硫辛酸在实验性神经细胞老化过程中对内源性谷胱甘肽水平的影响
张 毅 苗 玲 苏 敏 蔡 琰
上海交通大学医学院附属仁济医院神经内科 上海 200127
本文进一步分析硫辛酸对内源性抗氧化剂谷胱甘肽(GSH)的影响,以探讨硫辛酸抗氧化、保护神经细胞的机制。
1 材料与方法
1.1 主要试剂和设备 硫辛酸(纯品原料)有上海现代制药有限公司提供,所用细胞株是美国新墨西哥洲洲立大学Davise教授馈赠的小鼠神经母细胞瘤细胞A2(NBA2)。高糖改良 Eagle培养基(DMEM)、0.25%胰蛋白酶(含 EDTA)、磷酸缓冲液(PBS)为美国invitrogen公司产品;牛血清白蛋白、胰岛素是Sigma公司产品;DMSO是AMRESCO公司产品;MTT和小牛血清购自上海华美生物公司;GSH分析试剂和考马斯亮蓝蛋白测定试剂购自南京建成生物工程有限公司。CO2细胞培养箱:TABAI MFG.有限公司(日本);超净工作台:苏州净化设备厂(中国);Nicon倒置相差显微镜:Nicon公司(日本);Bio-Rad 680酶标仪:Bio-Rad公司(美国);7200分光光度计:尤尼柯(上海)仪器有限公司(中国)。
1.2 培养液准备 牛血清培养液(BD):DMEM中含小牛血清10%,pH 7.2,无血清培养液(AI):DMEM 中含500mg牛血清白蛋白和5mg胰岛素,pH 7.2。含硫辛酸培养液(LA):在AI中加入硫辛酸,配制成含100μmol/L硫辛酸的无血清培养液。
1.3 细胞培养 依据实验性神经细胞老化模型建立方法[1],采用无血清培养液(AI)在96孔培养板和25cm2的细胞培养瓶中培养NBA2细胞。设立硫辛酸实验组(LA组)和无血清对照组(AI组),LA组培养液为含100μmol/L硫辛酸的AI培养液,2组均设5d、10d和15d时间组;细胞在37℃、5%CO2培养箱中培养。
1.4 用MTT法检测神经细胞存活数 接种在96孔板中各组细胞(1.0×104个/孔)培养至5d、10d和15d时同时终止培养,各孔中加入新鲜配制的5mg/mL的MTT溶液20 μL,继续在37℃、5%CO2培养箱中孵育4h,然后去除溶液,每孔中加入150μL DMSO,震荡10min溶解结晶,最后在酶标仪上用570nm波长测定各孔的吸光度,吸光度的大小反映了存活的细胞数量。以5d对照组为标准,细胞存活率定为100%,其他各组吸光度与之相比,得到细胞相对存活率。每组重复8次,取平均值。
1.5 测定GSH含量 接种于25cm2的细胞培养瓶中细胞(7×105个/瓶)在培养至5d、10d和15d时终止培养,各组细胞用0.25%胰蛋白酶消化制备单细胞悬液,PBS洗涤2次,3次冻融破碎细胞,取各组细胞上清液用比色法测定并计算GSH含量(具体操作按照试剂盒说明书),各组均重复5次,取平均值,同时用考马斯亮蓝法测定蛋白含量(按试剂盒说明操作)。
1.6 统计学处理 使用SPSS 11.0统计软件对数据进行分析,计量数据采用均数±标准差(±s)表示,进行ANOVA分析。P<0.05为差异有统计学意义。
2 结果
2.1 硫辛酸对老化的实验性神经细胞存活率的影响 100 μmol/L LA实验组和AI对照组细胞存活率见表1。
2.2 硫辛酸对实验性神经细胞内GSH水平的干预 各组细胞内GSH含量见表2。
表1 硫辛酸对神经细胞老化过程中细胞存活率的影响 (n=8,±s,%)

表1 硫辛酸对神经细胞老化过程中细胞存活率的影响 (n=8,±s,%)
注:与同时期对照组比较,*P<0.05
组别5d 10d 15d AI对照组100.00±14.79 75.45±10.78 28.54±3.13 LA组 212.48±12.22* 200.55±28.29* 96.81±14.46*
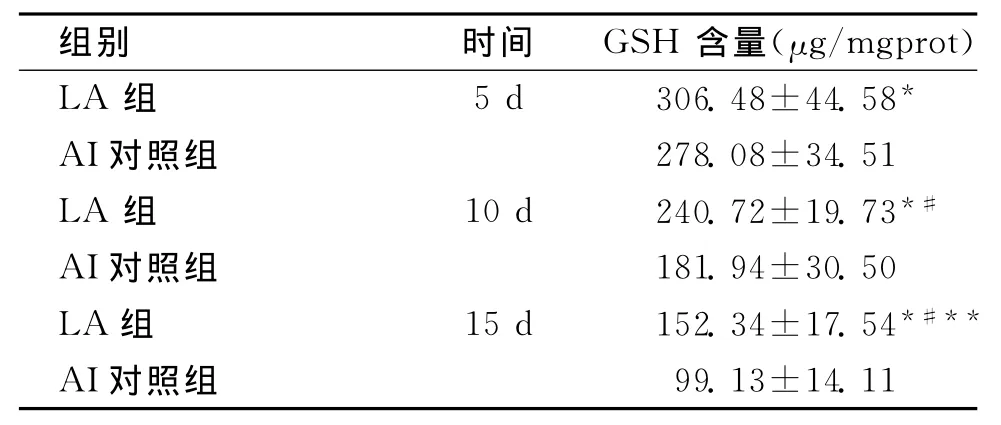
表2 硫辛酸对神经细胞老化过程中细胞内GSH水平的影响 (重复次数n=5,x¯±s)
3 讨论
谷胱甘肽(GSH)和超氧化歧化酶(SOD)是细胞内重要的清除自由基、抗氧化损伤的物质,SOD能促使超氧阴子自由基变为氧分子和过氧化氢,并通过其他酶系的进一步作用而清除,抵抗膜脂质过氧化作用,保护细胞免受氧化损害。GSH是细胞内一种低分子量硫醇抗氧化剂,主要通过两种ATP依赖酶(γ-谷氨酰胱氨酸连接酶,GSH合成酶)合成,作为重要的内源性抗氧化剂,在清除过多ROS,保护细胞对抗氧化损伤方面起关键作用。这些内源性抗氧化剂反映了细胞自身的抗氧化能力。
我们以往研究结果提示,硫辛酸对神经细胞具有保护作用,能够减少老化细胞内的脂质过氧化损伤;在抗氧化分析中,虽然发现对SOD活性有一定的提升作用,但是其对SOD的作用并不显著[2]。本文继续采用已建立的神经细胞老化模型,进一步分析硫辛酸对细胞内源性抗氧化剂GSH的作用。结果显示,尽管老化过程中GSH水平也明显下降,但是与对照组比较,硫辛酸能显著提高细胞内还原型谷胱苷肽水平。结果说明硫辛酸具有促进细胞内源性抗氧化剂GSH水平提高的作用。我们已经知道硫辛酸自身具有超强的抗氧化能力,是许多其他抗氧化剂所不能及的[3-4]。我们的结果提示硫辛酸可能通过直接清除ROS和调动细胞内在抗氧化剂双重作用保护神经细胞对抗氧化应激。Jia等[5]在SHSY5Y细胞上的研究同样得到硫辛酸能通过上调GSH等内源性抗氧化分子保护细胞。
细胞老化的基本特征之一是细胞内过氧化反应产物的积聚增多,公认的老化指标——脂褐素的形成与脂质过氧化反应产物在细胞内的积聚密切相关。神经细胞老化涉及到与ROS相关的氧化应激[6]。氧化损伤是老化和与老化相关的许多神经系统退行性疾病的重要因素[7-8]。因此抗氧化越来越成为抗老化、保护神经细胞和预防及治疗与老化相关的神经退行性疾病的重要策略和措施,相关药物在神经系统疾病治疗中应用越来越广泛[9]。
硫辛酸作为外源性抗氧化剂,对细胞抗氧化能力的提升以及对细胞的保护作用除了与直接清除ROS、自身抗氧化功效有关外,对内源性抗氧化物质的诱导也值得关注。
(致谢:感谢上海现代制药股份有限公司对本工作的大力支持和帮助)
[1]蔡琰,沈金坤,陆荣华 .神经细胞老化实验研究模型:无血清条件下培养小鼠神经母细胞瘤细胞[J].实验生物学报,1985,18(6):453-458.
[2]张毅,苗玲,苏敏,等 .硫辛酸在神经细胞老化过程中的细胞保护作用研究[J].中国老年学杂志,2009,29(13):1 161-1 163.
[3]Trujillo M,Radi R.Peroxynitrite reaction with the reduced and the oxidized forms of lipoic acid:New insight into the reaction of peroxynitrite with thiols[J].Arch Biochem Biophys,2002,397:91-98.
[4]Navari-Izzo F,Quartacci MF,Sgherri C.Lipoic acid:a unique antioxidant in the detoxification of activated oxygen species[J].Plant Physiol Biochem,2002,40:463-470.
[5]Jia Z,Hallur S,Zhu H,et al.Potent upregulation of glutathione and NAD(P)H:quinone oxidoreductase 1by alpha-lipoic acid in human neuroblastoma SH-SY5Ycells:protection against neurotoxicant-elicited cytotoxicity[J].Neurochem Res,2008,33(5):790-800.
[6]Barja G.Aging in vertebrates and the effect of caloric restriction:a mitochondrial free radical production-DNA damage mechanism[J].Biol Rev Camb Philos Soc,2004,79(2):235-251.
[7]Gustavo Barja.Free radicals and aging[J].Trends in Neurosciences,2004,27:595-600.
[8]Trushina E,McMurray CT.Oxidative stress and mitochondrial dysfunction in neurodegenerative diseases[J].Neuroscience,2007,145(4):1 233-1 248.
[9]宋妤 .依达拉奉在神经系统疾病的应用[J].中国实用神经疾病杂志,2008,11(12):131-133.

