人丙酮酸羧化酶异位表达提高中国仓鼠卵巢细胞补料分批培养后期活率
付 托,张存超,靖 钰,蒋 成,张学光,寇 庚
(1.苏州大学医学生物技术研究所,江苏 苏州215007;2.第二军医大学肿瘤研究所,上海200433)
中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞是目前利用重组DNA技术表达重组蛋白最理想的表达系统[1],其表达的外源蛋白更接近天然构象。目前,延长细胞生长周期、提高活细胞密度、控制代谢抑制物积累是CHO细胞研究的热点。
通过操纵细胞凋亡途径可以影响细胞的生长周期和营养代谢途径。Dorai等[2]报道抗凋亡基因的表达能改变CHO细胞的乳酸代谢;Jeon等[3]报道在二氢叶酸还原酶缺陷型CHO细胞培养中,ldh-a和bcl-2的共表达能减少乳酸的生成并促进细胞生长。因此,调节代谢抑制物的代谢通路,通过影响相关酶的活性和表达可以减少代谢抑制物的累积。乳酸是动物细胞培养过程中的主要代谢废物之一[4]。Zhou等[5]报道,CHO细胞中乳酸脱氢酶和丙酮酸脱氢酶激酶表达的下降能降低乳酸水平并促进抗体的生成。
人丙酮酸羧化酶(Human pyruvate carboxylase,hPC)是回补途径的一个代谢酶,能将丙酮酸转换成草酰乙酸,从而连接糖酵解途径和三羧酸循环。Kim等[6]研究发现,CHO细胞DG44中hPC的功能性表达能减少乳酸的形成;Easlon等[7]研究发现,在酵母线粒体内过表达苹果酸脱氢酶有延长酵母寿命的作用;Chong等[8]报道在表达单克隆抗体的重组CHO细胞中过度表达丙酮酸羧化酶会促进细胞的生长。
作者在此以实验室改造的宿主细胞CHO-K1为研究对象,考察hPC异位表达对其表型的影响,期望获得细胞生长得到改善的细胞株,为后续的重组蛋白表达提供改善的宿主细胞。
1 实验
1.1 材料、试剂与仪器
实验所用细胞 CHO-K1、大肠杆菌E.coli TG1,均为自行保存。
限制性内切酶、PCR试剂及酶类、反转录试剂,Takara公司(TaKaRa Code:DRR037A);G418试剂,Roche公司;DNA片段小量胶回收试剂盒(W5001)、质粒小量抽提试剂盒(W5211),上海华舜公司;RNA提取试剂(货号:740955.50),MACHEREY-NAGEL公司;淋巴细胞分离液,上海华精生物高科技有限公司;连接试剂盒,Promega公司;转染试剂盒Lipofectamin 2000,Invitrogen 公 司;ABI 7500 型 Realtime PRC器;葡萄糖氧化酶法试剂盒,南京建成生物。
1.2 方法
1.2.1 hPC表达载体的构建
1.2.1.1 hPC-pGEM-T克隆载体的构建
由GenBank获得hPC的序列(NM_000920.3,编码区核苷酸的长度为3537bp),按照引物设计的基本原则,设计相应引物(表1),尽量在PCR反应的扩增特异性和扩增效率之间取得平衡。以编码序列中的XhoI酶切位点为界限,将目的序列分为两段进行扩增,记为hPC-1和hPC-2。引物合成由上海生工生物技术公司完成。

表1 hPC分段扩增引物及PCR条件Tab.1 Primers and PCR conditions of hPC amplification
通过分离人血液淋巴细胞,提取mRNA并反转录获得cDNA,以此作为PCR模板,相关操作按照淋巴细胞分离液和反转录试剂操作说明书进行。PCR采用Taq酶进行,退火温度为50℃,循环数为30个。PCR产物在1.5%琼脂糖凝胶中进行电泳,并将目的条带胶回收。胶回收后,将目的产物与pGEM-T载体按照Promega试剂盒操作说明书进行连接。
以连接产物转化E.coli TG1感受态细菌(TSS法制备),转化时取一管(100μL)感受态细菌,加入10μL PCR上述连接产物,轻轻混匀后冰浴30min,42℃热激90s,再冰浴2min。加入450μL含20 mmol·L-1葡萄糖的LB培养液,37℃、200r·min-1下温和振荡培养60min,取100μL涂布氨苄青霉素抗性平板。涂布后的平板在室温放置约20min后置于37℃恒温培养箱过夜培养(17~20h)。挑选抗性克隆接种于LB培养液,37℃、280r·min-1下培养过夜并进行质粒抽提(操作按照质粒小量抽提试剂盒说明书进行)。所获质粒经酶切后,进行琼脂糖电泳检测。选取含有目的条带的质粒送样测序。
1.2.1.2 hPC-pcDNA 3.0表达载体的构建
将测序结果正确的hPC-pGEM-T载体与pcDNA 3.0表达载体分别经酶切后,在1.5%琼脂糖凝胶中进行电泳,回收hPC基因及酶切后的pcDNA 3.0。将上述回收产物连接并转化E.coli TG1感受态细菌,置于37℃培养箱培养过夜。挑选抗性菌株提取质粒并进行酶切鉴定,选取酶切结果与预期一致的质粒测序验证。
1.2.2 hPC转染与筛选
使用转染试剂盒Lipofectamin 2000,以获得的hPC-pcDNA 3.0表达载体与pcDNA 3.0空载体分别转染CHO-K1细胞,具体操作按照说明书进行。转染后阳性细胞筛选使用G418试剂进行,筛选浓度为800 μg·mL-1。获得G418抗性细胞库后,用有限稀释法获得克隆[9]。有限稀释法所用培养基为16/DM+10%FBS+Gln+0.8mg·mL-1G418,在96孔板中获得克隆后转移到24孔板中进行培养。在24孔板中传代时,逐步减少血清含量,使之适应到300F无血清培养基(实验室自制),在此培养基中添加2mmol·mL-1Gln及0.8mg·mL-1G418,获得悬浮培养的克隆,用于后续鉴定。
1.2.3 hPC的荧光定量PCR检测
将上述阳性克隆进行荧光定量PCR鉴定,以检测hPC的相对含量。以β-actin基因作内参,hPC进行荧光定量PCR的引物[10]为:F:tgaagttccgaacagtccat;R:agagtagatggctacggtg,此引物能特异性扩增转染的hPC,而不能扩增CHO中的PC。PCR采用Taq酶进行,采用两步法,退火/延伸为60℃、35s,循环数为25个。
1.2.4 hPC转染效果的验证
将经过筛选的含hPC-pcDNA 3.0表达载体的CHO-K1细胞以及转入空载体的CHO-K1细胞在100mL摇瓶中进行补料分批培养。初始接种浓度为5×105个·mL-1,培养体积为30mL。接种细胞时记为第0h,每隔24h取样200μL细胞悬液用台盼蓝染色并计数,计算每日的活细胞密度(Viable cell density,VCD)与细胞活率(Viability)。初始培养基为300 F+4mmol·L-1Gln,72h添加3%300S及1mmol·L-1Gln并添加葡萄糖至2.5g·L-1。之后,每天补葡萄糖至2.5g·L-1;隔天补1mmol·L-1Gln。当细胞活率普遍低于70%时停止培养。
2 结果与讨论
2.1 hPC基因克隆及表达载体的构建
2.1.1 hPC基因分段克隆
hPC基因以XhoI为界,分为两段分别克隆。前、后段分别记为hPC-1和hPC-2,长度分别为1666bp和1871bp。hPC基因经PCR扩增后,在1.5%琼脂糖凝胶中电泳,回收目的条带并与pGEM-T载体连接。
2.1.2 表达hPC的E.coli阳性菌株挑选
以hPC前后段分别与pGEM-T载体的连接产物转化E.coli TG1感受态细菌,并分别挑选具有氨苄青霉素抗性的克隆5个。将这10个克隆在摇瓶中培养后抽提质粒,含有hPC-1、hPC-2的克隆载体分别用HindⅢ、XhoⅠ及Eco RⅠ、XhoⅠ酶切,电泳结果见图1。

图1 挑选菌株中质粒酶切电泳鉴定结果Fig.1 Electrophoresis results of hPC inserted vector from picked clone
由图1可看出,hPC-1-pGEM-T质粒1#、2#的条带位置与预期一致,hPC-2-pGEM-T质粒8#的条带与预期一致,将这些质粒用于测序鉴定。结果显示,hPC-1的1#克隆和hPC-2的8#克隆中目的条带序列与预期一致,可用于表达载体构建。
2.1.3 表达载体的构建
hPC-1的1#克隆和hPC-2的8#克隆中质粒分别用HindⅢ、XhoⅠ及Eco RⅠ、XhoⅠ双酶切,并回收PC-1及PC-2,两者与经 Hind Ⅲ、Eco RⅠ酶切之后的pcDNA 3.0表达载体连接。连接产物经转化、挑选克隆、克隆培养及质粒提取后,获得的质粒1#~5#均用Eco RⅠ、XhoⅠ和HindⅢ酶切,并在1.5%琼脂糖凝胶中电泳,结果见图2。
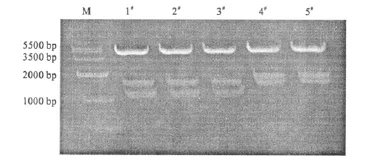
图2 表达载体酶切电泳鉴定结果Fig.2 Expression vectors verified by electrophoresis after digestion by Eco RⅠ,XhoⅠ and Hind Ⅲ
由图2可看出,克隆1#、2#和3#中的相应质粒经酶切后的片段大小与预期一致。挑选1#质粒测序,显示其PC序列与目的序列一致,可用于后续实验。至此,已成功构建表达载体hPC-pcDNA 3.0。
2.2 hPC的mRNA水平鉴定
以hPC-pcDNA 3.0和pcDNA 3.0载体分别转染CHO-K1,转染使用试剂 Lipofectamin 2000。转染后挑选G418抗性克隆并提取总RNA,用荧光定量PCR法鉴定hPC的表达,结果见图3。

图3 Real-time PCR鉴定hPC的 mRNA水平Fig.3 Relative hPC mRNA quantity determined by real-time PCR
由图3可看出,2#、4#和6#均表达hPC,而且4#克隆的hPC表达量最高,将其用于后续实验,记为hPC 4#。
2.3 hPC表达对CHO细胞生长及活率的影响
以hPC 4#克隆为研究对象,考察hPC异位表达对CHO细胞生长和活率的影响。培养方式为补料分批培养,每24h计数,并绘制生长曲线,如图4所示。以转染pcDNA 3.0的克隆4#作为对照。

图4 hPC异位表达对细胞生长和活率的影响Fig.4 Effect of hPC ectopic expression on cell growth and viability
由图4可看出,培养前期,hPC 4#细胞的活细胞密度和活率与对照没有明显差别;培养6d后,hPC 4#细胞的活细胞密度与活率明显高于对照。这表明,hPC在CHO细胞中表达改善了细胞的生长,并提高了补料分批培养后期细胞的活率。
2.4 讨论
hPC在CHO细胞中表达提高了活率,这可能是由于,hPC表达抑制了细胞凋亡,进而提高了细胞活率。hPC表达是否抑制了凋亡,以及通过何种方式抑制凋亡,还需要进一步研究确定。
在无血清培养基中添加pH值指示剂酚红进行实验。结果发现,细胞培养后期,hPC表达的细胞培养上清颜色比对照偏红,说明其培养上清pH值高于对照。由于在补料分批培养后期,乳酸是影响pH值的重要因素,因此hPC表达可能减少乳酸生成。因此,hPC对细胞的作用也可能是通过减少乳酸累积来进行的。在细胞培养前中期,乳酸积累量较少,对细胞生长未有明显抑制作用,而到后期,乳酸累积的抑制作用明显。hPC的表达可增加碳进入TCA循环的流量,减少乳酸的积累,从而提高活细胞密度与活率,并延长细胞培养时间。
3 结论
成功构建了人丙酮酸羧化酶(hPC)表达载体,将其转入CHO-K1细胞中表达,并对重组细胞生长情况进行验证。结果表明,hPC异位表达能提高CHO细胞在培养后期的活率,获得了生长改善的细胞株,为后续的重组蛋白表达研究与细胞培养工艺优化奠定了基础。
[1]Lin S C,Leng C H,Wu S C.Generating stable Chinese hamster ovary cell clones to produce a truncated SARS-CoV spike protein for vaccine development[J].Biotechnol Prog,2010,26(6):1733-1740.
[2]Dorai H,Kyung Y S,Ellis D,et al.Expression of anti-apoptosis genes alters lactate metabolism of Chinese hamster ovary cells in culture[J].Biotechnol Bioeng,2009,103(3):592-608.
[3]Jeon M K,Yu D Y,Lee G M.Combinatorial engineering of ldh-α and bcl-2for reducing lactate production and improving cell growth in dihydrofolate reductase-deficient Chinese hamster ovary cells[J].Appl Microbiol Biotechnol,2011,92(4):779-790.
[4]Miller W M,Wilke C R,Blanch H W.Effects of dissolved oxygen concentration on hybridoma growth and metabolism in continuous culture[J].J Cell Physiol,1987,132(3):524-530.
[5]Zhou M,Crawford Y,Ng D,et al.Decreasing lactate level and increasing antibody production in Chinese hamster ovary cells(CHO)by reducing the expression of lactate dehydrogenase and pyruvate dehydrogenase kinases[J].J Biotechnol,2011,153(1-2):27-34.
[6]Kim S H,Lee G M.Functional expression of human pyruvate carboxylase for reduced lactic acid formation of Chinese hamster ovary cells(DG44)[J].Appl Microbiol Biotechnol,2007,76(3):659-665.
[7]Easlon E,Tsang F,Skinner C,et al.The malate-aspartate NADH shuttle components are novel metabolic longevity regulators required for calorie restriction-mediated life span extension in yeast[J].Genes Dev,2008,22(7):931-944.
[8]Chong W P,Reddy S G,Yusufi F N,et al.Metabolomics-driven approach for the improvement of Chinese hamster ovary cell growth:Overexpression of malate dehydrogenase Ⅱ [J].J Biotechnol,2010,147(2):116-121.
[9]Freshney R I.Culture of Animal Cells:A Manual of Basic Technique(Fifth Edition)[M].John Wiley & Sons,2005:221-222.
[10]Chusainow J,Yang Y S,Yeo J H,et al.A study of monoclonal antibody-producing CHO cell lines:What makes a stable high producer[J].Biotechnol Bioeng,2009,102(4):1182-1196.

