嗜酸性乳杆菌MG株S层蛋白的高级结构预测分析及原核表达
王 敏,小 琴,那日苏,2,王彩凤,特尼格尔,赵 慧,格日勒图*
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特010018;2.内蒙古锡林郭勒职业学院,内蒙古锡林郭勒026000)
S层蛋白(S-layer protein,SLP)位于细菌细胞的最外层,是一类表面结构蛋白,这层结构对细菌细胞的生存及完整性有着很重要的作用[1]。S层蛋白是由蛋白质或糖蛋白亚基组成的单分子晶体点阵,它们形成有孔的网格结构覆盖在细胞表面[2]。S层蛋白具有方形或六边形对称结构,分子质量为40ku~200ku,大量的研究表明,S层蛋白可能与细菌的黏附有关[3-4]。关于细菌S层蛋白应用方面的研究逐渐兴起,如生物技术、纳米技术、纳米生物技术和仿 生技术 等[5-6]。S层蛋白也存在于某些乳杆菌属的细菌表面,如嗜酸乳杆菌、短小乳杆菌、瑞士乳杆菌、弯曲乳杆菌、鼠李糖乳杆菌、鸡乳杆菌等。现在普遍认为S层蛋白是某些乳酸菌的黏附素之一[7]。
嗜酸乳杆菌与肠黏膜上皮细胞相互作用、密切结合构成了生物学屏障,通过其自身及其代谢物与其它细菌之间的相互作用,阻止了致病菌的定植和入侵,拮抗致病菌和有害微生物的生长及其毒素的黏附[8]。该菌能分泌包括S层蛋白在内的多种蛋白或酶,促进蛋白质的消化吸收,并抑制了致癌物质的产生,其代谢物活化了免疫功能,抑制宿主癌细胞的形成和增殖[9]。但是S层蛋白在这些过程中如何发挥作用尚未见到相关研究报道。
本试验对分离自内蒙古的嗜酸性乳杆菌MG株的slp基因氨基酸序列进行高级结构预测,并构建了slp基因的原核表达载体pGEX-slp,经IPTG诱导获得成功表达,得到GST融合的S层蛋白。该融合蛋白的成功表达为进一步研制相关的生物制品奠定了基础。
1 材料与方法
1.1 材料
1.1.1 质料与菌种 嗜酸性乳杆菌MG株,由内蒙古农业大学乳品生物技术与工程教育部重点实验室分离并保存;pMD-19T,宝生物工程(大连)有限公司产品;pGEX4T-3,Invitrgen公司产品;E.coli DH5α、E.coli BL21均由本实验室保存。
1.1.2 试剂与仪器 普通质粒小提取试剂盒,Tiangen公司产品;Taq DNA 聚合酶、XhoⅠ、BamHⅠ、pMD-19T,胶回收试剂盒,均购自Takara公司;鼠抗GST血清,日本带广畜产大学原虫病研究中心制备;绵羊抗鼠IgG-HRP,Invitrogen公司产品;氨苄青霉素,Sanland-chem公司产品。
冷冻离心机,PCR仪,电泳仪(DYY-12型),凝胶成像系统。
1.1.3 引物设计 用Primer premier 5.0软件设计一对引物并由上海桑尼公司合成,预计扩增片段长度为1 200bp:
上 游 引 物Pacid-F:5'-GCCGGATCCATTGTTAGCGCTCCTG-3'(下划线处为BamHⅠ酶切位点);下 游 引 物Pacid-R:5'-CACCTCGAGTTAGACCCGACGGCCA-3'(下划线处为XhoⅠ酶切位点)。
1.2 方法
1.2.1 嗜酸性乳杆菌MG株的slp基因的扩增与克隆 参照双杰等[10]的方法,提取嗜酸性乳杆菌MG株基因组DNA,以其为模板,设计一对特异性引物,扩增slp基因片段,PCR反应具体程序如下:95℃预变性5min;95℃1min,55℃1min,72℃1.5min,25个循环;72℃延伸10min。PCR产物经15g/L琼脂糖凝胶电泳鉴定,回收slp基因片段,16℃与pMD19-T载体进行连接反应,连接产物转化到E.coli DH5α感受态细胞,涂布于含有Amp抗性的平板,37℃进行过夜培养,试剂提取重组克隆质粒,经PCR和酶切鉴定,筛选阳性克隆测序,将该质粒命名为pMD-slp。
1.2.2 SLP蛋白质的三级结构预测 应用CPH models-3.0(http://www.cbs.dtu.dk/services/CPHmodels)在线软件对SLP蛋白质进行高级结构预测;并利用同源建模原理使用Swiss-Model和Swiss-PdbViewer软件获得了SLP蛋白质的高级结构3D模拟图。
1.2.3 原核表达载体pGEX-slp的构建 用BamHⅠ和XhoⅠ对pMD-slp进行双酶切,胶回收纯化slp基因片段,将其定向克隆到经同样酶切的pGEX-4T-3表达载体上,转化到E.coli DH5α感受态细胞,酶切鉴定重组表达载体pGEX-slp,并在上海生工生物工程技术服务有限公司进行测序验证。
1.2.4 重组蛋白SDS-PAGE分析 参照分子克隆实验指南(第3版)[11]提供的原核表达方法,将含有重组表达载体的BL21菌液,37℃振荡培养至OD 600nm值达到0.6左右时,加入IPTG(终浓度为0.5mmol/L)进行诱导表达5h,取样后12 000 r/min离心5min收集菌体,加1×SDS凝胶上样缓冲液,煮沸10min后,冰浴5min,12 000r/min离心5min,取10μL上清上样于120g/L的SDSPAGE胶,进行电泳,经考马斯亮蓝染色,检测蛋白表达情况。
1.2.5 Western blot检测 将SDS-PAGE胶上的目的条带转印至硝酸纤维素膜上,用50g/L脱脂乳4℃封闭过夜,加鼠抗GST血清(一抗,1∶1 000稀释)室温作用1h,PBS缓冲液洗3次,每次15min;加入辣根过氧化物酶(HRP)标记的绵羊抗鼠IgG抗体(二抗,1∶5 000稀释)室温作用1h,PBS缓冲液洗3次,每次15min,在二氨基联苯胺(DAB)缓冲液中显色。
2 结果
2.1 slp基因的PCR扩增产物
嗜酸性乳杆菌slp基因PCR扩增产物经10 g/L琼脂糖凝胶电泳进行鉴定,结果发现在位于约1 260bp处有一条特异性DNA扩增条带,与预期理论值大小一致(图1)。

图1 slp基因的PCR扩增产物Fig.1 The amplification of slp gene by PCR
2.2 重组载体pGEX-slp的酶切鉴定和PCR鉴定
嗜酸性乳杆菌slp基因大小约为1 200bp,pGEX-4T-3大小约为5 500bp,将重组质粒pGEX-slp用BamHⅠ和XhoⅠ双酶切后,在琼脂糖凝胶电泳图谱上,分别出现约5 000bp和1 200bp左右的特异性条带(图2)。PCR鉴定结果如图3所示,在2 000bp和1 000bp之间有一特异性条带,符合理论值1 260bp的大小。
2.3 嗜酸性乳杆菌SLP蛋白质的氨基酸序列预测
应用Genetyx生物软件推导出的SLP蛋白质氨基酸序列,嗜酸性乳杆菌MG株的SLP蛋白共由414个氨基酸组成(图4)。
2.4 SLP蛋白质的高级结构预测
应用3种在线软件对SLP蛋白质进行高级结构预测结果如图5(A~C)所示,3种不同软件预测出3D空间结构惊人相似,表明预测结果的高重复性。
2.5 SDS-PAGE与Western blot分析结果
对重组菌经IPTG诱导表达后的产物进行SDS-PAGE电泳分析。如图6所示,IPTG诱导5h后在70ku处出现了条带(第2泳道),而未加IPTG的同一个菌样在同一时间未出现类似条带(第1泳道)。以鼠抗GST血清为一抗,对IPTG诱导表达产物进行Western blot的结果如图7所示,试验组重组菌样品(含pGEX-slp)约在70ku处出现特异性条带,与SDS-PAGE结果相符,并在27ku处也出现与对照组样品(含pGEX-4t-3空质粒)相同的条带(泳道2)。而对照组样品(含pGEX-4t-3空质粒)除了27ku处的特异性条带以外还有一条明显大于70ku的非特异性条带(泳道1)。
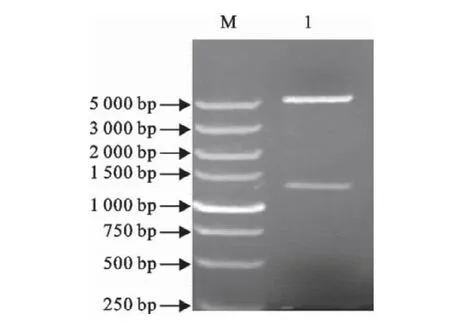
图2 重组载体的pGEX-slp的双酶切鉴定Fig.2 Identification of recombinant plamid pGEX-slp by BamHⅠand XhoⅠdigestion

图3 重组载体的PCR鉴定Fig.3 Identification of the recombinant plasmid pGEX-slp by PCR

图4 SLP蛋白质的氨基酸序列Fig.4 Amino acid sequence of SLP protein

图5 slp的3D预测结果Fig.5 Prediction results of slp 3D
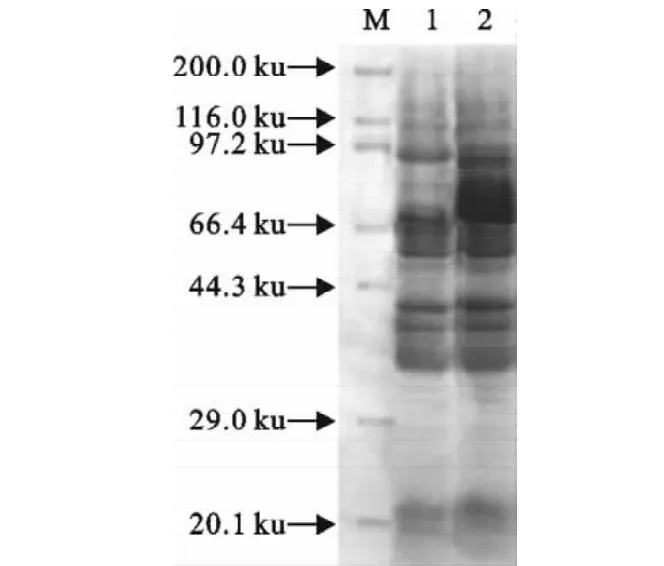
图6 SLP蛋白表达的SDS-PAG鉴定结果Fig.6 Identification of the expression of SLP proteinsby SDS-PAGE

图7 SLP蛋白Western blot鉴定结果Fig.7 Identification of the expression of SLP proteins by Western blot
3 讨论
细菌S层蛋白因其本身具有的单分子晶体层结构,从而使其具有佐剂的活性,能够将抗原表位或者蛋白质展示在细胞表面,是一种高效的携载抗原的物质[12]。S层蛋白的C端可以融合抗原蛋白,使其准确嵌入到S层蛋白晶格中,然后具有活性的融合蛋白部分就能够被锚定在细胞膜表面[13-14]。现在许多的在线生物软件可以通过同源建模的原理,能够预测蛋白质的高级结构。本试验用CPHmodels,Swiss-Model和Swiss-PdbViewer 3种软件对嗜酸性乳杆菌SLP蛋白质高级结构预测结果发现,3种不同的软件预测SLP蛋白的结构相似性很高,其中α螺旋占3.33%,线性结构占45%,无规则卷曲占51.67%,亲水性氨基酸占59.1%。1~20氨基酸为N端信号肽跨膜结构域,充分展现出外膜蛋白质的特性。这对今后slp基因的遗传改造,进一步膜蛋白质特性分析以及嵌入外源基因提供了理论依据。S层蛋白质结构上的这种信号肽活性以及疏水性等特性与Hein J B等[15]报道结果极其相似,国内尚未见类似报道。
本试验构建了原核表达载体pGEX-slp并经IPTG诱导有效表达出GST融合的SLP蛋白质。Western blot鉴定试验结果表明该融合蛋白可被鼠抗GST抗体所识别。在试验组重组菌样品(含pGEX-slp质粒)中出现了2个条带,大小分别约为70ku和27ku,前者与SLP和GST融合后的蛋白质分子质量大小基本吻合,后者与GST融合蛋白大小基本吻合。这表明SLP融合蛋白不稳定,容易裂解,其原因可能与slp基因的信号肽序列表达产物的断裂有关,因为本试验中slp基因进行融合的时候信号肽序列部分未进行剪切。由于断裂以后的SLP部分不会被鼠抗GST血清所识别,所以Western blot鉴定试验结果中未出现该条带。此外,在对照组样品试验中,除了GST实际大小吻合的27 ku的特异性条带以外还出现了明显大于70ku的非特异性条带,其原因仍需要进一步试验研究来证实。本试验为重组蛋白SLP的生物活性和相关应用的进一步研究奠定了基础。
[1] Sara M.Conserved anchoring mechanisms between crystalline cell surface S-layer protein and secondary cell wall polymers in Grampositive bacteria[J].Trends in Microbiol,2001,9(2):47-50.
[2] Schuster B,Sleytr U B.S-layer-supported lipid membranes[J].J Biotechnol,2000,74(3):233-254.
[3] Sara M,Sleytr U B.S-layer proteins[J].Bacteriology,2000,182:859-868.
[4] Sleytr U B,Beveridge T J.Bacterial S-layers[J].Trends in Microbiol,1999,7:253-260.
[5] Sleytr U B,Huber C,Ilk N,et al.S-layer proteins of Lactobacillus brevis[J].FEMS Microbiol Lett,2007,267(2):131-186.
[6] Debabov V G.Bacterial and archaeal S-layer as object of bionanotechnology[J].Molekuliarnaia Biologiia,2004,38(4):578-591.
[7] 刘 琼,王春凤,杨桂连,等.嗜酸乳杆菌S-层蛋白表面展示系统的构建及酶切位点分析[J].安徽农业科学,2011(30):2-20.
[8] 牛生洋,赵瑞香,孙俊良.嗜酸乳杆菌在现代乳品中的应用研究进展[J].中国乳品工业,2005,33(10):31-34.
[9] 张 帆,建 华,刘立恒等.嗜酸乳杆菌的培养条件及其生物学特性[J].食品与发酵工业,2005,31(3):43-46.
[10] 双 杰,包秋华,永 胜等.几种乳酸菌S-层蛋白的普查以及slp基因的克隆与序列分析[J].中国乳品工业,2010(8):8-10.
[11] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2002:1228-1231.
[12] Helga T,Kathy P.Display of a peptide mimotope on a crystalline bacterial cell surface layer(s-layer)lattice for diagnosis of epstein-barr virus infection[J].Bioconjugate Chem,2008,19(4):860-865.
[13] 王莉莉,杨晓临,周正任.嗜酸性乳杆菌细胞壁提取成分对小鼠小肠上皮内淋巴细胞免疫功能的影响[J].中国微生态学杂志,1999(2):68-70.
[14] Chen C C,Louie S,Shi H N,et al.Preinoculation with the probiotic Lactobacillus acidophilus early in life effectively inhibits murine Citrobacter rodentiumcolitis[J].Pediatr Res,2005,58(6):1185-1191.
[15] Hein J B,Carin P A M K,Johannes M,et al.S-layer protein of Lactobacillus acidophilus ATCC4356:purification,expression in Escherichia coli,and nucleotid sequence of the corresponding gene[J].J Bacteriol,1993,175(19):6089-6096.
[16] Schuster B,Györvary E,Pum D,et al.Nanotechnology with S-layer proteins[J].Meth Mol Biol,2005,300:101-123.
[17] Hein J B,Carin P A M K,Peter H P.Identification cloning,and nucleotide sequence of a silent S-layer protein gene of Lactobacillus acidophilus ATCC4356which has extensive similarity with the S-layer protein gene of this species[J].J Bacteriol,1995,177(24):7222-7230.

