硫酸软骨素提取与纯化方法研究
陈婷 严凌苓 成长玉
(1.江西生物科技职业学院动科系,江西南昌 330200 ;2.达州市食品药品检验所,四川达州 635000)
硫酸软骨素(chondroitin sulfate,简称CS)是来自动物软骨组织的一类天然的酸性黏多糖(muc-opolysaccharide)——糖胺聚糖。研究发现,该物质主要是作为治疗风湿和类风湿疾病的药物。近年来,随着对其生理功能和生化性质研究的深入,发现CS 具有抗凝、抗炎、抗血栓、抗癌及降低心肌耗氧量,促进冠状动脉循环、降血脂、抗凝血和防止血管硬化等作用[1]。对冠心病、动脉粥样硬化、心绞痛、心肌缺氧、心肌梗塞等心血管疾病的治疗有一定疗效;还对神经细胞、粘膜细胞、肾细胞等具有保护作用;CS 还可活化脂解酶,使脂肪降解,因此是防止肥胖有效物质;CS 可与某些物质调制成化妆品用于保护皮肤的健美;CS 还具有保水性、保胶性和高粘性,我国出口到日本、韩国的CS 都被用作食品添加剂。因此CS 是国内外流行的保健品和化妆品以及医药品的重要原料[2]。
1 硫酸软骨素的概况
1.1 种类与分布
硫酸软骨素是一种酸性粘多糖——糖胺聚糖,有多种异构体,它们均由D-葡萄糖醛酸、N-乙酰-D-氨基半乳糖硫酸脂为单位组成。只是硫酸基团的位置不同而有A、C、D和E 四种异构体。
硫酸软骨素为结缔组织的基本成分,与其他粘多糖共存,分布很广。玻璃样软骨、颈韧带、角膜、骨、软骨肉肿、动脉、髓核、巩膜、齿、人血清、尿、牛脑及脊髓、鹿茸及鹿角、长吻角鳖软骨、乌贼皮中均含有。在软骨中的含量占干燥量的20~40%。玻璃样软骨中也由于动物种、年龄、部位、疾病等不同,硫酸软骨素的种类及量也不同。自然界中硫酸软骨素多存在于动物软骨、喉骨、鼻骨(猪含41%)、牛、马中膈和气管(含36%~39%)中,其他如腿骨、韧带、皮肤、角膜等组织中也含有。鱼类软骨中含量很丰富,如鲨鱼骨中含50%~60%,结缔组织中含量很少。腔肠动物、海绵动物、原生动物也含有硫酸软骨素。
1.2 化学结构
硫酸软骨素是氨基己糖和葡萄糖醛酸交替连接而成的直链分子,通常含有50~70个双糖单位,分子量为10000~50000D[3]。根据化学结构的不同硫酸软骨素可分为硫酸软骨素A、硫酸软骨素B、硫酸软骨素C、硫酸软骨素D和硫酸软骨素E 等多种类型,如下图所示[4]。
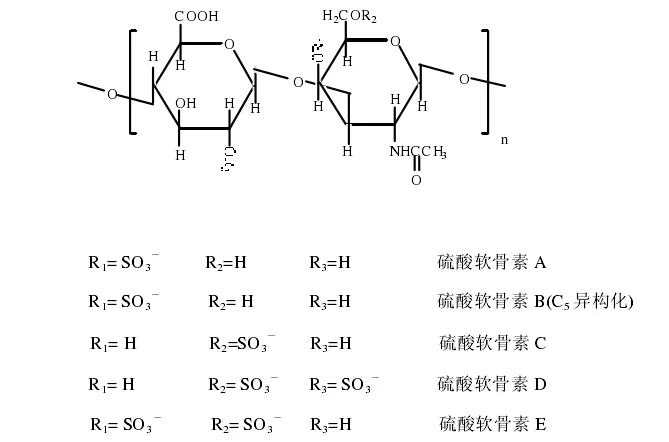
1.3 物理性质
硫酸软骨素为白色、无臭、略带咸味的固体粉末。由于其分子结构中带有羟基、羧基、硫酸基等极性基团,故具有较强的吸湿性、易溶于水、难溶于甲醇、乙醇、丙醇、丙酮、乙醚等多种有机溶剂。硫酸软骨素的水溶液呈粘稠性,在强酸、强碱及高温条件下易降解为分子量较小的低聚糖,导致溶液粘度下降[5]。
1.4 化学性质
多数硫酸软骨素含有-SO3H和-COOH 等基团,是一种聚阴离子的高分子化合物,易与Na+、K+、Ca2+、Mg2+等阳离子结合[6,7]。
1.4.1 还原性
硫酸软骨素含有半缩醛基,具有还原性,可将碱性酒石酸铜溶液中的Cu2+还原成红色的氧化亚铜。
1.4.2 降解反应
硫酸软骨素在中性低温条件下较稳定,而在高温强酸条件下易发生降解反应,使其分子量降低。硫酸软骨素也可在硫酸软骨素裂解酶ABC或硫酸软骨素裂解酶B 等的作用下发生降解。
1.4.3 沉淀反应
硫酸软骨素含有的硫酸基可与Ba2 +离子发生沉淀反应,沉淀物(BaSO4)在盐酸或硝酸中均不溶解。
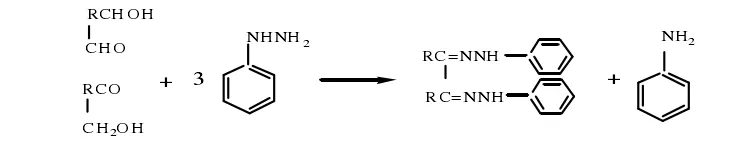
1.4.4 糖脎试验
硫酸软骨素可与苯肼在一定条件下发生反应生成糠脎[8]。
2 硫酸软骨素的提取
硫酸软骨素属于酸性黏多糖,广泛存在于动物的器官软骨,目前酸性黏多糖的提取方法主要有降解法和非降解法.非降解法仅用于非蛋白多糖的黏多糖—透明质酸,而降解法适用于包括透明质酸在内的所有酸性黏多糖。硫酸软骨素的提取采用降解法,降解法又包括碱提取法和蛋白酶提取法两种。根据这些性质,硫酸软骨素的提取方法有很多,归纳起来,主要有以下几种[9]:
2.1 中性盐法
先用l0%氯化钙提取,氯仿-戊醇(1:4)除去蛋白质,2倍量乙醇沉淀,最后以Lloyd 试剂精制。而以透析法除杂质、氯化六氨合钴纯化,或一磷钨酸纯化,均可使工艺简化。以30%氯化钾或30%氯化钾加1%碳酸钾提取,高岭土吸附除去杂蛋白,可提高产品收率。该方法提取的产品较白,各项指标符合国家标准,也不会造成环境污染,但是产率较低,造成原材料的大量浪费,对经济效益有一定的影响。
2.2 碱提取法
2.2.1 浓碱提取法
将粉碎好的软骨碎片称重后,加入骨质量1.5倍的l5%氢氧化钠溶液,室温下进行浸提l2~16 h(分两次进行),然后用盐酸调节pH 值到2.8~3.2,双层纱布过滤30 min,留下滤液。将滤液调节pH 到8.5~9.0,按骨质量的4%加入胰蛋白酶,于50~54℃水解6 h,用盐酸调节pH 到6.5,升高温度到80~90℃,加入活性炭进行脱色反应,然后过滤,在滤液中加入1.5倍体积的无水乙醇进行沉淀分层4h,所得沉淀即为硫酸软骨素,在60℃下干燥即得最终产品。
2.2.2 稀碱提取法
将粉碎好的软骨碎片称重后,加入骨质量6倍的2%氢氧化钠溶液,60℃下进行浸提24 h(分两次进行),然后用盐酸调节pH 值到2.5~3.0,双层纱布过滤,留下滤液。将滤液调节pH 值到8.5~9.0,按骨质量的4%加入胰蛋白酶,于5O~54℃水解7 h,用盐酸调节pH 到5~7,升高温度到80~90℃,加入0.5%活性炭进行脱色反应,然后过滤,在滤液中加入1.5倍体积的无水乙醇和1.5%的氯化钠溶液进行沉淀分层6h。所得沉淀再次加入1.5%的氯化钠溶液和3倍体积的无水乙醇进行沉淀,所得即为硫酸软骨素,然后在60~65℃下干燥即得最终产品。
2.3 碱盐法
2.3.1 稀碱稀盐提取法
将粉碎好的软骨碎片称重后,加入均为骨质量6倍的0.5%氢氧化钠和2%的NaC1 混合溶液,室温下进行浸提30 h(分两次进行),然后用盐酸调节pH 值到8.5~9.0,加入骨质量4%的胰蛋白酶进行水解。水解后升温到80~90℃,加入骨质量1.5%的滑石粉,过滤;加入1.7倍体积的无水乙醇进行沉淀,过滤后再加入1.5%的氯化钠溶液进行沉淀过滤;加入1.7倍体积的无水乙醇再次进行沉淀过滤,所得沉淀物于60℃下干燥即得最终产品。
2.3.2 稀碱浓盐提取法
将粉碎好的软骨碎片称重后,加入骨质量5倍的0.4%氢氧化钠和20%的氯化钠混合溶液(pH 值为13),室温下进行浸提30h(分两次进行);用盐酸调节pH 值到7.8,升温到80~90℃,加入骨质量4%的滑石粉,将盐解液调节pH 值到2~3,过滤1h;将滤液加入1.5倍体积的水进行稀释,同时调节pH 值到6.5;加入1.7倍体积的无水乙醇沉淀12h,将沉淀物加入1.5%的氯化钠溶液进行沉淀过滤;加入1.7倍体积的无水乙醇再次沉淀8h,所得沉淀物于60℃下干燥即得最终产品。
2.4 酶提取法
2.4.1 稀碱——酶解提取法
邹开朗[10]等提出稀碱与酶解相结合法生产硫酸软骨素。先将软骨在80℃水中煮4-6 h,然后按原料(干质量)与2%氢氧化钠的比例为1:6.25的量加入氢氧化钠溶液,室温提取1.5 h,然后用盐酸调pH 值到6.0-6.5,双层纱布过滤:留下滤液,滤渣再以1:0.12的质量比加入2%的氢氧化钠溶液,于40℃下提取lh,再用双层滤布过滤;弃滤渣,取滤液。合并2次滤液,并测量体积待用。滤液调节pH 值到8.0~9.0,按滤液与胰酶1000:0.5的比例加入胰酶,于40~50℃水解lh 后,再按1000:0.5的质量比加入胃蛋白酶,40~50℃水解1.5h,过滤后加入高岭土和活性炭附。用氯仿反萃取法萃取滤液,留水层。调水层pH 值至6.8~7.2,再加入2.5倍体积的95%以上乙醇沉淀,即得硫酸软骨素。
2.4.2 复合酶酶解提取法
王凤琴[11]等用复合酶解法提取硫酸软骨素。把猪肋、喉、气管等软骨预处理后,以骨粉1:3的比例加入去离子水,加入原料量1%的复合酶,于55℃搅拌酶12~15 h。复合酶水解液用盐酸调pH 值7.5,加入2%的醋酸钠溶液,搅拌溶解后,升温到85℃,保温20min,过滤去残渣,滤液加入胰酶酶解。经酶解后的酶解液在85℃下维持15min,过滤,乙醇沉淀,干燥磨粉后得成品。影响该工艺水解反应的因素为酶解温度、pH 值与加酶量,利用正交试验得出优化条件为温度50℃、pH值8.6~8.9、加酶量0~39L,收率达17.84%。采用全新的双酶酶解工艺和中空纤维超滤等现代技术生产硫酸软骨素,由于酶作用专一性强的特点,质量稳定、收率高,产品颜色洁白,生产周期较短。
2.4.3 酶解-树脂提取法
将软骨绞碎,加1 mol/L的氢氧化钠溶液浸泡,40℃保温水解2 h 或加pH 值为7.5的水浸泡,用蛋白酶55℃保温水解20 h,再加盐酸中和至近中性,过滤;调整滤液中NaCI 浓度达到0.5 moI/L后,将溶液通过Amberlite IRA-933 离子交换树脂柱吸附完毕;用0.5 mol/L的NaCI 液洗涤,再用1.8moI/L的氯化钠液洗脱,流速2 L/h,洗脱液脱盐,乙醇沉淀,离心分离,收集沉淀,真空干燥,即得成品。应用此工艺制得的硫酸软骨素样品,经纸电泳检查为单一区带,抗原物质试验结果为阴性,含硫量为7.2%。其优点是酶水解或稀碱水解与树脂交换技术相结合,保证了硫酸软骨素分子不降解,解决了成品纯度的问题。该方法简便,收率高,是一种较有实用价值的制备方法[12]。
2.5 超声辅助法
超声辅助法是利用超声波的空化作用,使物料周围形成空穴,从而有利于硫酸软骨素提取的方法。采用超声辅助的碱提酶解法提取硫酸软骨素,其提取物中硫酸软骨素的含量和得率并无明显提高,但可大大缩短提取时间。
蒲志军[13]等利用超声波法制备硫酸软骨素,其原理是在碱性条件下蛋白质易离解和超声波的热学机制促使蛋白质快速解离而达到去杂蛋白的目的,然后升温(85~90℃)均能使解离的蛋白质变性吸附到白陶土上,从而使硫酸软骨素与蛋白质分离,提高产品质量。
2.6 乙酸抽提法
Nakand[14]等利用乙酸水溶液提取硫酸软骨素。先把鲜软骨上的脂肪、肉及其他软组织去掉,在-20℃冷冻,使用前在4℃解冻,把软骨放在水中,用乙酸调节pH 值为4.5,在37℃下抽提7 h。抽提液沸腾浓缩后,在90℃下干燥即得硫酸软骨素粗品,影响硫酸软骨素浸出率的主要影响因素是pH 值。该工艺流程简单,成本较低,可以考虑商业化大规模生产。但是目前在国内还没有厂家用这种工艺生产硫酸软骨素。
3 硫酸软骨素的纯化
3.1 溶剂法
溶剂法是利用软骨中不同化学成分的溶解性差异,而将硫酸软骨素与其它杂质相互分离的纯化方法[15]。硫酸软骨素含有的硫酸基、羧基和羟基等亲水性基团,使其易溶于水,不溶于乙醇、甲醇、丙醇和丙酮等有机溶剂。一定条件下,采用乙醇沉淀法可得到纯度为70%~78%的硫酸软骨素。将较低纯度的硫酸软骨素溶于浓度为2%(w/v)的NaCl 溶液中,加入定量乙醇,于低温下静置后离心,重复以上步骤可依次得到较高纯度的硫酸软骨素。采用甲醇和丙醇也可得到同样的效果。
3.2 季铵盐沉淀法
溶液中以聚阴离子形式存在的硫酸软骨素可与季铵盐类化合物(如溴化十六烷基三甲铵或氯化十六烷基吡啶等)形成水溶性很小的季铵盐络合物。这些络合物在低离子强度的水溶液中不溶解,当其增大到临界离子强度时,可发生解离并溶解,利用该性质可使硫酸软骨素得到分离纯化。季铵盐类化合物沉淀法一般需要控制硫酸软骨素的浓度为0.1%~1.0%(w/v)范围内,硫酸软骨素与季铵盐发生化学反应的质量比为1:3,沉淀后季铵盐的最终浓度应大于0.05%(w/v)[16]。
3.3 超滤膜法
超滤膜法是利用滤膜孔径的不同使硫酸软骨素与其它非多糖类杂质分离,而得到分子量分布范围较窄且纯度较高的硫酸软骨素的方法。采用管形的三氧化二铝膜纯化硫酸软骨素,其滤膜的孔径分别为100nm、50nm、20nm,溶液的透过速度分别为90 L·h-1·m-2、60 L·h-1·m-2、43L·h-1·m-2,硫酸软骨素的截流率均可达到100%,杂质透过率分别为50%、65%、70%。
3.4 色谱法
溶液中的硫酸软骨素以聚阴离子的形式存在,采用阴离子交换剂通过交换吸附可对其进行纯化。离子交换色谱法是依靠库仑力的作用将物质吸附在交换剂上,然后选择合适的溶液进行洗脱,达到其纯化的目的[17]。采用Dowex-X2型强碱型阴离子交换树脂,梯度洗脱体系为硼酸-氯化钠溶液,流速为2.0mL·min-1,柱温55℃,压力为1.5~3.4kg·cm-2。当氯化钠溶液浓度为1.5mol·L-1时,可得到纯度较高的硫酸软骨素,回收率为85%。
3.5 电泳法
根据化合物所带电荷类型和数量的不同,采用电泳法可将硫酸软骨素与其它杂质分离开。电泳法具有分辨率、目标物纯度和回收率均较高的特点。采用双相电泳法纯化硫酸软骨素时,第一相电泳条件为pH 值6.0的吡啶/醋酸/水(10∶ 1∶ 89,v/v)缓冲液,电场强度为7.5V·cm-1,电泳时间为60min;第二相电泳条件为pH 值7.7 醋酸钡缓冲液,电场强度为7.5V·cm-1,电泳时间为130min,可得到纯度为82%(w/w)的硫酸软骨素。采用琼脂糖凝胶电泳,电泳条件为0.05mol·L-1的1,2-二氨基丙烷缓冲液(pH9.0),电流强度为50mA,电泳时间为80min,可得到纯度为90%(w/w)的硫酸软骨素,但其回收率仅为45%[18]。
4 展望
目前对CS的工艺研究大多是对现有方法的优化,今后的研究仍会以减少提取剂用量、提高收率与产品纯度为目标,并逐渐将研究成果应用于实际生产中。在结构分析方面,则要优化现有方法,加强对不同来源CS 及其衍生物结构的认识,并注重将活性与结构研究相结合。
CS 是重要的生化药物,因其特有的生物活性而广泛用于临床。未来的研究应在加强生产工艺、分析技术和活性研究的基础上开发新的CS 资源,重视扩展其在功能食品、保健品等领域的应用。
[1]肖凯军,等.鲨鱼软骨粘多糖的提取[J].化工学报,2001,52(8):2761.
[2]吴立芳,马美湖.我国畜禽骨骼综合利用的研究进展[J].现代食品科技,2005,21(1).
[3]施文健,吴程华,庄奇佳.十六烷基三甲基溴化铵光度滴定法测定硫酸软骨素钠盐[M].理化检验-化学分册,2003,39(3):147-150.
[4]Kazuyuki Sugahara,Satoml Nadanaka,Kyoko Takeda.Structural analysis of unsaturated hexasaccharides isolated from shark cartilage chondroitin sulfate D that are substrates for the exolytic action of chondroitin sulfate ABC lyase.Europe of journal biochemistry,1996,239:871-880.
[5]朱瑞芬,童兴龙,李颖.硫酸软骨素的研制[J].中国医药工业杂志,2000,31(6):255-256.
[6]罗曼,蒋立科.硫酸软骨素快速提取法研究[J].动物学杂志,2000,35(5):37-40.
[7]余仲建.现代有机分析[M].天津:天津科技出版社,1994:202-205.
[8]张启峰.有机分析教程[M].北京:中国标准出版社,1996:198-201.
[9]陈红丽,杨永锋等.硫酸软骨素提取方法研究[J].河南科学,2008,9(26):1039-1041.
[10]邹开朗,邹国林.硫酸软骨素快速提取法研究[J].氨基酸和生物资源,2000,22(3):22.
[11]王凤琴.硫酸软骨素生产新工艺的研究[J].淮阴工学院学报,2003,12(3):7.
[12]李良铸,李明哗.最新生化药物制备技术[M].北京:中国医药科技出版社,2001.
[13]蒲志军,马林,嘉庆等.超声波法制备硫酸软骨素生产工艺的研究[D].四川师范大学学报:自然科学版,2000,23(6):640.
[14]Nakano T,Lkawa N,Ozimek L.An economical method to extract chondroitin sulphate-peptide from bovine nasalcartilage[J].Canadian Agricultural Engineering,2000,42(4):205.
[15]Nicola Volpi.Purification of heparin,dermatan sulfate and chondroitin sulfate from mixtures by sequential precipitation with various organic solvents.Journal of chromatography B,1996,685:27-34.
[16]Nicola Volpi,Milena Dondi,Anna Maria,et al.Characterization of a small chondroitin sulfate proteoglycan isolated from the mucus surrounding the embryos of Vivi parusater.Biochimica et biophysica acta,1998,1380:239-248.
[17]陈健,郭祀远,李琳,等.声电场强化超滤鲨鱼鳍软骨粘多糖[J].华南理工大学学报(自然科学版),2003,2:9-10.
[18]Hirofumi Inoue,Ryoichi Nakayama,Kaoru Otsu,et al.Release of inorganic ion under mild alkaline condition from sulfate,unsaturated disaccharides obtained from chondroitin sulfates by chondroitinase digestion.Carbohydrate research,1986,155:277-282.

