平欧榛子蛋白分离及功能特性分析*
吕春茂,魏雅静,孟宪军,董文轩,陆长颖
(沈阳农业大学 食品学院,辽宁 沈阳,100866)
榛子,世界四大干果(扁桃、核桃、榛子、腰果)之一。榛仁含脂肪50.6% ~63.8%,蛋白质16.2% ~23.6%,碳水化合物16.5%,还含有多种维生素及矿物质元素。平欧榛子是以我国野生平榛为母本,欧洲榛为父本进行种间远源杂交产生的新种,别名大果榛子、杂交榛子。它集中了平榛与欧洲榛的优良特性,具有果大、壳薄、出仁率高、适应性强、风味好等特点[1]。本研究以平欧榛子为原料,经过脱脂处理后分别提取了榛子的分离蛋白、清蛋白、球蛋白、醇溶蛋白及谷蛋白,并对各蛋白组分分子质量分布及分离蛋白的功能特性进行了分析和测定。
1 材料与方法
1.1 主要材料和试剂
平欧榛子,购于本溪县三阳大果榛子专业生产合作社。榛子去壳、脱皮、粉碎、脱脂、分装(50 g/袋),于-20℃冰箱中备用;SDS-PAGE 凝胶配制试剂盒、预染蛋白Maker,北京鼎国昌盛生物技术有限责任公司;大豆色拉油,市售;核桃,市售;HCl、NaOH、Cu-SO4、NaCl、乙醇、正己烷,均为分析纯。
1.2 主要仪器设备
FD-IC-80 真空冷冻干燥机,北京博医康实验仪器有限公司;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;SHB-ⅢA 循环水式多用真空泵,郑州长城科工贸有限公司;pHS-25 数显pH 计,上海精密科学仪器有限公司;DYY-6C 型电泳仪,北京市六一仪器厂;Mini-PROTEAN Tetra System 电泳槽,BIO-RAD 公司;TDL-40B 台式离心机,上海安亭科学仪器厂;IKA T18 ULTRA-TURRAX 高速分散均质机,IKA 公司。
1.3 实验方法
1.3.1 基本营养成分测定
粗蛋白测定:微量凯氏定氮法(GB/T5009.5 -2010);粗脂肪测定:索氏提取法(GB/T 14772 -2008);水分测定:常压干燥法(GB/T5009.5 -2010);灰分测定:高温灼烧法(GB/T5009.4 -2010)。
1.3.2 榛子蛋白分离方法
榛子分离蛋白的制备采用碱溶酸沉法,见参考文献[2-3]。
参照Osborne 蛋白分级法[4],分级提取制备榛子的清蛋白、球蛋白、醇溶蛋白及谷蛋白,计算各蛋白所占的相对百分比。
1.3.3 SDS -PAGE 分析蛋白相对分子质量
根据文献[6-7],采用12%分离胶、5%浓缩胶对分离得到的各榛子蛋白组分进行SDS -PAGE 电泳分析。稳流操作,考马斯亮蓝R-350 染色15 min,10%冰醋酸脱色,拍照。
1.3.4 榛子分离蛋白功能特性的测定
1.3.4.1 溶解度[7]
测定不同pH 值下样品的氮溶解性指数NSI 值。制备0.1 g/L 榛子蛋白溶液,用0.1 mol/L HCl 或NaOH 调节pH 值为2 ~9,室温下搅拌1 h,4 000 r/min 离心10 min,分别测定上清液中含氮量及样品中总氮含量。溶解度的计算:

1.3.4.2 持水性[8]
准确称取1 g 榛子蛋白于预先称量过的离心管中,加入30 mL 去离子水,用磁力搅拌器搅拌使其混合均匀,调pH 值为3、5、7、9,将装有样液的离心管分别放在30、50、70、90 ℃的水浴中加热30 min,然后于冷却水中冷却30 min,3 000 r/min 离心10 min,去除上清液,称重。若无上清液,则应加水搅拌再离心,直到有少量上清液为止。持水性的计算:

1.3.4.3 吸油性[9]
准确称取0.5 g 榛子蛋白于离心管中,加入3 mL大豆色拉油,在高速分散均质机中均质2 min,分别在30、50、70、90 ℃的水浴中静止30 min,1 000 r/min 离心沉降25 min,吸取上层未吸附油,称量。吸油性的计算:
吸油性=(吸油后样品和离心管总质量-吸油前样品和离心管总质量)/样品质量
1.3.4.4 乳化性和乳化稳定性[10]
制备0.1、0.3、0.5 g/L 榛子蛋白溶液各25 mL,分别调pH 值为3、5、7、9,加入25 mL 大豆色拉油,在高速分散均质机中均质2 min,1 500 r/min 离心5 min,测定此时离心管中乳化层的高度和液体总高度。然后将离心管置于80℃水浴中,加热30 min,冷却至室温,再离心(1 500 r/min)5 min,测出此时乳化层高度。乳化性和乳化稳定性的计算公式如下:

1.3.4.5 起泡性和泡沫稳定性[11]
制备0.1、0.3、0.5 g/L 榛子蛋白溶液各100 mL,分别调pH 值为3、5、7、9,在高速分散均质机中均质2 min,记下均质停止时泡沫体积,静置30 min,记下此时泡沫体积。起泡性和泡沫稳定性的计算:

2 结果与讨论
2.1 平欧榛子基本营养组成
平欧榛子基本营养组成见表1。

表1 榛子原料、脱脂粉主要成分分析 %Table 1 Main composition of the hazelnut kernel and defatted powder %
2.2 榛子不同类型蛋白质组成
由图1 可知,榛子蛋白质中清蛋白含量最高,其次为球蛋白,谷蛋白含量较低,醇溶蛋白含量最低。由于榛子主要的蛋白质组分是水溶性的清蛋白和盐溶性的球蛋白,因此溶解性能较好,这也是蛋白质主要的功能性质,可以作为一种理想的天然的优质蛋白质资源应用于食品工业中。

图1 榛子蛋白质组分的构成及含量Fig.1 Distribution and protein content of protein frations of hazelnut
2.3 榛子蛋白质相对分子质量分布
采用12%的分离胶,5%浓缩胶对榛子蛋白分离出的组分进行SDS-PAGE 电泳分析,如图2、图3 所示。从图2 可以看出,在非还原条件下,分离蛋白及4 种分提蛋白的相对分子质量均小于71 kDa,分离蛋白主要亚基分布在35 ~71 kDa,此外,还有一些含量较少的亚基分布在16 kDa 附近。4 种分提蛋白质的亚基分布也存在一定差异,清蛋白在71 kDa 处有1条明显的亚基带,在35 ~71 kDa 还有5 条较模糊的亚基带,在16 kDa 附近有一些相对分子质量较低的亚基,球蛋白在50 ~71 kDa 有2 条比较明显的亚基带,在35 ~50 kDa 有3 条比较明显的亚基带,在16 kDa 附近有含量较少的亚基,谷蛋白在16 ~25 kDa有含量较少的亚基,醇溶蛋白在71 kDa 附近有1 条很浅的亚基带。

图2 非还原SDS-PAGE 电泳图谱Fig.2 Non-reduced SDS-PAGE
从图3 可以看出,在还原条件下,分离蛋白及4种分提蛋白的相对分子质量也均小于71 kua,在16~50 kua 之间均有2 条主要亚基带,在16 ~25 kua之间均有一条明显条带,分离蛋白和清蛋白在50 kua附近还有一条比较明显的亚基带,而球蛋白在50 kua附近亚基带较浅,谷蛋白在50 kua 附近没有条带,醇溶蛋白在25 kua 附近和35 ~50 kua 之间分别有一条很浅的亚基带。图3 与图2 的差异还表明榛子蛋白中存在分子内及分子间二硫键。

图3 还原SDS-PAGE 电泳图谱Fig.3 Reduced SDS-PAGE
2.4 溶解度
在室温条件下,考察不同pH 值对榛子分离蛋白溶解度的影响,如图4 所示,榛子分离蛋白溶解度随pH 值的变化曲线呈2 种不同的趋势。pH5 时,蛋白的溶解度最低,这是由于在pH 值接近该蛋白等电点时,蛋白质分子的正负电荷逐渐相等,表面的净电荷几乎为零,分子间斥力最小,蛋白质容易凝聚形成沉淀[12]。
2.5 持水性
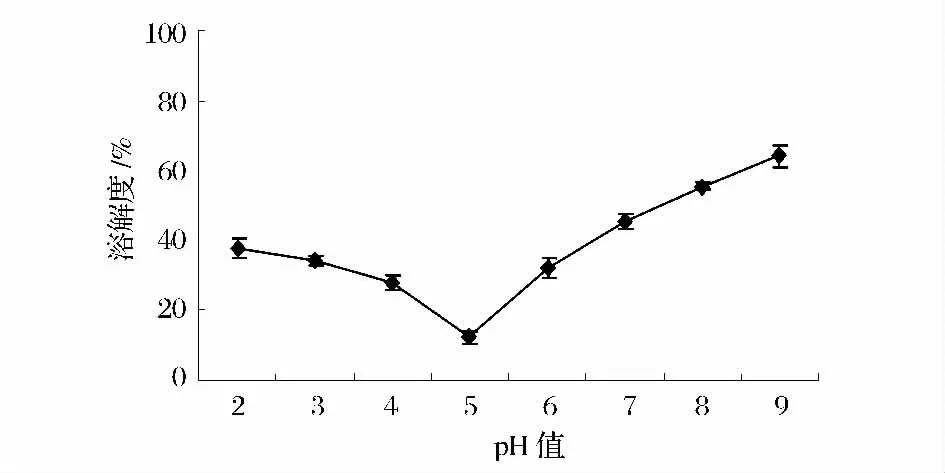
图4 不同pH 值下榛子分离蛋白的溶解性Fig.4 Dissolve characteristics of protein isolate of hazelnut on different pH value
在食品加工中,蛋白质对原料中的水分以及添加到产品中参与加工的水分具有的保持能力,就是蛋白质的持水性。持水性的高低直接决定着产品的风味、质地和组成状态[13]。本研究考察了不同温度、pH 值对榛子分离蛋白持水性的影响。由图5 可知,pH5 在等电点附近,持水性最小,当pH <5 时,持水性随酸性增强而增大,当pH >5 时,持水性随碱性增强而增大;从温度看,随温度的升高,分子热运动加剧,水在蛋白质中分布的更均匀,氢键减少或蛋白质变性,蛋白质表面积减小导致持水性下降,继续加热,使埋藏在球状分子内部的极性侧链发生离解和开链转向蛋白质分子表面,蛋白持水性又表现为增大[14]。
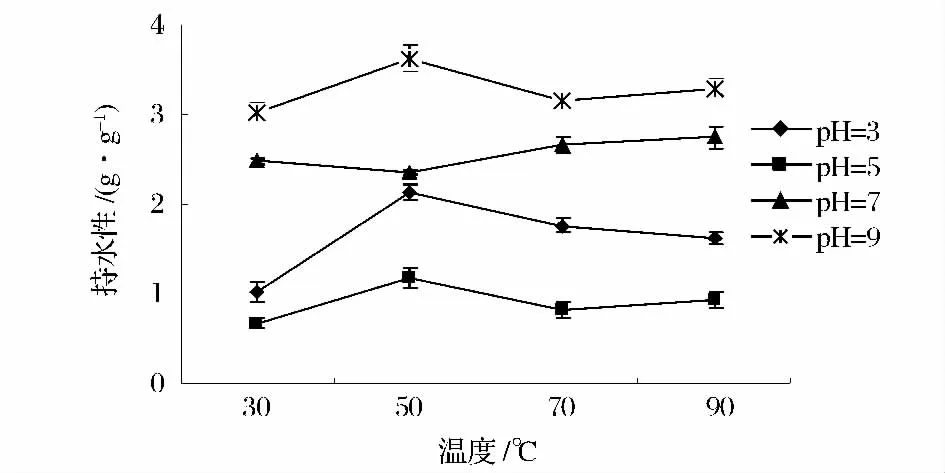
图5 不同pH 值、温度下榛子分离蛋白的持水性Fig.5 Water-holding of protein isolate of hazelnut on different pH value and temperature
2.6 吸油性
蛋白质的吸油性是指蛋白产品吸附油脂的能力。如图6 所示,当温度升至50℃左右时,榛子分离蛋白的吸油性最低为2.815 g/g,该值比山核桃蛋白质的吸油性高(50℃,1.89 g/g)[15],但小于核桃分离蛋白,这可能是由于随着温度升高,油的黏度逐渐降低,蛋白对油的吸附力减小,使得分离蛋白的吸油性下降。随着温度继续上升,蛋白质变性加剧,疏水基团暴露,与油的亲和力加大。除温度外,蛋白质的pH值、种类、加工方法等都会影响到蛋白质的吸油性。

图6 不同温度下榛子分离蛋白、核桃分离蛋白的吸油性Fig.6 OAC of protein isolate of hazelnut and walnut on different temperature
2.7 乳化性和乳化稳定性
乳化性是衡量蛋白质促进水型乳状液形成能力的指标,乳化稳定性是指维持乳状液的能力[16]。蛋白质分子中既有亲水集团又有疏水集团,因此,在水-油界面处,能与水及油分别结合,形成水油混合液。如图7、图8 所示,榛子分离蛋白在接近等电点区域乳化性和乳化稳定性最低,在等电点区域左侧时,蛋白质乳化性随pH 值的升高而降低,在等电点区域右侧时,蛋白质乳化性随pH 的升高而升高。这是因为在等电点区域,蛋白质发生絮凝,溶解度最小,而偏离此区域蛋白质溶解度较大,这说明蛋白质的乳化性质与蛋白质溶解性密切相关。同时,由于蛋白质在乳化体系中的稳定性取决于界面膜的稳定性,随着蛋白质浓度的增大,界面膜厚度增加,从而提高了膜的强度,增加了蛋白质的乳化稳定性。

图7 不同浓度、pH 值下榛子分离蛋白的乳化性Fig.7 Emulsifiability property of protein isolate of hazelnut on different concentration and pH value

图8 不同蛋白质浓度、pH 值下榛子分离蛋白的乳化稳定性Fig.8 Emulsion stability of protein isolate of hazelnut on different concentration and pH value
2.8 起泡性和泡沫稳定性
水分子对空气的包裹形成气泡,蛋白质作为两性分子可以成为水-气表面的介质,帮助降低气-液表面张力促成泡沫形成[17]。在泡沫形成后,蛋白质肽链通过分子内及分子间相互作用,形成稳定结构,维护泡沫稳定。由图9 可见,蛋白质起泡性曲线呈现先下降后上升的趋势,在等电点区域,蛋白质的溶解性很差,而起泡性与溶解度密切相关,导致此时起泡性最低,偏离等电点的pH 环境下溶解性增强,因此吸附到气-液界面上的蛋白质分子较多,从而起泡性增强。由图10 可见,蛋白质泡沫稳定性曲线呈现先上升后下降的趋势,等电点区域出现极大点,这是因为此时泡沫处于破裂非常缓慢阶段,泡沫排液和pH 值有很大的关系,在等电点附近,排液速度减慢,因此泡沫稳定。如图9、图10 所示,蛋白质的起泡性及泡沫稳定性均随蛋白质浓度的增加而增大,蛋白质浓度提高有利于形成较小、较硬的气泡,有利于产生气泡和泡沫的稳定。

图9 不同蛋白质浓度、pH 值下榛子分离蛋白的起泡性Fig.9 Foamability of protein isolate of hazelnut on different concentration and pH value
3 结论
(1)平欧榛子基本营养组成,蛋白质22.74%,脂肪58.82%,水分5.17%,灰分4.61%,蛋白质组分分析结果表明清蛋白占榛子粗蛋白的67.18%,球蛋白17.62%,谷蛋白6.53%,醇溶蛋白3.17%。清蛋白是构成榛子蛋白组成的主要部分,含量超过了60%。

图10 不同蛋白质浓度、pH 值下榛子分离蛋白的泡沫稳定性Fig.10 Foam stability of protein isolate of hazelnut on different concentration and pH value
(2)榛子蛋白组分相对分子质量分布比较集中,且各组分间存在相似之处,还原和非还原SDS-PAGE分析表明,榛子蛋白质各种组分中均存在二硫键,非还原条件下,各组分亚基相对分子质量主要分布在35 ~71 kDa,还原条件下,各组分亚基相对分子质量主要分布在16 ~50 kDa,并且有2 条明显的亚基带,醇溶蛋白的亚基带很浅。
(3)榛子分离蛋白的溶解性在pH5 时最小;在温度为50℃,pH9 的条件下持水性最好;其吸油性在温度为50℃时最小,为2.815 g/g;乳化性在浓度为0.5 g/L 时最大,同时浓度越高越有利于保持乳化稳定性;其起泡性和泡沫稳定性也随浓度的上升而升高。
[1] 刘国夫,殷展波,李延波,等. 平欧杂交榛子引种栽培技术[J]. 中国园艺文摘,2009,25(5):113 -114.
[2] 张春红,盛芳,宋晓艺. 榛子分离蛋白提取及其功能特性的研究[J]. 油料蛋白,2011,8 (36):28 -30.
[3] 娜仁图雅. 红小豆分离蛋白的特性研究以及抗氧化肽制备[D]. 内蒙古:内蒙古农业大学,2011:9 -10.
[4] Idouraine A,Yensen S B,Weber C W. Fraction and parial characterization of tepary bean (Phaseolus acutifolius)prorein[J]. Food Chemistry,1994,50(1):13 -18.
[5] 杨令叶. 韩城大红袍花椒籽种仁蛋白质分离提取和性能的研究[D]. 西安:陕西师范大学,2011:17 -18.
[6] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1976,1(227):681 -185.
[7] Semiu O O,Folake O H,Hans-pater M,et al. Functional properties of protein concentrates and isolates produced from cashew(Anacardium occidentale L. )nut[J]. Food Chemistry,2009,3(115):852 -858.
[8] 朱凯艳. 利用水相同时提取花生油和蛋白工艺的研究[D]. 无锡:江南大学,2012:17 -18.
[9] 黄晓钰,刘邻渭. 食品化学综合实验[M]. 北京:中国农业大学出版社,2002:122 -12.
[10] Dipak K Dev.Funtional properties of rapeseed protein products with varying phytic acid content[J]. Agri Food Chem,1986,34:775.
[11] 杜蕾蕾. 冷榨核桃制备核桃油和核桃蛋白的研究[D]. 武汉:武汉工业学院,2009:48 -49.
[12] 管斌,林洪,王广策. 食品蛋白质化学[M]. 北京:化学工艺出版社,2000:2 -6.
[13] 李剑玄. 浒苔蛋白质的分离提取及其功能特性的研究[D]. 武汉:武汉工业学院,2010:33 -34.
[14] 何东平. 水相酶法同步提取冷榨花生饼中蛋白质和花生油的研究[D]. 武汉:华中农业大学,2006:55 -56.
[15] 何志平. 浙江山核桃抗氧化与蛋白质特性研究[D].杭州:浙江大学,2011:82 -83.
[16] 段家玉. 冷榨花生饼制备花生蛋白和多肽的研究[D]. 武汉:华中农业大学,2006:30 -31.
[17] 李迎秋,陈正. 高压脉冲电场对大豆分离蛋白功能性质的影响[J]. 农业工程学报,2006,22(8):194 -198.

