重组小鼠IFN-β原核表达载体的构建及包涵体溶解条件的筛选
苏雅拉图,张永胜,陈宇杰,胡小平,王丽颖,万 敏,吴柒柱
(1.内蒙古民族大学生命科学学院,内蒙古 通辽 028000;2.吉林大学白求恩医学院生物化学与分子生物学教研室 ,吉林 长春 130021)
干扰素β(interferon-β,IFN-β)具有广泛的抗病毒作用,对一般病毒感染有促进机体恢复及缩短病程的作用[1-2]。IFN-β对某些癌细胞有抑制作用,可下调细胞原癌基因的转录水平,下调某些生长因子受体表达[3],对巨噬细胞的功能有增进作用,并可调节T、B淋巴细胞的功能[4]。利用基因工程下游技术可以在大肠杆菌中表达IFN-β,但表达产物往往是以包涵体形式存在,要通过变复性过程才可以获得有活性的IFN-β。一些文献[5-6]报道:在研究中存在包涵体无法溶解或溶解效率低的问题。本文作者主要在重组小鼠IFN-β原核表达载体的构建及包涵体溶解效率等技术方面做了尝试,以期为筛选适合包涵体溶解的条件提供实验依据。
1 材料与方法
1.1 动物和主要试剂
Balb/c鼠(昆明鼠)购自吉林大学实验动物中心。内切酶NcoⅠ、HindⅢ和T4DNA连接酶、pMD18-T质粒购自宝生物工程有限公司(大连);Taq DNA聚合酶购自Promega公司;DNA回收试剂盒购自北京鼎国生物技术公司;IPTG购自Sigma公司;pET-28a(+)质粒购于美国Novagen公司;JM109菌种和BL21(DE3)菌种由吉林大学白求恩医学院生物化学与分子生物学实验室提供。
1.2 引物的设计
采用primer 5.0软件设计引物。上游引物,5'-CCATGG(NcoⅠ酶切位点)GA(调解碱基错位)ATCAACTATAAGCAGCTC-3′;下游引物,5′-G(调解 GC比)AAGCTT(HindⅢ酶切位点)GTTTTGGAAGTTTCTGGT-3′,由上海生工生物技术公司合成。
1.3 重组表达载体的构建与鉴定
采用新鲜小鼠肝组织提取DNA,进行PCR扩增,电泳回收片段,T-A克隆pMD18-T质粒。将重组pMD18-T质粒转化JM109感受态细胞,菌液移入培养基中,置37℃恒温箱中过夜。从氨苄青霉素(Amp)抗性LB固体培养基中挑单菌落接种于含5mL LB液体培养基(Amp:75mg·L-1)试管中,37℃、175r·min-1振荡培养过夜。碱溶解法小量制备质粒,由限制性内切酶NcoⅠ和HindⅢ双酶切,电泳,能释放出目的片段的质粒为阳性克隆。回收目的片段,同时将PET28a空质粒NcoⅠ和HindⅢ双酶切回收。在T4DNA连接酶的作用下将目的片段定向克隆至双酶切的PET28a空质粒中,后将其转化到BL21表达工程菌。菌液移入KaNa抗性LB固体培养基中,37℃恒温箱中过夜培养。从KaNa抗性LB固体培养基中挑单菌落接种于含5mL LB液体培养基(Amp:75mg·L-1)试管中,37℃、175r·min-1振荡培养过夜。碱溶解法小量制备质粒,限制性内切酶NcoⅠ和HindⅢ双酶切,产物在琼脂糖凝胶中电泳,能释放出目的片段的质粒为阳性克隆。阳性重组质粒送上海生工公司测序。将重组IFN-β命名为IFN-β′,并利用 DNA star序列分析软件分析IFN-β′成熟蛋白二级结构、等电点及相对分子质量。确定测序结果与GenBank登录的小鼠IFN-β的序列信息相符后,用IPTG诱导表达,并SDS-PAGE鉴定。
1.4 目的蛋白包涵体溶解
菌液11000r·min-1离心10min,沉淀加入溶解液(Tirs 20mmol · L-1,NaCl 500mmol·L-1,尿素8mol·L-1,pH 7.8)搅拌均匀后4℃冰箱过夜。次日取混合液100μL,11000r·min-1离心10min,将沉淀和上清分离,沉淀加入100μL祛离子水混匀后,上清与沉淀各加5×非还原Buffer 25μL沸煮5min,离心。经15%SDS-PAGE检测。因IFN-β′蛋白以包涵体形式表达,所以在进行此重组蛋白的复性和纯化过程中要求先对包涵体进行溶解。传统方法溶解IFN-β′蛋白包涵体,以1g菌∶5mL溶解液混匀,超声波破菌(工作5s,间隔5s,60次),4℃过夜,次日15%SDS-PAGE检测。本研究对比了不同溶解液成分、不同pH环境、不同干菌与溶`解液比例、不同溶解温度、不同溶解时间等主要因素对包涵体溶解效果的影响。同时观察不同包涵体洗涤液对包涵体溶解效果的影响(洗涤液1:Tris 50mmol·L-1,pH 7.8; 洗涤液2:Tris 50mmol·L-1,尿素2mol·L-1,TritonX-1001/50,pH 7.8)。
2 结 果
2.1 IFN-β′成熟蛋白预测与鉴定
利用DNA star预测到IFN-β′成熟蛋白的等电点(pI)为9.67,相对分子质量为21300。重组蛋白氨基酸序列中含有1个半胱氨酸。用限制性内切酶NcoⅠ和HindⅢ双酶切重组质粒pET/IFN-β,1%琼脂糖电泳显示在486bp处有条带产生,证明IFN-β基因插入 pET-28a(+)质粒的 NcoⅠ 和HindⅢ酶切位点间。见图1。
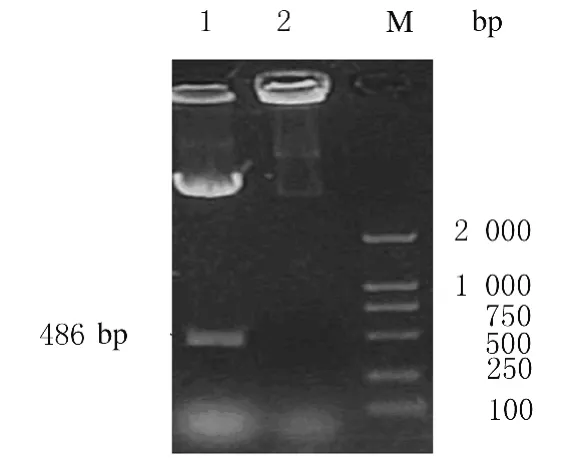
图1 双酶切pET-28a的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoregram of pET-28adigested by enzyme
2.2 IFN-β′的诱导表达
用相同浓度IPTG诱导不同时间(图2A)及不同IPTG浓度诱导相同时间(图2B)对目的蛋白表达量均有影响。目的蛋白表达量与诱导时间有关;由于IPTG可循环使用,且0.06~0.40mmol·L-1的IPTG浓度所表达的产量基本相同,为了减少IPTG对菌体的伤害,并且考虑操作方便,在实验中用0.1mmol·L-1IPTG诱导。
2.3 IFN-β′蛋白的可溶性表达
应用超声方法裂解经0.1mmol·L-1IPTG诱导的E.coli菌体,检测是否有可溶性的IFN-β′蛋白表达。SDS-PAGE分析显示:IFN-β′蛋白不以可溶性形式表达(图3A)。改变诱导条件为18℃、150r·min-1过夜诱导12h,SDS-PAGE分析显示:IFN-β′蛋白仍然以包涵体形式表达(图3B)。
2.4 不同条件下包涵体溶解效果
2.4.1 传统方法溶解包涵体蛋白 用传统方法溶解IFN-β′蛋白包涵体后,SDS-PAGE分析显示:IFN-β′蛋白不能被溶解。见图4。
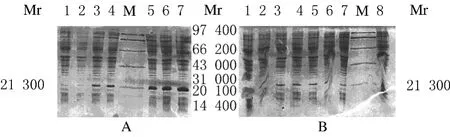
图2 表达产物的SDS-PAGE电泳图Fig.2 SDS-PAGE electrophoregram of expression product

图3 可溶性IFN-β′蛋白表达的SDS-PAGE电泳图Fig.3 SDS-PAGE electrophoregram of soluble IFN-β′protein expression
2.4.2 使用不同pH值溶解液包涵体蛋白溶解情况 改变溶解液pH值溶解IFN-β′蛋白包涵体,SDS-PAGE检测结果显示:改变包涵体溶解液pH值对IFN-β′蛋白包涵体的溶解无明显影响。见图5。
2.4.3 溶解液中加入DTT时包涵体蛋白溶解情况 在溶解液中加入DTT溶解IFN-β′蛋白包涵体,SDS-PAGE检测结果显示:溶解液中加入DTT对IFN-β′蛋白包涵体的溶解无明显影响。见图6。
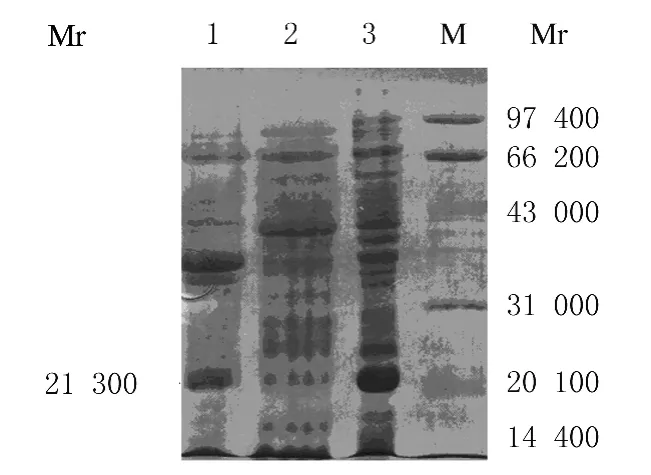
图4 包涵体溶解SDS-PAGE电泳图Fig.4 SDS-PAGE electrophoregram of dissolved inclusion body

图5 不同pH值溶解液溶解包涵体的SDS-PAGE电泳图Fig.5 SDS-PAGE electrophoregram of lysis inclusion body in solutions with different pH values

图6 溶解液中加入DTT后SDS-PAGE电泳图Fig.6 SDS-PAGE electrophoregram of lysis precipitation added with DDT
2.4.4 包涵体洗涤后溶解效果 为防止菌体碎片对溶解液溶解包涵体产生影响,裂解包涵体前使用包涵体洗涤液进行洗涤,纯化的包涵体再经溶解液溶解,SDS-PAGE检测结果显示:包涵体经洗涤后不能被溶解液所溶解。见图7。

图7 包涵体洗涤后溶解SDS-PAGE电泳图Fig.7 SDS-PAGE electrophoregram of the inclusion body after washing and dissolving
2.4.5 尿素溶解液溶解包涵体SDS-PAGE检测结果 因采用8mol·L-1尿素不能溶解IFN-β′蛋白包涵体,因此尝试用10mol·L-1尿素的溶解液来裂解蛋白包涵体,SDS-PAGE检测结果显示:含有10mol·L-1尿素浓度的溶解液亦不能溶解此包涵体。见图8。

图8 10mol·L-1尿素溶解液溶解包涵体SDS-PAGE电泳图Fig.8 SDS-PAGE electrophoregram of inclusion body dissolved with 10mol·L-1 urea solution
2.4.6 使用不同比例溶解液包涵体蛋白溶解情况
考虑到溶解包涵体蛋白浓度和温度对包涵体的溶解有一定影响,因此尝试增加溶解液的比例,溶解液比例增加至1g菌∶20mL溶解液,并且分别在室温和37℃温度下观察包涵体溶解情况,SDSPAGE检测结果显示:温度对包涵体溶解几乎无影响,而增加溶解液比例能溶解部分IFN-β′蛋白包涵体。见图9。
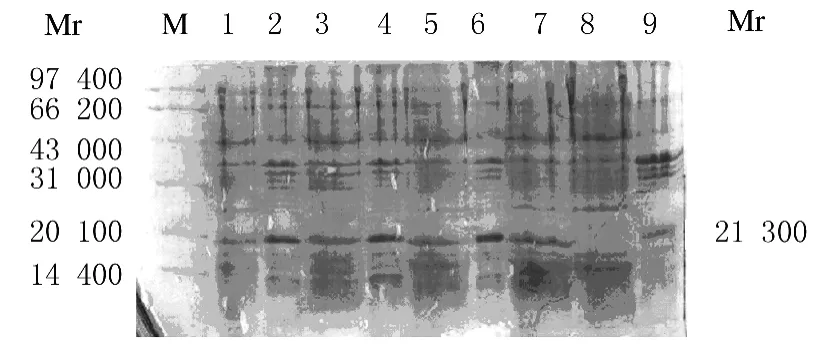
图9 不同比例溶解液溶解包涵体SDS-PAGE电泳图Fig.9 SDS-PAGE electrophoregram of inclusion body dissolved with different proportions of solution
3 讨 论
包涵体主要是由于在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,而无法形成正确的次级键等原因形成的[7];也可能是外源基因合成速度太快,没有足够的时间进行折叠,二硫键不能正确的配对,使过多的蛋白间发生非特异性结合,蛋白质无法达到足够的溶解度[8]。IFN-β的表达产物往往以包涵体形式存在,要通过变复性过程才可以获得有活性的IFN-β。Li等[9]比较了7mol·L-1盐酸 胍、8mol·L-1尿 素、2%Sarkosyl与2mol·L-1尿素加pH值的变性液对rhG-CSF包涵体蛋白的溶解和复性的影响,结果显示:高pH值环境能有效溶解该蛋白,低浓度的尿素具有协同作用。Singh等[10]研究了含有不同羟基的醇类对hGH包涵体蛋白的溶解,结果表明:6mol·L-1正丙醇加2mol·L-1尿素的溶解效果最好。2011年Yang等[11]用这种两步变性一步复性方法对91种包涵体从进行变复性,其中76%的蛋白平均复性率高于75%。本文作者在实验中尝试了更换溶解液、改变尿素浓度、改变溶解环境、调整溶解液pH值、调整诱导表达时间等方法,但蛋白包涵体仍难以被溶解;在使用1g菌加20mL溶解液时发现包涵体有溶解,结果表明:增加溶解液比例可以提高包涵体的溶解率。
研究[12]显示:低温诱导表达可提高可溶性目的蛋白产量;Yang等[13]认为:低温能降低蛋白质合成的速率,改变多肽折叠的动力学,从而导致正确折叠的蛋白增加。也有研究[14-15]显示:可能在较低温度下,与蛋白折叠和蛋白聚合相关的蛋白的表达更有利于菌体形成稳定的可溶性蛋白。
本研究中蛋白在低温过夜诱导时未出现可溶性表达,这可能与蛋白本身特性有关。不同的菌株其最佳诱导表达时间是不同的,即便是同一种菌株,在细菌生长密度和蛋白表达条件不一样的时候其最佳表达时间也会有所差别。诱导时间过短,表达水平下降;诱导时间过长,由于培养基的消耗,使细菌老化,也会导致表达量的降低。采用不同浓度的IPTG、37℃诱导相同时间发现:IPTG浓度在0.1~1.0mmol·L-1之间表达量相同。
[1]金伯泉.细胞和分子免疫学 [M].西安:世界图书出版公司,1995:1335-1371.
[2]Damell JE Jr,Kerr IM,Stark GR.Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins [J]. Science,1994,264(5146):1415-1421.
[3]Mark DF,Lu SD,Creasey AA,et al.Site specific mutagenesis of human fibroblast interferon gene [J].Proc Natl Acad Sci,1984,81(18):5662-5666.
[4]Uehara A,Sugawara S,Takada H.Priming of human oral epithelial cells by interferon-gamma to secrete cytokines in response to lipopolysaccharides,lipoteichoic acids and peptidoglycans[J].J Med Microbiol,2002,51(8):626-634.
[5]罗 莉,何勇智,张勇侠,等.功能性包涵体的研究进展 [J].中国生物工程杂志,2013,33(1):114-121.
[6]龙英娜,刘焕奇,王明志.重组包涵体的纯化与复性 [J].兽医临床,2008(4):70-71.
[7]Sunttha K,Chung BH,Jang KH,et al.Refolding and purification of zymomonas mobilis levansucrase produced as inclusion bodies in fed-batch culture of recombinant Escherichia coli [J].Protein Expr Purif,2000,18(3):338-393.
[8]Tsuji I,Mastui H,Ito T,et al. L-cysteine-enhanced renaturation of bioactive soluble tumor necrosis factor ligand family member LIGHT from inclusion bodies in Eschcrichia coli [J].Protein Expres Purif,2011,80(2):239-245.
[9]Li M,Fan H,Liu J,et al.High pH solubilization and chromatography-based renaturation and purification of recombinant human granulocyte colony-stimulating factor from inclusion bodies [J]. Appl Biochem Biotech,2012,166(5):1264-1274.
[10]Singh SM,Sharma A,Upadhyay AK,et al.Solubilization of inclusion body proteins using n-propanol and its refolding into bioactive form [J].Protein Express Purif,2012,81(1):75-82.
[11]Yang Z,Zhang L,Zhang Y,et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method [J].PLoSOne,2011,6(7):e22981.
[12]朱红裕,李 强.外源蛋白在大肠杆菌中的可溶性表达策略 [J].过程工程学报,2006,6(1):150-155.
[13]Donovan RS,Robinson CW,Glick BR.Review:Optimizing inducer and culture conditions for expression of foreign protein under the control of the Lac promoter[J].J Ind Microbiol,1996,16(3):145-154.
[14]Carter P,Kelley RF,Rodrigues ML,et al. High-level Escherichia-coli expression and production of a bivalent humanized antibody fragment [J].Bio-technology,1992,10(2):163-167.
[15]程太平,荣 俊,刘晓娜,等.IBDV VP2基因重组质粒pBV220表达条件的优化 [J].动物医学进展,2007,28(4):9-13.

