辽东楤木协同顺铂抑制SKOV3-DDP生长的作用及机理
王春梅,薛晓鸥,张广美
(1.北京中医药大学东直门医院,中西医结合博士后流动站,北京 100700;2.北京中医药大学东直门医院,北京 100700;3.哈尔滨医科大学附属第一医院,黑龙江 哈尔滨 150001)
卵巢癌是恶性度及致死率最高的妇科肿瘤[1],五年生存率不到45%。以铂类为主的化学治疗为其主要的治疗手段之一。虽然铂类初始使用临床效果显著,但随疗程的增加,肿瘤细胞逐渐对其产生耐受性[2],铂类耐药成为影响卵巢癌化疗疗效及患者预后的主要因素。因此,寻求一种增强铂类化疗效果或降低铂类耐药的方法十分重要。
辽东楤木(Aralia elata(Miq.)Seem),是东北地区餐桌上常见的山野菜,为五加科楤木属多年生亚乔木植物,又名龙牙楤木、刺嫩芽、刺老芽等。中医学认为其具有补肾填精的功效。在前期的实验中我们发现在辽东楤木叶中提取的皂苷类物质可抑制卵巢癌SKOV3细胞及卵巢癌耐顺铂株SKOV3-DDP细胞的生长[3],并能够降低耐药蛋白的表达[4]。本课题旨在探讨辽东楤木叶总皂苷(Total aralosides isolated from the leaves of Aralia elata(Miq.)Seem ,TALAS)是否具有协同顺铂、抑制SKOV3-DDP细胞生长的作用并探寻其可能的作用机制。
1 实验材料
1.1 实验用细胞系及培养方法 卵巢腺癌顺铂耐药株(SKOV3-DDP,中国医学科学院肿瘤研究所,批号zk-2010)。培养条件:细胞培养于含10%胎牛血清(NQBB,澳大利亚)的RPMI-1640培养液中,其中加入0.1%青 - 链霉素、0.3%谷氨酰胺,于37℃、5%CO2恒温培养箱培养,每隔3天传一代,取对数生长期细胞用于实验。
1.2 实验药品及试剂 辽东楤木叶总皂苷(TALAS),粉末状、褐色、易溶于水,常温保存,由黑龙江中医药大学中药化学教研室匡海学教授2010年赠送,用含10%胎牛血清的RPMI-1640培养液配成1 000ug/ml母液,-20℃保存,根据实验需求配成相应浓度;顺铂(齐鲁制药,批号990619),用生理盐水配成液体,4℃保存;RPMI-1640培养液(HyClone,美国);胎牛血清(NQBB,澳大利亚);蛋白分子量标准(江苏碧云天);Annexin-V FITC/PI凋亡检测试剂盒(江苏碧云天);Phospho-iκB -α(Ser32)抗体(CST,美国);Phospho-iκκα(Ser176)(CST,美国);Phospho- NF -κBp65(Ser536)(CST,美国);内参 β -actin、马抗小鼠二抗、羊抗兔二抗(SANTA CRUZ,美国);MTT、DMSO、PI、RNase A(Sigmal,美国);PCR 引物(上海生工,内参 GAPDH:上游:5'- gtcagtggtggacctgacct-3'、下游5'- aggggtctacatggcaactg - 3',LRP(lung resistance protein)5'-acaagacccgtgtggttagc-3'、下游:5'-agagggacaacacggtgaac-3');RT-PCR反应试剂盒(大连宝生物)。
1.3 实验耗材及仪器设备 细胞培养瓶、细胞培养板、枪头等耗材(corning,美国);DYY-12型电泳仪(北京六一仪器厂);GDS-8000凝胶成像仪(UVP,美国);流式细胞仪(BD,美国);多功能酶标仪(Biotek,美国);荧光倒置显微镜(德国蔡司Zeiss公司);紫外分光光度计(岛津,日本);逆转录-PCR反应仪(百维信生物);蓝盾552可见光凝胶电泳透射仪(厦门百维信生物)。
2 实验方法
2.1 MTT法检测TALAS、顺铂对 SKOV3-DDP细胞的协同抑制作用
在前期实验中,已通过MTT法证实TALAS对SKOV3-DDP细胞的抑制作用,在本实验中仍采用MTT法检测TALAS与顺铂在抑制耐药细胞生长中的协同作用。取对数生长期SKOV3-DDP细胞,以5×103个/孔接种于96孔培养板中,分为顺铂组(50umol/l)、TALAS(100ug/ml)组、顺铂 +TALAS组(50umol/l+100ug/ml)、阴性对照组(培养液),每组设五个复孔,周边孔用PBS填补。37℃,5%CO2恒温培养箱培养24h后,吸尽液体,PBS冲洗后,每孔加入300ul液体,混合药液组两种药液各加入150ul,培养24h后,MTT法检测细胞活性,根据公式计算抑制率。
2.2 Annexin-V FITC/PI双染法检测细胞凋亡
选择对数生长期SKOV3-DDP细胞,经胰酶消化后,制成单细胞悬液,细胞计数板计算浓度。以3×105个/孔,种植于6孔细胞培养板中,每孔加入2ml完全培养液,37℃、5%CO2恒温培养箱中培养24h。将细胞分为对照组、TALAS低剂量组(50ug/ml)、TALAS中剂量组(100ug/ml)、TALAS高剂量组(200ug/ml)。吸出上清液,根据分组加入不同浓度药液各2ml,37℃、5%CO2恒温培养箱中继续培养24h。Annexin-V FITC/PI凋亡检测试剂盒检测细胞凋亡(按说明操作)。实验重复3次。凋亡率用(mean±SEM)表示,组间比较用t检验,用SPSS 13.0进行统计分析,P<0.05为具有显著性差异。
2.3 RT-PCR检测LRP mRNA表达
细胞处理及实验分组同上,收集各组细胞,提取总RNA,根据引物及反应条件逆转录合成cDNA,按反应条件进行PCR反应,然后将PCR反应产物进行琼脂糖凝胶电泳,紫外灯观察凝胶并照相,实验重复3次,条带分析软件分析实验结果。
2.4 WB法检测NF-B信号传导通路蛋白质磷酸化水平
细胞培养、药物干预及分组同上实验,收集各组细胞,磷酸化蛋白提取试剂盒提取各组细胞蛋白质,检测蛋白质含量,计算上样量,经过聚丙烯胺凝胶电泳、转膜等过程,将蛋白质转至NC膜上,然后进行免疫反应。一抗稀释浓度:Phospho-iκB-α(Ser32)抗体:抗体稀释液 =1∶800,Phospho - iκκα:抗体稀释液 =1∶1 000,Phospho-NF -κB:抗体稀释液 =1∶750,涡旋混匀。内参β-actin:抗体稀释液=1∶500。马抗小鼠二抗稀释浓度为1∶500,羊抗兔二抗稀释浓度为1∶1 000。免疫反应后,碱酶法显影、定影,实验重复3次,照相并分析结果。
3 实验结果
3.1 TALAS、顺铂抑制SKOV3-DDP细胞生长的协同作用
经过24h的作用后,顺铂组(50umol/l)细胞抑制率达到(54.37 ±1.27)%,TALAS 组(100ug/l)抑制率为(45.67±2.34)%,顺铂 +TALAS(69.26±2.34)%。结果显示,TALAS与顺铂有明显的协同作用,可增强顺铂对SKOV3-DDP细胞的抑制作用。
3.2 Annexin-V FITC/PI双染法检测细胞凋亡
用Annexin-V FITC/PI双染法检测TALAS诱导SKOV3-DDP细胞发生凋亡的作用,结果如图1A所示:正常对照组早期凋亡的细胞仅占细胞总数的(0.85±0.13)%;TALAS低剂量组作用24h后,早期凋亡细胞的比率上升到(8.1±0.34)%;TALAS中剂量组及高剂量组早期凋亡细胞含量进一步上升,分别为(14.9 ±0.85)%、(28.7 ±0.45)%。如图1B 所示:与正常组相比,中、高剂量组早期凋亡率具有显著性差异(P <0.05,P <0.01)。
3.3 TALAS对LRP mRNA水平的影响 结果见表1。
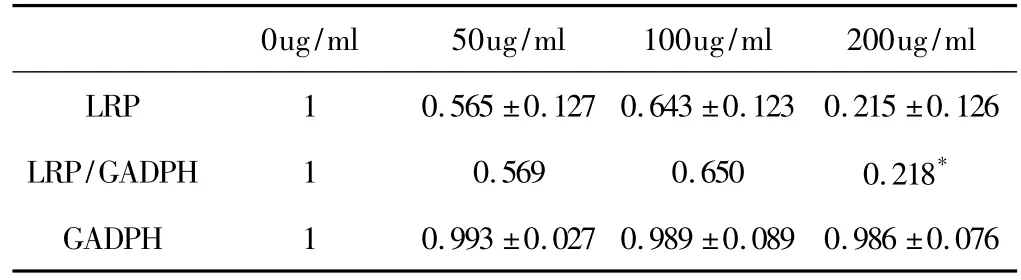
表1 TALAS对LRP RNA水平的影响(mean±SEM,n=3)
如图2所示,左侧为内参GAPDH组,右侧为LRP组,从左至右分别为对照组、TALAS低剂量组(50ug/ml)、中剂量组(100ug/ml)、高剂量组(200ug/ml),分别作用24h后,细胞内LRP及内参GADPH的表达情况,条带灰度代表mRNA表达水平的高低。如表1所示:将对照组灰度设置为1,其他各组为相对于正常组的灰度值,将各组条带灰度值与相应组内参GADPH的灰度值相比,结果如表1所示:与对照组相比,高浓度组差异显著(P<0.05),低浓度、中浓度组无显著性差异。
3.4 WB法检测NF-κB信号传导通路蛋白质磷酸化水平 结果见图3、表2。

表2 TALAS 对 Phospho-iκB - α、Phospho- iκκα、Phospho-NF-κB蛋白质表达的影响(mean±SEM,n=3)

图1 Annexin-V FITC/PI双染法检测不同浓度TALAS作用24h后早期凋亡率的变化

图2 RT-PCR法检测TALAS对SKOV3-DDP细胞LRP mRNA水平表达的影响
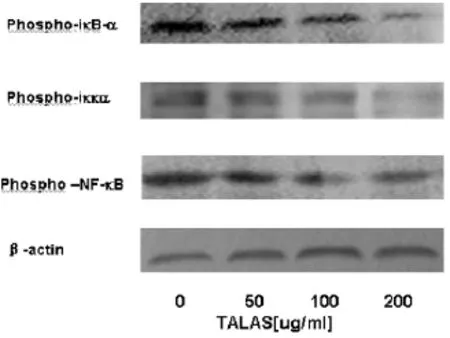
图3 WB 法检测 TALAS对 Phospho-iκB - α、Phosphoiκκα、Phosphoκ -NF - κB 蛋白质表达水平的影响
如图3所示,从左至右为正常细胞对照组、TALAS低剂量组(50ug/ml)、中剂量组(100ug/ml)、高剂量组(200ug/ml)分别作用于SKOV3-DDP细胞24h后,Phospho-iκκB - α、Phospho-iκκα、Phospho-NF - κB及内参β-actin蛋白质的表达情况,条带灰度代表蛋白质表达水平。
如表2所示,将正常组的灰度值设置为1,其他各组为相对灰度值,与正常组相比,中浓度组及高浓度组P-iκB-α表达水平显著降低,具有统计学意义(P<0.05,P <0.01);高浓度组 P -iκκα、P -NF - κB 表达水平下调,与正常组相比具有显著性差异(P<0.01),低、中剂量组与正常组相比差异不显著(P>0.05)。
4 讨论
铂类耐药是卵巢癌治疗过程中的严重问题,解决铂类耐药对于卵巢癌患者意义重大。顺铂是一种中性的、正方形Pt(CN)配合物,含有两个氯离子配体并处于顺位。其主要作用机制是对DNA复制、RNA转录的抑制,并阻碍细胞停滞于G2期,诱导其凋亡。任何影响顺铂加合物形成和调节细胞凋亡的因素都可以影响对顺铂的耐药性。如有报道说,胞内蛋白的失活作用能够导致细胞对顺铂的耐药性[5-6],另外,药物的摄取和流出异常与顺铂的耐药性也密切相关,在耐顺铂的细胞株中,通常可以观察到药物蓄积降低的现象。某些癌基因与抑癌基因表达的突变与细胞对顺铂的耐药性有有一定关系,因为这些基因表达的突变可以引起细胞结构与功能的改变[7-11],促使凋亡机制发生异常,或抑制凋亡通路活性。
通过前期实验,我们已经证实了TALAS对SKOV3细胞及SKOV3-DDP细胞的抑制作用,但未探讨其与顺铂的协同作用[12]。在本实验中,通过MTT实验发现,TALAS与顺铂协同应用效果明显优于单独使用,证明二者具有明显的协同作用。而通过Annexin-V FITC/PI双染法,进一步证实了TALAS诱导耐药细胞发生凋亡的作用,提示二者的协同作用可能与TALAS的促凋亡作用相关。肺耐药相关蛋白(lung resistance protein,LRP)被认为是人类的主要穹窿蛋白,分布于胞浆内或核膜上,可通过胞吐机制将药物排出细胞,从而减少了药物在细胞内的积聚。其底物非常广泛,包括铂类和烷化剂类药物。通过RT-PCR法检测TALAS对LRP mRNA水平的表达,结果发现高浓度组TALAS可明显下调其表达水平。因此,TALAS与顺铂的协同作用可能与其能够抑制LRP的表达相关。
信号传导通路的异常也是导致肿瘤细胞耐药的重要因素,因其网络性、交叉性,可通过多种直接、间接的渠道影响肿瘤细胞耐药。NF-κB是一种转录因子,包括5个亚型,主要涉及人体防御反应、组织损伤、细胞分化和凋亡及肿瘤生长抑制过程中的信息传递。在大多数细胞中,NF-κB可以通过上调促细胞存活基因和凋亡抑制基因的表达,来保护细胞免于凋亡[13]。因NF-κB对维持细胞抵抗肿瘤坏死因子(TNF)的杀伤起着关键性作用[14],而推测NF-κB的抑制凋亡作用可能是通过肿瘤坏死因子受体-1介导的。很多证据显示,NF-κB与肿瘤多药耐药密切相关,并且可能从多方面涉及多药耐药性的发生、发展和形成[15-16],可在各种刺激尤其是化疗药物的作用下高表达,并抵抗化疗药物的促凋亡作用。NF-κB信号传导通路关键蛋白磷酸化水平与其活性密切相关,在本实验中,通过WB法,发现TALAS可下调其关键蛋白磷酸化水平,抑制NF-κB信号传导通路的活性。因此,推测TALAS与顺铂的协同作用可能与其诱导凋亡及降低耐药蛋白表达有关,而此作用可能是通过抑制NF-κB信号传导通路的活性来实现的。
[1]Chêne G,Penault- Llorca F,Raoelfils I.Ovarian carcinogenesis:recent and past hypotheses[J].Gynecol Obstet Fertil,2011,39(4):216-223.
[2]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61:212 -236.
[3]王春梅,张广美.辽东楤木叶总皂苷对卵巢癌细胞的抑制作用及其线粒体凋亡途径的影响[J].中医药学报,2011,8(3):13 -16.
[4]王春梅,张广美.辽东楤木叶总皂苷逆转卵巢癌细胞耐药的实验研究[J].世界中西医结合杂志,2012,8(7):23 -26.
[5]Chen ZS,Mutoh M,Sumizawa T,et al.An active efIqux system for heavy metals in cisplatin - resistant human KB carcinoma cells[J].Exp Cell Res,1998(240):312 - 320.
[6]Pectasides D,Pectasides M,Farmakis D,et al.Oxaliplatin and irinotecan plus granulocyte-colony stimulating factor as third-line treatment in relapsed or cisplatin-refractory germ cell tumor patients:a phase II study[J].Eur Urol,2004,46(2):216 -221.
[7]Lyakhovich A,Shekhar.MRP overexpression confers chemoresistance:RAD6 expression during cell cycle and its redistribution to chromatin during DNA damage - induced response[J].Oncogene,2004,23(17):3097 -3106.
[8]Leitao AA,Leite CA,Santos BC,et al.HSP induced by hyperosmotic stress partially protects cells against nephrotoxic drugs[J].Nephron Exp Nephrol,2003,94(3):94 -102.
[9]RA Moorehead,G Singh.Influence of the proto-oncogene c- fos on cisplatin sensitivity[J].Biochem Pharmacol,2000(59):337 - 345.
[10]Vikhanskaya,MD'Incalci,M Broggini.The p73 competes with p53 and attenuates its response in a human ovarian cancer cell line[J].Nucleic AcidsRes,2000(28):513 -519.
[11]D Zwahlen,Tschan,TJ Grob,et al.Differential expression of p73 splice variants and protein in benign and malignant ovarian tumours[J].Int J Cancer,2000(88):66 - 70.
[12]王春梅,张广美.辽东楤木叶总皂苷对卵巢癌细胞的抑制作用及其对线粒体凋亡途径的影响[J].中医药学报,2011,39(1):17-19.
[13]Bentires-mj M,Barbu V,Fillet M,et al.NF -kappaB transcription factor induces drug resistance through MDR1 expression in cancer cells[J].Oncogene,2003:22(1):90 - 97.
[14]Ros JE,Schuetz JD,Geuken M,et al.Induction of Mdrl expression by tumor necrosis factor-alpha in rat liver cells is independent of p53 but requires NF - kappaB signaling[J].Hepatology,2001,33(6):1425-1431.
[15]Cusack JC Jr,Liu R,Baldwin AS Jr.Inducible chemoresistance to 7-ethyl-10-[4-(1-piperidino)-1-piperidino]-carbonyloxycamp to-the cin(CPT-11)in colorectal cancer cells and a xenograft model is overcome by inhibition of nuclear factor-kappaB activation[J].Cancer Res,2000,60(9):2323 -2330.
[16]何凯,雷娟,卢战凯,等.NF-κB在卵巢癌顺铂耐药株 COC1/DDP中的表达及意义[J].实验诊断学,2008,10(9):1113-1114.

