肝癌肝动脉化疗栓塞治疗对缺氧诱导因子2α表达的影响及其临床意义
孙海香 杨欣荣 徐泱 樊嘉,2
(1.复旦大学附属中山医院肝癌研究所,上海 200032;2.复旦大学附属生物医学研究院,上海 200032)
肝动脉化疗栓塞(transarterial chemoembolization,TACE)是治疗中晚期肝癌常选的非手术治疗方法。缺氧诱导因子2α(hypoxia inducible factor 2 alpha,HIF-2α)是细胞适应缺氧微环境的重要转录因子,是HIFs家族的重要成员之一。HIF-2α参与细胞代谢、增殖、凋亡和血管生成,在非小细胞肺癌、胰腺癌、宫颈癌和结直肠癌等多种肿瘤中表达异常[1-2]。目前,关于 HIF-2α在肝癌中的表达研究较少,且争议颇多[3-6]。本研究旨在探讨 TACE治疗对肝癌组织中HIF-2α表达水平的影响,并分析其表达水平与其他病理因素的相关性,企盼阐明HIF-2α在肝癌的发生、侵袭与转移中的作用机制。
1 资料与方法
1.1 一般资料 采用复旦大学附属中山医院2001—2005年经TACE治疗后手术切除的157例肝癌患者的肝癌组织,用于组织芯片染色。组织芯片的制备参考Gao等[7]的作法。从上述157例肝癌组织中随机选取30例肝癌组织;同时收集未经TACE治疗而直接行手术切除的30例肝癌患者的肝癌组织。
1.2 试剂 RIPA裂解液、Bradford蛋白浓度测定试剂盒(江苏碧云天公司);Trizol试剂(美国Invitrogen公司);实时荧光定量逆转录-聚合酶链反应(RT-PCR)试剂盒(日本 Takara公司);HIF-2α及3-磷酸甘油醛脱氢酶(GAPDH)引物由上海生工生物工程公司合成;HIF-2α及GAPDH抗体(英国Abcam公司);辣根过氧化物酶(HRP)标记二抗免疫组化试剂盒(上海长岛生物技术公司)。
1.3 RT-PCR检测 HIF-2α基因表达 肝癌组织RNA抽提参照Trizol试剂盒说明书操作。HIF-2α和GAPDH的引物序列同参考文献[4],按试剂盒说明书操作,反应条件为:94℃预变性5min后;95℃变性15s,60℃退火30s,72℃延伸30s,共30个循环;最后72℃延伸10min。
1.4 蛋白质印迹法(Western blot)检测 HIF-2α蛋白表达 采用考马斯亮蓝法(Bradford法)检测标本组织抽提液中总蛋白的浓度,操作步骤参照说明书。
1.5 免疫组织化学(IHC)方法检测 HIF-2α蛋白分布 采用IHC-SP法,参照试剂盒说明书进行操作。按照阳性细胞数占同类计数细胞的百分比,将染色结果分为低表达与高表达,以50%为标准。
1.6 统计学处理 采用SPSS 12.0软件进行统计分析,计量资料以均数±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 TACE治疗后肝癌组织中 HIF-2α的表达TACE治疗后肝癌组织中HIF-2α的mRNA水平显著上升(P<0.05),见图1A;Western blot也显示,TACE治疗后HIF-2α蛋白表达水平显著上升,与非TACE治疗而直接手术治疗的肝癌患者的HIF-2α表达水平比较,差异有统计学意义(P<0.05),见图1B。

图1 TACE组和手术组术后肝癌组织中HIF-2α的mRNA及蛋白的表达水平
2.2 IHC分析TACE治疗后肝癌组织中 HIF-2α的表达分布 IHC显示,HIF-2α蛋白阳性信号主要定位于肝癌细胞的细胞核和胞浆中,呈棕黄色或者褐色,见图2。
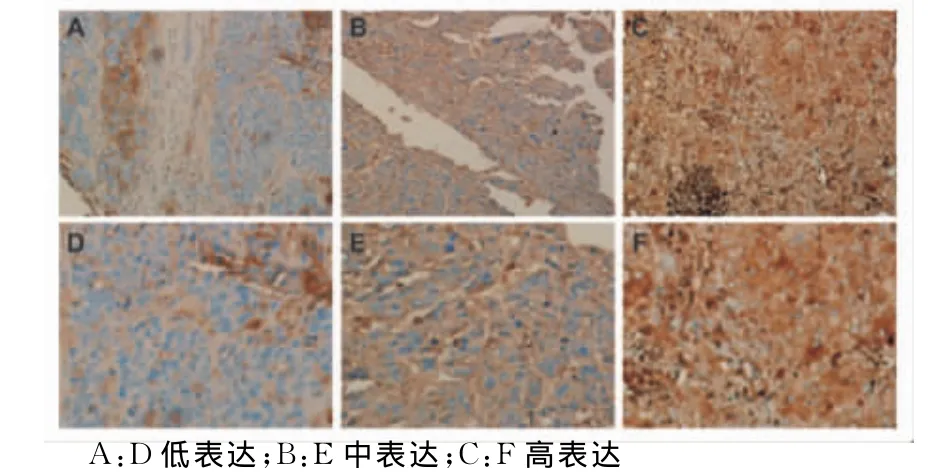
图2 肝癌组织中HIF-2α表达情况(A~C:×100;D~F:×200)
2.3 HIF-2α在TACE治疗的肝癌患者中的临床意义 甲胎蛋白水平、γ-谷氨酰转肽酶水平、肿瘤直径和包膜完整性与肝癌患者的总体生存时间(overall survival,OS)相关(P<0.05);γ-谷氨酰转肽酶水平、肿瘤直径和包膜完整性与肝癌患者的无瘤生存时 间 (disease-free survival,DFS)相 关 (P<0.05);HIF-2α蛋白表达水平与肝癌患者的 OS相关(P<0.05),而与DFS无关(P>0.05)。
3 讨 论
TACE是中晚期肝癌常用的治疗方法。TACE既可直接在肿瘤组织中施以药物杀伤癌细胞,又可栓塞供养肿瘤的血管,阻断肿瘤血供,致肿瘤组织缺血、缺氧,进而使肿瘤失去活力。HIF-2α能调节肿瘤坏死因子-α、c-Myc、血管内皮生长因子、Twist等多个在肿瘤生长、转移和血管生成等过程中起着重要作用的基因的表达。目前,关于HIF-2α在肝癌中的研究相对较少,其作用也有争议。有研究[6]指出,HIF-2α表达水平与肝癌中的血管密度相关,HIF-2α水平高的患者预后较差。也有研究[4]表明,HIF-2α可促进肝癌细胞自噬、凋亡,提示HIF-2α可能在肝癌发生过程中起着抑制作用。也有研究[8]发现,HIF-2α参与E2F1信号通路,促进细胞凋亡,肝癌组织中HIF-2α的表达水平与肿瘤直径呈负相关。本研究发现,TACE治疗后肝癌组织中HIF-2α的表达水平显著上升,并且其表达水平与肝癌患者的OS相关,这进一步证实HIF-2α参与了肝癌的发展。进一步深入研究HIF-2α的功能及其作用机制,将对肝癌的治疗具有十分重要的意义。
[1] Brown JM,Wilson WR.Exploiting tumour hypoxia in cancer treatment[J].Nat Rev Cancer,2004,4(6):437-447.
[2] Keith B,Johnson RS,Simon MC.HIF1αand HIF2α:sibling rivalry in hypoxic tumour growth and progression[J].Nat Rev Cancer,2011,12(1):9-22.
[3] Talks KL,Turley H,Gatter KC,et al.The expression and distribution of the hypoxia-inducible factors HIF-1alpha and HIF-2alpha in normal human tissues,cancers,and tumor-associated macrophages[J].Am J Pathol,2000,157(2):411-421.
[4] Menrad H,Werno C,Schmid T,et al.Roles of hypoxia-inducible factor-1alpha(HIF-1alpha)versus HIF-2alpha in the survival of hepatocellular tumor spheroids[J].Hepatology,2010,51(6):2183-2192.
[5] He C,Sun XP,Qiao H,et al.Downregulating hypoxia-inducible factor-2αimproves the efficacy of doxorubicin in the treatment of hepatocellular carcinoma[J].Cancer Sci,2012,103(3):528-534.
[6] Bangoura G,Liu ZS,Qian Q,et al.Prognostic significance of HIF-2alpha/EPAS1expression in hepatocellular carcinoma[J].World J Gastroenterol,2007,13(23):3176-3182.
[7] Gao Q,Qiu SJ,Fan J,et al.Intratumoral balance of regulatory and cytotoxic T cells is associated with prognosis of hepatocellular carcinoma after resection[J].J Clin Oncol,2007,25(18):2586-2593.
[8] Sun HX,Xu Y,Yang XR,et al.HIF-2αinhibits hepatocellula carcinoma growth through the TFDP3/E2F1-dependent apoptotic pathway[J].Hepatology,2012[Epub ahead of print].

