抗菌肽FAPs在毕赤酵母中的重组表达研究
冯兴军,李 静,宋雪莹,许文杉,邢丽维,柳 迪
(东北农业大学动物科学技术学院,哈尔滨150030)
抗菌肽(Antimicrobial peptides)是生物体在病原体刺激下,免疫防御系统产生的一类具有生物学活性小分子多肽,是动植物非特异免疫系统重要成分[1],广泛分布于细菌、真菌、高等植物、昆虫、两栖类、哺乳动物以及人类体内[2]。抗菌肽具有抗菌、抗病毒、抗肿瘤、免疫调节等作用[3-4]。和抗生素相比,抗菌肽具有分子质量小、抗菌谱广、水溶性好、耐热性强、无免疫原性和作用机制独特等优点,不易引起微生物耐药性,被认为是替代抗生素有效药物之一[5]。
鸡源抗菌肽Fowlicidins-2能够快速杀菌,受盐离子浓度影响小,对抗性菌株有很强抑制作用[6]。天蚕素B(Cecropin B)具有抑制肿瘤细胞和免疫调节作用,对高等动物正常细胞无损伤,对DNA、RNA病毒有很强抑制作用[7]。Merrifield等对天蚕素A(Cecropin A)和蜂毒素(Melittin)进行结构改造后得到Cecropin A(1-8)-Melittin(1-18),不但没有蜂毒素溶血作用,其抗菌活性也有明显提高,且该杂合肽还具有较天蚕素A和蜂毒素更广抗菌谱[8]。死亡素(Thanatin)结构简单,对G+菌、G-菌和某些真菌都有抑制作用,但是对金黄色葡萄球菌活性较低,对哺乳动物细胞不表现出溶血性。本研究根据这四种抗菌肽氨基酸序列,设计合成四种抗菌肽融合基因,并利用基因工程方法在毕赤酵母中成功表达,为基因工程方法制备抗菌肽寻求技术路线,为进一步研究其功能和应用奠定理论基础。
1 材料和方法
1.1 试验材料
1.1.1 质粒及菌株
质粒pPICZαC、毕赤酵母SMD1168购自Invit⁃rogen公司;E.coliDH 5α、E.coliATCC25922、S.aureusATCC25923、S.syphimuriumC77-31和P.ae⁃ruginosaATCC27853为本实验室保存。
1.1.2 试剂
限制性内切酶XholⅠ、XbalⅠ、SacⅠ、T4连接酶(购自Takara(大连)有限公司);DNA分子质量Marker、小分子质量蛋白Maker、Zeocin、Tri⁃cine(购自上海生工生物工程技术服务有限公司);琼脂糖凝胶回收试剂盒、质粒提取试剂盒(购自北京康为生物公司);其他试剂为国产分析纯;多核苷酸及DNA测序由上海生工生物工程技术服务有限公司完成。
1.2 方法
1.2.1 抗菌肽FAPs基因设计与合成
将4种抗菌肽Fowlicidin-2、Cecropin B、Ce⁃cropin A(1-8)-Melittin(1-18)、Thnantin 串联,并在每种抗菌肽N端加入Kex2裂解位点(-Glu-Lys-Arg-),形成四种抗菌肽串联体FAPs,根据FAPs氨基酸序列,化学合成具有酵母密码子偏爱性编码基因,并在编码基因5'和3'端分别引入XholⅠ、XbalⅠ酶切位点。将设计好的基因核苷酸序列送由上海生工生物工程技术服务有限公司合成并连入载体pUC57。
1.2.2 重组表达载体构建
XholⅠ、XbalⅠ双酶切含有目基因克隆载体,获得目的基因,与表达载体pPICZαC连接,转化E.coli的DH 5α[9]。PCR筛选阳性克隆,所用引物为载体上的通用引物,上游引物:5'GAC TGG TTC CAA TTG ACA AGC 3';下游引物:5'GCA AAT GGC ATT CTG ACA TCC 3',反应条件:94℃ 5 min;94℃ 1 min,59℃ 1 min,72℃ 1 min,30个循环;72℃10 min。提取质粒通过XholⅠ、XbaⅠ双酶切、DNA测序进一步验证,获得重组表达质粒pPICZαC-FAPs。
1.2.3 重组表达载体转化及转化子筛选
SacⅠ线性化pPICZαC-FAPs(5~10 μg),电转化毕赤酵母SMD1168,转化条件:3 000 V、25 μF、200 Ω电击5 ms,30 ℃温育复性1~1.5 h后涂MD(含100 μg·mL-1Zeocin)平板,30℃培养至出现单菌落,PCR方法鉴定转化子,用冻-煮-冻法[10]制备PCR模板,所用引物及PCR反应条件同1.2.2。
1.2.4 抗菌肽诱导表达
将筛选得到的酵母转化子单菌落接种于5 mL YPD培养基中,30 ℃、280 r·min-1培养16~17 h,取50 μL培养液转接到25 mL BMGY中,30℃、300 r·min-1培养到OD值为2~6,收集菌体转接于50 mL BMMY培养基中,30℃、300 r·min-1、1%甲醇诱导72 h,其间每隔24 h补加甲醇使其终浓度为0.5%~1%。诱导后离心收集上清,冷冻干燥,取样15%Tricine-SDS-PAGE分析[11],Bradford法测定上清中蛋白含量。
1.2.5 重组FAPs抗菌活性初步测定
直径为5 mm圆形滤纸片高压蒸汽灭菌,放入pPICZαC-FAPs转化子培养上清中,浸泡2 h,取出风干备用。将对数生长中期E.coliATCC25922用PBS制成悬液,调整OD600至0.2左右,此时细菌浓度约为5×107cfu·mL-1,取0.2 mL菌悬液加在LB琼脂平板上,均匀涂开。将滤纸片放在平板上,以pPICZα-C空载转化酵母培养上清浸泡滤纸片为阴性对照,37℃倒置培养18 h。
1.2.6 重组FAPs最小抑菌浓度测定
采用微量肉汤稀释法测定重组FAPs抑菌活性。0.02%乙酸溶液(含0.4%牛血清白蛋白)稀释FAPs,得到2倍梯度度稀释抗菌肽贮存液(2 560,1 280,…,10和5 μg·mL-1),存放于聚丙烯离心管中。测试菌接种于MHA培养基中过夜培养,将测试菌过夜培养物稀释至 2×105~7×105cfu·mL-1,分别取100 μL加到96孔细胞培养板每行1~11号孔,将按梯度稀释抗菌肽11 μL对应加到1~10号孔,11号孔不加抗菌肽,作为阳性对照,12号孔加入100 μL新鲜MHB培养基作为空白对照,37℃培养18至24 h后,用酶标仪测490 nm吸光值。吸光度比11号孔低50%以上孔内浓度即定义为对该测试菌最小抑菌浓度MIC。试验在无菌条件下操作,重复3次。
2 结果与分析
2.1 FAPs编码基因合成及重组表达载体构建
2.1.1 FAPs编码基因合成
根据四种抗菌肽氨基酸序列,设计具有酵母密码子偏爱性编码基因,在每种抗菌肽N-端加入编码Kex2裂解位点(-Glu-Lys-Arg-)3个密码子,在编码基因5'和3'端分别引入XholⅠ、XbalⅠ酶切位点,编码序列大小381 bp,化学方法合成并克隆到pUC57。
2.1.2 重组表达载体pPICZαC-FAPs的构建
PCR所用上下游引物分别与pPICZαC855-875、1 423~1 443间碱基互补,以该对引物筛选重组质粒,经2%琼脂糖凝胶电泳,如图1所示,含有质粒pPICZαC菌落为模板PCR产物DNA条带为588 bp,而阳性重组质粒PCR扩增产物DNA条带为882 bp。测序结果表明,碱基序列与设计完全一致,说明成功构建重组质粒。
2.2 FAPs在毕赤酵母SMD1168中表达
2.2.1 重组表达载体转化
重组表达载体经SacⅠ线性化后,电转化毕赤酵母SMD1168,利用PCR方法进一步筛选阳性菌落,如图2所示,阳性对照,即以含有质粒pPICZαC酵母菌落为模板的PCR产物为588 bpDNA条带,而阳性重组质粒,即以含有重组质粒pPICZαC-FAPs酵母菌落为模板的扩增产物为882 bp DNA条带,说明重组质粒pPICZαC-FAPs和质粒pPICZαC已成功转入毕赤酵母SMD1168中。
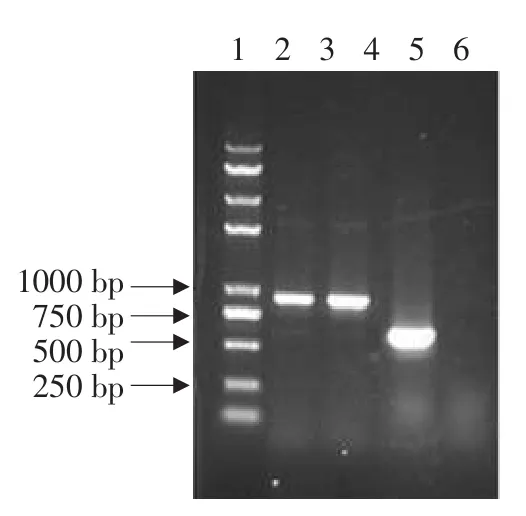
图1 PCR方法筛选重组质粒pPICZαC-FAPsFig.1 PCR screening of the recombinant plasmid pPICZαC-FAPs
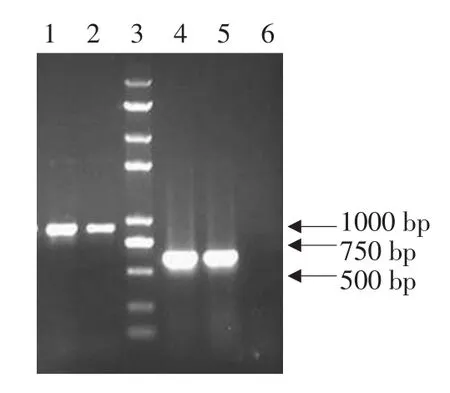
图2 PCR方法筛选pPICZαC-FAPs酵母转化子Fig.2 PCR screening of the yeast transformant of pPICZαC-FAPs
2.2.2 FAPs诱导表达
按照优化诱导条件,30℃、pH 6.0、甲醇终浓度为1%,诱导72 h,取上清冷冻干燥后,进行Tricine-SDS-PAGE分析,如图3所示,重组表达质粒pPICZαC-FAPs转化子产生一条约为14 ku特异蛋白带,与预期FAPs蛋白大小大小一致,上清中蛋白浓度为32 mg·L-1。

图3 pPICZαC-FAPs转化子表达产物Tricine-SDS-PAGE分析Fig.3 Tricine-SDS-PAGE analysis of the expression of P.pastoris transformed with the recombinant plasmid pPICZαC-FAPs
2.3 FAPs抑菌活性初步检测
为初步检测所表达FAPs是否具有抗菌活性,以对数生长中期E.coliATCC25922为指示菌,利用纸片法检测FAPs抗菌活性,结果如图4所示,含有FAPs上清处理纸片周围出现明显抑菌圈,而对照纸片周围没有出现抑菌现象,表明抗菌肽FAPs具有一定抑菌活性。

图4 FAPs对E.coli ATCC25922抑菌活性Fig.4 Antibacterial activity of FAPs against E.coli
2.4 FAPs抑菌活性测定
利用微量肉汤稀释法测定抗菌肽FAPs对E.coliATCC25922、S.aureusATCC25923、S.typhimuriumC77-31和P.aeruginosaATCC27853最小抑菌浓度MIC,随着抗菌肽浓度提高,四种菌生长均受到不同程度抑制,如表1所示,测得FAPs对金黄色葡萄球菌抑菌作用最强,其MIC值为8.0 μg·mL-1。
3 讨论与结论
抗菌肽无残留、无毒害、具有广谱抗菌能力,受到越来越多关注。自然界中存在丰富抗菌肽资源,可利用这些抗菌肽作模版,人工设计并合成功能型小肽。由于天然存在抗菌活性偏低、甚至对真核生物细胞具有毒性、引起红细胞溶血缺点,因此抗菌肽存在很大改造空间[12]。目前改造抗菌肽主要方法包括:①氨基酸残基替换[13];②截取天然抗菌肽部分氨基酸序列[14];③杂合肽,即将两种或两种以上抗菌肽经改造后连接在一起[15],杂合抗菌肽表现出较天然抗菌肽更高抗菌活性[16]。
近年来利用基因工程方法已经成功表达多种抗菌肽,对建立肽基因工程菌和抗菌肽研究具有重要意义。毕赤酵母作为表达外源蛋白宿主菌,营养要求低,易于培养。存在酵母氧化酶AOX1基因,将其作为外源基因启动子,受甲醇诱导,能够严格调控外源蛋白表达。在表达过程中酵母自身分泌到培养基中蛋白较少,简化后期蛋白分离与纯化过程,具有遗传高稳定性。毕赤酵母还可以对表达外源蛋白进行翻译后加工和修饰,使表达蛋白质获得正确折叠、糖基化和N-末端加工,从而使表达蛋白具有生物活性。毕赤酵母SMD 1168,是一类蛋白酶缺失宿主菌[17],表达过程中能保护表达产物免受降解,促进表达量提高。
为提高抗菌肽抗菌活性,消除抗菌肽溶血性及细胞毒性,本研究根据四种抗菌肽结构特点,利用毕赤酵母密码子偏爱性设计合成抗菌肽FAPs,并选择毕赤酵母SMD1168为表达宿主菌进行表达,成功获得大小为14 ku抗菌肽FAPs,产量为32 mg·L-1。经抑菌活性检测,结果表明FAPs对G+及G-菌均有不同程度抑菌活性,其中对金黄色葡萄球菌抑菌活性最强,其MIC为8.0 μg·mL-1。虽然得到具有抑菌活性重组抗菌肽FAPs,但还需对其他生物活性,如抗菌谱、免疫原性、免疫调节、抑制肿瘤作用及其机制进行深入研究。
[1]Brogden,K A.Antimicrobial peptides∶pore formers or metabolic inhibitors in bacteria[J].Nat Rev Microbiol,2005,3(3)∶238-250.
[2]Hancock R E.Cationic peptides∶effectors in innate immunity and novel antimicrobials[J].The lancet Infect Dis,2001,1(3)∶156-164.
[3]Jin F L,Xu X X,Zhang W Q,et al.Expression and characteriza⁃tion of a housefly Cecropin gene in the methylotrophic yeast,Pich⁃ia pastoris[J].Protein Expr Purif,2006,49(1)∶39-46.
[4]Lapis K.Physiologic and path physiologic significance of antimi⁃crobial(host defensive)small peptides[J].Orv Hetil,2008,149(51)∶2419-2424.
[5]陈福,罗玉萍,龚反熹,等.抗菌肽耐药性研究进展[J].微生物学通报,2008,35(11)∶1186-1790.
[6]Bommineni Y R,Dai H,Gong Y X,et al.Fowlicidin-3 is aβ-he⁃lical cationic host defense peptide with potent antibacterial and li⁃popolysaccharide-neutralizing activities[J].FEBS J,2007,274(2)∶418-428
[7]Gankovskaia O A.Kovalchuk L V,Gankovskaia LV,et al.Role of Toll-like receptors and defensins in antimicrobial protetion of urogenital tract in females[J].Zh Mikrobiol Epidemiol Immunobi⁃ol,2008,(1)∶46-54.
[8]Merrifield R B,Merrifield E L,Juvvadi P,et al.Design and syn⁃thesis of antimicrobial peptides[J].Ciba Fond Symp,1994,186∶5-20.
[9]奥斯伯F,布伦特R,金斯顿R E.精编分子生物学实验指南[M].北京∶科学出版社,1998.
[10]刘秋云,罗樨,何康泽,等.快速制备酵母质粒和基因组DNA PCR模板[J].微生物学通报,2011,28(5)∶77-79.
[11]Schagger H,von Jagow G.Tricine-sodium dodecyl sulfate-poly⁃acrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 ku[J].Anal Biochem,1987,166(2)∶368-379.
[12]张昊,牛海涛,李改瑞,等.抗菌肽分子结构对其活性的影响[J].中国抗生素杂志,2010,35(12)∶892-897.
[13]Feng X J,Liu C L,Guo J Y,et al.Expression and Purification of an antimicrobial Peptide,Bovine Lactoferricin Derivative LfcinBW10 inEscherichia coli[J].Curr Microbiol,2009,60(3)∶179-184.
[14]杨细媚,文阳安,万祥辉,等.天蚕素A截短肽在大肠埃希菌中的高效表达及活性分析[J].中国抗生素杂志,2010,35(1)∶20-23.
[15]Schlamadinger D E,Wang Y,McCammon J A,et al.Spectroscop⁃ic and Computational Study of Melittin,Cecropin A,and the Hy⁃brid Peptide CM15[J].J Phys Chem B,2012,116(35)∶10600-10608.
[16]冯兴军,李静,赵晓宇,等.牛乳铁蛋白素-马盖宁杂合抗菌肽的设计、合成及抑菌活性[J].东北农业大学学报,2011,42(3)∶105-109.
[17]Van Den Hazel H B,Kielland-Brandt M C,Winther J R.Review∶biosynthesis and function of yeast vacuolar proteases[J].Yeast,1996,12(1)∶1-16.

