金纳米粒子掺杂DNA-CTMA-DPFP薄膜的表面增强拉曼散射特性
颜承恩,周 骏*,李 星,束 磊,马亚楠
(1.宁波大学理学院光电子技术研究所,浙江宁波 315211;2.宁波大学材料科学与化学工程学院,浙江宁波 315211)
1 引 言
2001年,日本的Ogata小组从三文鱼的卵和精囊中提取出了具有优良光电特性的DNA材料[1]。基于DNA生物光子材料,人们开展了生物传感器[2]、生物有机发光二极管[3]、有机场效应晶体管[4]及荧光染料掺杂DNA-类脂生物材料的ASE特性的研究工作[5]。另一方面,贵金属纳米粒子局域表面等离子共振(LSPR)产生的电磁场增强效应和表面增强拉曼散射(SERS)特性,在生物传感领域有广阔的应用前景[6]。当制备出间隙为纳米尺寸大小的金纳米阵列或者相同形状的金纳米粒子聚集成小簇时,同单个纳米粒子相比,其局域电磁场增强的“热点”作为SERS基底,能够产生显著的SERS响应[7-12]。因此,近年来,根据贵金属纳米粒子和DNA生物光子材料的优点,金纳米粒子与DNA的结合体系,成为当前材料学和生物光子学领域的重要研究对象[13]。例如,生物寡核苷酸能够在三维空间定位纳米粒子,寡核苷酸与金纳米粒子的轭合物可以用于检测DNA序列[14]。同样,金纳米粒子与荧光染料分子的混合体系,可用作光学和电子显微镜的标记物检测DNA或者蛋白质的能量传输[15-16]。
本文利用水相还原法制备金纳米粒子[17],并通过离子交换法制备DNA-CTMA生物材料[5],将金纳米粒子与DNA-CTMA均匀掺杂,制备出金纳米粒子掺杂DNA-CTMA材料。另外,利用钯催化反应合成 9,9-二乙基-2,7-二-(4-吡啶)芴(DPFP)荧光染料[18]与金纳米粒子掺杂DNA-CTMA材料混合,制备出金纳米粒子掺杂DNA-CTMA-DPFP材料,并甩胶制备成膜。分别测量金纳米粒子掺杂与不掺杂的DNA-CTMA-DPFP薄膜样品的吸收、荧光和拉曼光谱,研究了金纳米粒子掺杂质量比对DNA-CTMA-DPFP薄膜的SERS的影响。
2 材料制备及表征
2.1 材料与仪器
化学材料:氯金酸(99.9%)及鲑鱼 DNA,十六烷基三甲基溴化铵(CTMA)(99%),柠檬酸三钠(99%),9,9-二乙基-2,7-二溴芴,4-吡啶硼酸,碳酸钠,四三苯基磷钯,乙二醇二甲醚,二氯甲烷,石油醚,乙酸乙酯等,均为外购的分析纯材料。自备去离子水的电阻率为18 MΩ·cm。
仪器:场发射扫描电子显微镜(SU-70,日本日立公司)、便携式拉曼光谱仪(BWS415i-Raman TM,美国必达泰克公司)、双光束紫外可见分光光度计(TU-1901,北京普析通用仪器有限公司)、荧光分光光度计(F-4500,日本日立公司)、高速冷冻离心机(TGL-20M,上海湘仪公司)、均胶机(SC-1B,北京创威纳科技有限公司)、电热板(EH35B,广州市博泰科技仪器有限公司)。
2.2 金纳米粒子掺杂DNA-CTMA材料的制备
首先采用柠檬酸三钠法制备金纳米粒子。取250 mL质量分数为0.01%的氯金酸水溶液,搅拌加热至沸腾后,加入250 μL质量分数为1%的柠檬酸三钠水溶液,保持沸腾,氯金酸水溶液颜色变成酒红色,10 min后停止加热,自然冷却,即得到金纳米粒子胶体溶液。
考虑到金纳米粒子、CTMA以及DNA的相溶性,先在金纳米粒子胶体溶液中加入1 g的CTMA粉末,再取250 mL质量分数为0.4%的DNA水溶液,将含CTMA的金纳米粒子胶体溶液逐滴加入到DNA水溶液中。此时DNA和CTMA发生离子交换反应,生成金纳米粒子掺杂DNA-CTMA紫色沉淀物。室温静置8 h后,离心分离沉淀物,用去离子水冲洗沉淀物,去除杂质并烘干,即得到金纳米粒子掺杂DNA-CTMA粉末,金的质量分数为0.725%。该材料可以溶于正丁醇、酒精等溶剂。
然后,分别配制200 mL质量浓度为4 g/L的DNA水溶液和CTMA水溶液,将CTMA水溶液逐滴加入到DNA水溶液中,进行离子交换反应,室温下静置约6 h。离心分离出DNA-CTMA沉淀,用去离子水冲洗沉淀物,去除杂质并烘干,得到干燥的DNA-CTMA白色粉末。
称量100,98,96,94,92 mg 的 DNA-CTMA 材料,分别溶于2 mL的正丁醇溶液,磁力搅拌8 h,制备出5份DNA-CTMA正丁醇溶液,分别记为1#、2#、3#、4#、5#溶液。称量 25 mg 金纳米粒子掺杂的DNA-CTMA粉末溶于1 mL正丁醇溶液,并分别量取80,160,240,320 μL 该溶液,加入到2#、3#、4#、5#DNA-CTMA 正丁醇溶液中,制备成 4 种金纳米粒子同DNA-CTMA质量比为0.014 5%、0.029%、0.043 5%和 0.058%的金纳米粒子掺杂DNA-CTMA正丁醇溶液。
2.3 金纳米粒子掺杂DNA-CTMA-DPFP的材料制备
根据文献[18]合成DPFP材料。首先取9,9-二乙基-2,7-二溴芴(1.14 g,3 mmol)、4-吡啶硼酸(0.93 g,7.5 mmol)、碳酸钠(1.3 g,12 mmol)和四(三苯基磷)钯(0.12 g,0.1 mmol)加入到 150 mL的两颈圆底烧瓶中,抽真空充氮气3次。然后将乙二醇二甲醚(80 mL)和水(40 mL)在氮气保护下加进反应瓶,混合溶液加热至回流反应48 h,冷却至室温,用二氯甲烷萃取,合并有机层,用大量的盐水洗涤,无水硫酸镁干燥3 h后浓缩得到粗产品。采用硅胶柱色谱 (V(石油醚)∶V(乙酸乙酯)=1∶2) 分离出 9,9-二乙基-2,7-二-(4-吡啶)芴(DPFP),分子式为C27H24N2,相对分子量为376,结构式如图1所示,DPFP含有2个苯环、2个含氮杂环及2个乙基。

图 1 9,9-二乙基-2,7-二-(4-吡啶)芴分子的结构图Fig.1 Molecular structure of DPFP
称量15 mg DPFP溶于15 mL正丁醇溶液中,超声45 min。然后分别量取2 mL的染料正丁醇溶液加入1#DNA-CTMA 正丁醇溶液及2#、3#、4#、5#金纳米粒子掺杂的DNA-CTMA正丁醇溶液中,磁力搅拌12 h后,将每份溶液浓缩到2 mL,得到1份DNA-CTMA-DPFP正丁醇溶液,4份金纳米粒子掺杂的DNA-CTMA-DPFP正丁醇溶液。
2.4 薄膜样品制备
以石英玻璃为衬底,旋凃以上5个样品溶液,转速1 000 r/min,时间 60 s,60 ℃下烘烤 8 h,即得到膜厚约为3 μm的DNA-CTMA-DPFP薄膜样品和4种金纳米粒子掺杂的DNA-CTMA-DPFP薄膜样品,分别记为样品1#~5#。在5种薄膜样品中,DPFP分子的质量分数均为2%。
2.5 金纳米粒子紫外可见吸收光谱和SEM形貌
分别用紫外可见分光光度计和场发射扫描电子显微镜观测实验制备的金纳米粒子胶体溶液的吸收光谱和SEM形貌,结果如图2(a)、(b)所示。从图2(a)可知,金纳米粒子的局域表面等离子共振吸收峰位于532 nm;从图2(b)可知,金纳米粒子为球形,大部分纳米粒子的粒径为20 nm,呈均匀分布。球形金纳米粒子的表面光学性质各向同性,其局域表面等离子共振峰的形状(半峰全宽FWHM)与粒子的粒径分布有关,峰形比较对称而且半峰全宽较窄,表明粒子的粒径分布较均匀,与纳米粒子的SEM图结果相吻合。

图2 金纳米粒子的(a)吸收光谱和(b)电子扫描显微镜(SEM)图Fig.2 Absorption spectrum(a)and Scanning electron microscope(SEM)imagine(b)of the gold nanoparticles
2.6 薄膜样品紫外可见吸收和荧光光谱
用紫外-可见分光光度计和荧光光度计分别检测薄膜样品的吸收光谱和荧光光谱,结果如图3(a)、(b)所示。

图3 薄膜样品的吸收光谱(a)及荧光光谱(b)Fig.3 Absorption spectra(a)and fluorescence spectra(b)of the film samples
从图3(a)可见,5个样品在300~360 nm的吸收来自芴类荧光染料DPFP[18],其吸收峰强度与金掺杂质量比有关,而样品2#比样品1#以及样品5#比样品4#的吸收峰强度小可能是膜厚误差造成的。图3(a)中的插图是放大的5个样品在450~700 nm之间的吸收光谱,样品1#没有吸收峰,样品2#~5#存在明显的吸收。对比图2(a)发现,样品2#~5#在500~700 nm之间的吸收来自于薄膜样品中金纳米粒子局域表面等离子共振吸收,并且随金掺杂质量比的增加而增强。从图3(b)可知,样品的荧光光谱位于350~475 nm的蓝紫光区域,分别在370 nm和386 nm出现荧光峰,在408 nm处有不太明显的一个肩峰,分别对应DPFP的S10-S00、S10-S01和S10-S02能级的电子振动跃迁[18]。
3 拉曼光谱测量及结果分析
3.1 拉曼光谱测量的实验光路
采用显微镜采样系统和拉曼探头相结合的方式对薄膜样品及DPFP和DNA-CTMA材料进行拉曼光谱检测。

图4 拉曼检测实验光路示意图Fig.4 Experimental setup for Raman measurements
实验光路如图4所示。来自拉曼光谱仪的激光光源,通过输出光纤传送到拉曼探头,拉曼探头与显微采样系统连接,经显微物镜聚焦后照射在薄膜样品上,再经样品反射后被物镜采集并由光纤拉曼探头传输至拉曼光谱仪进行分析。实验所用的拉曼激发光波长为785 nm,激光功率为48 mW,信号采集积分时间为10 s,扫描区间为500~2 700 cm-1。显微镜采样系统中物镜的放大倍率为40。测量过程中,将DPFP材料压制成片状,将薄膜样品及压制成片状的DPFP及DNA-CTMA薄膜,分别放置于显微镜载物台上,通过CCD视频系统观察照射光斑的大小,调节载物台位置,使薄膜样品位于物镜的焦平面。
3.2 结果分析
实验测得的DPFP和DNA-CTMA及5种薄膜样品的拉曼光谱如图5(a)和图5(b)所示。从图5(a)可知,在785 nm激光激发下,DPFP在559,730,828,996,1 142,1 227,1 301,1 348,1 484,1 614 cm-1处出现拉曼散射峰。根据文献[19]的分析,1 614 cm-1的拉曼散射峰为苯环的伸缩振动,1 142 cm-1的拉曼散射峰为C—H的弯曲振动,1 227 cm-1的拉曼散射峰为 C—N键伸缩振动,730 cm-1的拉曼散射峰为共轭环变形所引起,996 cm-1的拉曼散射峰与苯环取代有关。从图5(a)还可知,DNA-CTMA 在 778,1 094,1 296 cm-1处出现拉曼散射峰。对 DPFP的拉曼光谱与DNA-CTMA的拉曼光谱进行对比可知,在相同激发条件下,DPFP的拉曼光谱整体强度大于DNACTMA拉曼光谱,并且DPFP比DNA-CTMA的拉曼散射峰尖锐。从图5(b)可知,5种薄膜样品的拉曼光谱均存在荧光包络;样品1#与样品2#的拉曼光谱接近,没有明显的拉曼信号;样品3#及样品4#的拉曼光谱出现的特征峰不明显;而样品5#出现较强的拉曼散射峰,拉曼散射峰分别位于726,828,1 013,1 142,1 227,1 301,1 348,1 454,1 484,1 614 cm-1处。将样品 5#的拉曼光谱同DPFP的拉曼光谱及DNA-CTMA的拉曼光谱进行比较可知,样品5#的拉曼光谱中主要拉曼散射峰与DPFP的拉曼光谱中的拉曼散射峰位置一致,说明样品5#的拉曼信号主要由薄膜中的DPFP染料分子产生。
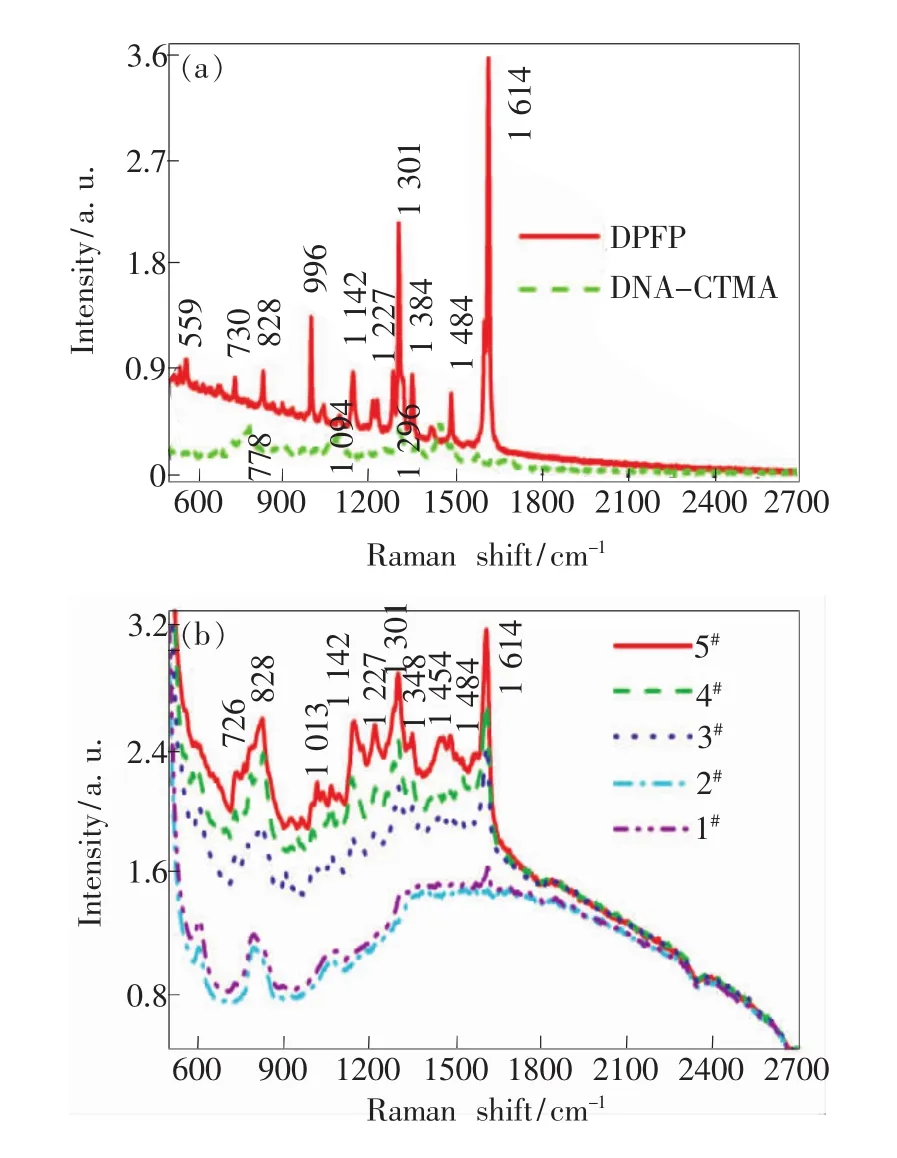
图5 (a)DPFP和DNA-CTMA的拉曼光谱;(b)5种薄膜样品的拉曼光谱。Fig.5 (a)Raman spectra of DPFP,DNA-CTMA.(b)Raman spectra of the five film samples.
同时,分析图5(b)可知,在样品1#的DNACTMA-DPFP体系中,掺杂质量比为2%的DPFP均匀分散在DNA-CTMA中,在785 nm激光作用下,产生微弱的拉曼信号,淹没在荧光光谱中,基本看不到拉曼散射峰信息。在金纳米粒子掺杂DNA-CTMA-DPFP的4个样品中,金纳米粒子均匀分散在薄膜中,在785 nm激光作用下,DPFP分子激发出拉曼散射的同时也激发出荧光,而且随着金纳米粒子掺杂比的增大,DPFP分子的SERS效应与荧光强度得到极大增强。这是由于在较高的金纳米粒子掺杂比情况下,粒子之间的距离减小,粒子间隙处的电磁场超常增强,与金纳米粒子发生作用的DPFP染料分子随之增多,DPFP分子的荧光激发增强,同时较高的金纳米粒子掺杂比使吸附在金纳米粒子表面上的DPFP分子产生显著的化学增强[20],伴随着表面拉曼散射效应,表现出图5(b)中样品3#、4#、5#的增强拉曼光谱。
4 结 论
采用水相还原法和离子交换法及钯催化反应,制备了DNA-CTMA-DPFP材料和金纳米粒子掺杂的DNA-CTMA-DPFP材料的薄膜样品,通过实验测量和分析,对各种薄膜样品的吸收和荧光光学特性及不同金纳米粒子掺杂质量比的薄膜样品的拉曼特性进行了研究。结果表明,在785 nm激光激发下,薄膜样品的拉曼散射主要来自DPFP分子,而且由于金纳米粒子对样品中DPFP分子具有SERS效应,随着薄膜样品中金纳米粒子掺杂比的增加,激发的DPFP分子的拉曼光谱强度逐渐增强。因此,在制备生物光学传感器件方面,具有较大金纳米粒子掺杂比的DNA-CTMA薄膜适合作为多种染料分子表面增强拉曼散射的基底。
[1]Wang L,Yoshida J,Ogata N,et al.Self-assembled supramolecular films derived from marine dexoyribonucleic acid(DNA)-cationic surfactant complexes:large-scale preparation and optical and thermal properties[J].Chem.Mater.,2001,13(4):1273-1281.
[2]Yaney P,Heckman E,Diggs D,et al.Development of chemical sensors using polymer optical waveguide fabricated with DNA[J].SPIE,2005,5724:224-233.
[3]Hagen J A,Li W,Steckla A J,et al.Enhanced emission efficiency in organic light-emitting diodes using deoxyribonucleic acid complex as an electron blocking layer[J].Appl.Phys.Lett.,2006,88(17):171109-1-3.
[4]Stadler P,Oppelt K,Singh T B,et al.Organic field-effect transistors and memory elements using deoxyribonucleic acid(DNA)gate dielectric[J].Organic Electronics,2007,8(6):648-654.
[5]Ding H F,Zhang F Y,Lin H,et al.Amplified spontaneous emission of fluorescent dye-doped DNA-CTMA thin films[J].Chin.J.Lasers(中国激光),2011,38(5):175-180(in Chinese).
[6]Stewart M E,Aanderton C R,Thompson L B,et al.Nanostructured plasmonic sensors[J].Chem.Rev.,2008,108(2):494-521.
[7]Stoerzinger K A,Hasan W,Lin J Y,et al.Screening nanopyramid assemblies to optimize surface enhanced Raman scattering[J].J.Phys.Chem.Lett.,2010,1(7):1046-1050.
[8]Li W Y,Camargo P H C,Lu X M,et al.Dimers of silver nanospheres:Facile synthesis and their use as hot spots for surface-enhanced Raman scattering[J].Nano Lett.,2009,9(1):485-490.
[9]Sherry L J,Chang S H,Schatz G C,et al.Localized surface plasmon resonance spectroscopy of single silver nanocubes[J].Nano Lett.,2005,5(10):2034-2038.
[10]Liu S P,Zhu H F,Chen N,et al.Surface enhanced Raman scattering spectrum analysis of nude mouse serum with Au nanoparticles active substrate[J].Chin.J.Lasers.(中国激光),2012,39(5):137-140(in Chinese).
[11]Huang Q,Xiong S Z,Zhao Y,et al.Nonlinear phenomenon of surface enhanced Raman scattering caused by surface plasmon[J].Acta Phys.Sinica(物理学报),2012,61(15):157801-1-6(in Chinese).
[12]Xi G Q,Chen Y P,Chen G,et al.Surface-enhanced Raman scattering spectroscopic assay of immunohistochemically stained human colon cancer tissue[J].Chin.J.Lasers(中国激光),2011,38(9):85-90(in Chinese).
[13]Xing H,Wang Z,Xu Z,et al.DNA-directed assembly of asymmetric nanoclusters using Janus nanoparticles[J].ACS Nano,2012,6(1):802-809.
[14]Elghanian R,Storhoff J J,Mucic R C,et al.Selective colorimetric detection of polynucleotides based on the distancedependent optical properties of gold nanoparticles[J].Science,1997,277(5329):1078-1081.
[15]Powell R D,Halsey C M R,Hainfeld J F,et al.Combined fluorescent and gold immunoprobes:Reagents and methods for correlative light and electron microscopy[J].Microsc.Res.Technol.,1998,42(1):2-12.
[16]Dubertret B,Calame M,Libachaber A J,et al.Single-mismatch detection using gold-quenched fluorescent oligonucleotides[J].Nat.Biotechnol.,2001,19(4):365-370.
[17]Frens G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nat.Phys.Sci.,1973,241(1):20-22.
[18]Yan C G,Lin H,Zhang F Y,et al.Amplified spontaneous emission of fluorene fluorescent-dye-doped DNA-CTMA thin films[J].High Power Laser and Particle Beams(强激光与粒子束),2012,24(10):2306-2310(in Chinese).
[19]Quillard S,Louarn G,Lefrant S.Vibrational analysis of polyaniline:A comparative study of leucoemeraldine,emeraldine and pernigraniline bases[J].Phys.Rev.B,1994,50(17):12496-12508.
[20]Liu Y C.Evidence of chemical effect on surface-enhanced Raman scattering of polypyrrole films electrodeposited on roughened gold substrates[J].Langmuir,2002,18(1):174-181.

