派伊尔结在肠道黏膜免疫中的作用
齐旺梅 海日汗 内蒙古农业大学兽医学院 010018
肠道相关淋巴组织由细胞因子以及相关淋巴组织(PP)构成,其中PP也是我们惯称的派伊尔结。肠道的免疫反应诱导器官派伊尔结(Peyer.s patches,PP)外表的滤泡连接上皮(FAE)具有一些特定的受体可以结合某些细菌[1]。本次实验主要研究乳酸菌黏附内化于派伊尔结性能从而发挥免疫作用的机制。结果发现派伊尔结是通过细菌的内化吸附能力从而被诱导产生免疫因子发挥免疫作用的。具体内容如下。
1 材料和方法
1.1 材料
FITC(异硫氰酸荧光素)于Am resco采购;OVA(卵清蛋白)于 Hyclone采购;RPM I1640是由GIBCO公司生产的培养基。用于TNF-A,IL-10,IL-12检测的试剂为中国医药上海化学试剂公司产品。实验采用的所有菌株均为本实验室培养。
1.2 方法
(1)培养乳酸菌
将保存在含甘油15%的细菌培养基中的乳酸菌菌株进行活化(使用-70e的琼脂培养基),之后将其进行单株菌落分离培养在37e的液体培养基内17h,进行连续2次的转接,使用4800r/m in的离心速度离心10m in,进行菌株的收集。
(2)荧光标记乳酸菌
把活细菌或处理过的细菌悬浮于100 mg Pm LFITC中 (溶解于PBS,pH7.3),37e暗处作用1 h,PBS洗四次,然后把细菌悬浮于PBS(109CFUPm L)[2]。
(3)制备体外派伊尔结
参照原雪琦、常桂芳等[3,4]的制备进行方法总结:把6周龄健康KM种小鼠用乙醚麻醉,脱颈处死,取出小肠,用预冷的PBS(磷酸缓冲液)清洗内容物,剪下派伊尔结段组织块。
(4)测定乳酸菌内化黏附于派伊尔结
将被荧光素标记的乳酸菌按照菌株的不同放入96孔板的微孔,每个微孔内放入4个派伊尔结组织块(内壁朝上)。于暗处37e的培养基进行1小时的摇床培养。然后使用PBS进行清洗,加入消化液,于70e培养基内17小时,待组织块耗尽,以PBS为空白对照,使用化学发光或荧光分析仪,分别在530nm发射光以及485nm激光波长的光下对荧光值进行检测。内化黏附性为每克派伊尔结相对的荧光数值。
(5)测定细胞因子
按照TNF-A,IL-10,IL-12检测试剂的说明书进行检测。每个样品要重复检测。
(6)小鼠分组处理
实验采用的是6周龄的小鼠(KM种),随机分成6个小组,每组10只。①为空白组:不进行OVA致敏处理,全程使用PBS洗胃。②为致敏空白组:进行OVA致敏处理,全程使用PBS洗胃。③致敏L.rhamnosusGG洗胃组:进行OVA致敏处理,全程使用菌悬溶液洗胃。第④,⑤,⑥三组分别为致敏L.acidophilusFn037 L洗胃组,致敏plantarumFn008 L洗胃组,致敏caseiFn012洗胃组,其操作方法均与第③组相同。在实验3周后,脱臼处死小鼠,看小鼠粪便形状,水样球状粪便就成功。
(7)测定小鼠腹腔巨噬cell的吞噬活性
在实验3周后,脱臼处死小鼠,使用PBS溶液取其腹腔渗出液,经过与荧光标记以及培养基的培养后,在530nm发射光以及485nm激光波长的光下,检测荧光值。
(8)测定小鼠粪便中sIgA
实验3周后,对每只小鼠进行粪便的新鲜收集并给予称重,使用PBS稀释后于温室培养半个小时,混合离心,按照测定试剂说明书测定小鼠粪便中的sIgA。
(9)统计学方法
所有实验数据均采用统计学软件SPSS19.0进行计算处理,并使用方差检验。
2 结果
2.1 乳酸菌对派伊尔结的黏附性以及诱导细胞因子的数量比较
L.caseiFn012,L.plantarum Fn008,L.philusFn 037,L.rhamnosusGG对派伊尔结的内化能力依次增强,但对派伊尔结诱导产生IL-12,TNF-A和IL-10的能力相当。
2.2 对腹腔巨噬cell吞噬活性的影响
从结果来看,第②组小鼠腹腔巨噬cell吞噬活性显著增强,p<0.05具有统计学意义,第③组进一步显著上升,p<0.05具有统计学意义,其它菌株组除了第⑥组与空白组相比较也均有提升,且差异明显,p<0.05具有统计学意义,而第⑥组与空白组无明显差异(p>0.05)。 具体见表 1。

表1 各组对腹腔巨噬cell吞噬活性的影响比较
2.3 测定小鼠粪便中sIgA致敏可抑制小鼠对sIgA的分泌,乳酸菌则可增强小鼠对sIgA的分泌,第③,④,⑤三组均可削弱由于致敏导致的sIgA分泌下降情况,且效果显著,p<0.05(具有统计学意义)。第⑥组菌株无明显作用,p>0.05(不具有统计学意义)。详细见表2。
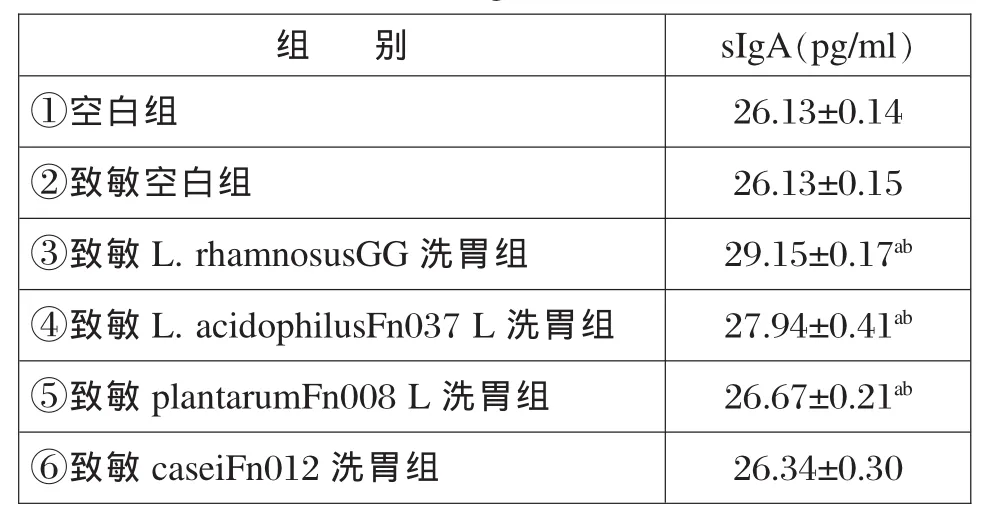
表2 各组对小鼠分泌sIgA的影响比较
3 结论
笔者通过此次研究得出,派伊尔结是通过细菌菌株的内化黏附,被诱导产生免疫细胞因子从而发挥其在肠道黏膜免疫中的作用,并且免疫因子分泌的多少与细菌菌株的内化黏附能力成正比。这可为以后工作中对免疫调节性乳酸杆菌以及活菌疫苗载体的筛选提供科学依据。
[1]Brayden DJ,Baird AW.Apical membrane receptors on intes-tinal M cells:potential targets for vaccine delivery [J].AdvDrug Deliv Rev,2004,56(6):721-726.
[2] Vinderola CG,Medici M,Perdigon G.Relationship betweeninteraction sites in the gut,hydrophobicity, mucosal immuno -modulating capacities and cell wall protein profiles in indigenous and exogenous bacteria[J].J Appl M icrobiol,2004,96(2):230-243.
[3]原雪琦,孙进,常桂芳,乐国伟,施用晖.10株乳酸菌黏附小鼠派伊尔结及免疫调节作用研究[J].中国微生态学杂志,2009,21(7):577-580.
[4]常桂芳,施用晖,乐国锋,孙进,徐子伟,原雪琪,胡晓丽.乳酸菌内化小鼠小肠派伊尔结特性及其影响因素[J].科技导报,2008,26(23):65-69.

