电感耦合等离子发射光谱法同时测定连云港产草莓中的铅铬镉铜
曾艳霞,李树安,孙 凡,张 帆,陈 丽,沙 鸥
(1.江苏省海洋资源开发研究院,江苏 连云港 524025;2.淮海工学院化学工程学院,江苏 连云港 524025)
草莓(Fragaia ananassa Duchesne),又名洋莓、地果、士多啤梨等,为蔷薇科(Rosaceae),草莓属(Fragaria),属浆果类果树。草莓具有丰富的营养价值和疗效,据测定草莓鲜果中含氨基酸0.4%~0.6%、糖5%~12%、有机酸1%~1.5%,每100g果肉含VB1、VB2各0.02mg、胡萝卜素0.01mg、VC达60mg以上,富含人体必需的钙、磷、铁等矿物元素,享有“水果皇后”的美称。目前对草莓的研究很多,但主要集中在种植喷施微肥及微肥对营养元素含量的增加效应方向的研究[1-4]。在连云港地区,每年4~6月、7~8月、9~10月是草莓根系的3次生长高峰,在草莓体内的微量元素,主要来源于土壤。关于连云港地区草莓生长期中微量重金属元素的状况至今未见报道,本研究目的是获得采集时间为4~6月份的本地产草莓中的微量金属元素。本实验以近年连云港本地大棚养殖的5个草莓品种为试材,采用全谱直读等离子体发射光谱仪(inductively coupled plasma atomic emission spectrometry,ICP-AES)法测定其铅、铬、镉、铜微量含量,以期了解连云港草莓果品微量重金属安全状况,并为其营养功能的进一步开发研究提供参考依据[5]。
1 材料与方法
1.1 材料与试剂
草莓购于连云港东海县黄川草莓种植基地,共5个品种,见表1。

表 1 供试草莓品种Table 1 The strawberry cultivars used in the experiment
标准储备液(20mg/L):22种元素混标GBW(E)060671为国家标准溶液(NCS)。高氯酸、浓硝酸(均为优级纯) 国药集团化学试剂有限公司;水为实验室自制的超纯水(Millore-Q装置处理)。
1.2 仪器与设备
iCAP 6300型全谱直读电感耦合等离子体原子发射光谱仪 美国Thermo Fisher公司。BS323S型万分之一分析天平 美国Sartorius公司;Multiwave 3000型微波消解仪 奥地利Anton Paar公司;TXBS9型马弗炉 北京皮尔美特科技有限公司;GG59-EH35B型电加热板 北京中西远大科技有限公司。
1.3 样品处理及上机
1.3.1 样品取样
按等距抽样法选择种植基地内的草莓植株抽样,选择成熟未损伤的草莓果,进一步制样后,经匀浆机混合均匀后取样。
1.3.2 样品预处理
样品用超纯水洗净,切成小块绞碎均匀,于105℃的恒温烘箱中烘干至质量恒定,研钵成粉末干品备用。
1.3.3 干法消解

表 2 马弗炉仪器工作条件Table 2 Operational parameters of Muffle furnace
平行称取3份草莓样品,移入马弗炉中,按设置条件(表2),炭化至无烟并升温灰化,若个别试样灰化不彻底,则可在样品冷却后滴加数滴硝酸,重新置入马弗炉中灰化,直至样品变成灰白色为止,放冷。用少量(1+20)稀硝酸将灰分洗入100mL三角瓶中,加2mL硝酸-高氯酸混合酸溶液(9:1,V/V)于电热板上消解至冒白烟,取下放冷,补加少量硝酸(1:1,V/V),用少量水冲洗瓶壁,置于电加热板上微热溶解样品,放冷过滤,滤液移至比色管中定容至25.00mL。同时制作分析空白。
1.3.4 湿法消解
聚四氟乙烯烧杯稀酸浸泡超纯水清洗烘干备用。平行称取3份草莓样品,加入硝酸-高氯酸混合酸溶液(9:1,V/V)静置过夜预消解,翌日置于电加热板上160℃消解,至溶液由黄色变成深黑色,补加少许硝酸至溶液黄色清亮透明,溶液剩余2~3mL为消化完全。消化液转入比色管,定容至50.00mL。同时制作分析空白。
1.3.5 微波消解
准确称取干品0.2000g,加入浓硝酸6mL,盖好内管盖过夜进行预消化,翌日于消解罐中根据设定程序进行消解,消解完成后赶酸1h,1% HNO3溶液定容到50.00mL。平行消化3份样品,同时制备分析空白液。消解程序见表3。
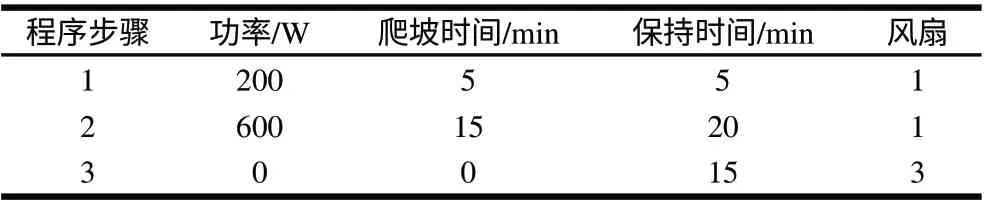
表 3 微波消解程序Table 3 Digestion programs by microwave
1.3.6 上机测样
消解后的样品溶液按ICP-AES的仪器设置参数依次上机测样(表4)。

表 4 光谱仪器工作参数Table 4 Operational parameters of the spectroscope
2 结果与分析
2.1 谱线选择
ICP-AES对每个元素测定可以选择多条特征谱线,并具有同步自动背景校正功能。本实验选择2~3条谱线,根据干扰少、精密度好、信噪比高、信号强度高的原则确定最适合谱线,选择的谱线波长及级次如下:Cd 214.438{457};Cr 267.716{126};Cu 327.396{103};Pb 220.353{453}。
2.2 方法检出限
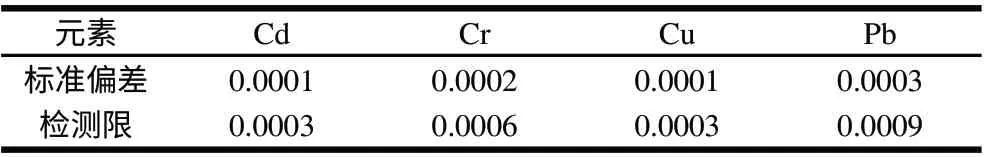
表 5 方法检测限(n=11)Table 5 The limit of detection of the method (n=11) mg/kg
空白测定11次,确定方法检出限,以3倍信噪比(RSN=3)确定方法检测限(表5)。
2.3 稳定性实验
以湿法消解的样品处理溶液为例,以1个样品溶液上机测定,以甜宝样品为例,取制备好的样品溶液分别在0、2、4、8、16、24h进行测定元素含量,结果如表6。发现6次测定结果的RSD值分别为0.32%~3.91%。表明该方法的稳定性较好。

表 6 稳定性实验结果Table 6 Results of stability test
2.4 标准曲线与线性方程
以混标使用液为母液,1% HNO3溶液配制0.01、0.05、0.1、0.2、1mg/kg工作液。并以1% HNO3为标准空白。按表1的仪器工作条件分别测定各元素标准系列工作液的曝光值。以质量浓度C/(mg/L)为横坐标,曝光值A(Cts/s)为纵坐标绘制标准工作曲线,得出回归方程和相关系数,见表7。

表 7 测定重金属含量工作曲线Table 7 Standard curves of heavy metals
由表7可知,各元素标准工作曲线相关系数分别均为0.999以上,说明工作曲线的线性关系较好,该测定方法符合0.998以上的精度要求。
2.5 加标回收实验

表 8 重金属含量加标回收实验Table 8 Recovery tests of heavy metals
以微波消解为例,以0.1mg/kg混标为加标液,准确量取待测液5.00mL于50.00mL比色管中,加入5.00mL加标液,充分混匀后上机测定。测定结果见表8。
由表8可知,实验所测回收率在85.3%~106.3%之间,符合GB/T 23942—2009《化学试剂:电感耦合等离子体原子发射光谱法通则》要求,表明本法准确度高。
2.6 样品测定结果及精密度
干法、湿法及微波消解处理样品后,同时测定5种品种中4种微量元素,测定结果见表9。

表 9 微量元素含量测定结果(n=3)Table 9 Determination of trace heavy metals in strawberry samples (n=3)
从表9可以看出,除个别值(*)外,各元素测定值的相对标准偏差(RSD)均小于20.0%,表明结果精密度好。
3 讨论与结论
食品的重金属污染是食品监测最重要的方面之一[7]。建立快速测定草莓中铜、铅、镉、铬的方法,对于水果的重金属安全检测及分析具有重要意义[8]。国内外规定的食品质量已经降低了食物中有毒金属的最大允许程度,这是由于造成食物链污染的这些金属剂量的危险性在加强[9]。
食品中铬通常用原子吸收火焰法测定,但铬需要的激发温度高,而原子吸收的原子温度低,导致原子化不完全,使得结果偏低。而ICP由于激发温度高,是测定铬、钡等高温元素的好方法。ICP-AES的优势在于可以同时测定多种元素[10-12]。本实验采用ICP检测了微量铬含量,选择的谱线波长及级次为Cr 267.716{126},测定结果准确可靠,精密度好。
采用干法、湿法及微波消解处理样品后,ICP上机测定发现,3种处理样品的方法均能够同时准确测定样品中微量重金属——铜、铅、镉、铬的含量,但本实验不进行3种处理方法显著性差异的比较。干法灰化具有快速简单的特点,但易造成挥发元素的损失,不适用挥发元素如砷、汞的检测[13]。湿法消解需要消耗酸试剂,易带来轻微的环境酸污染。微波消解与湿法消解法相比,具有快速、试剂用量少、空白值低、对易挥发物质回收率高,环保,对环境污染小的优点,其用酸少,消解速度快,可减少易挥发元素的损失,非常适用该样品的前处理[14-15]。样品前处理实验中发现,HNO3-H2O2的消解体系[12]与纯硝酸体系都能够消解完全样品至澄清液,为避免引入更多的杂质,本实验最终选择只加硝酸消化。最终测试结果表明,5种草莓样品的微量重金属含量——铜、铅、镉、铬均在食品污染物限量值以内,提示连云港地区4~6月份采集草莓的食用安全。本实验可为同时快速检测其他水果中微量元素含量提供思路。
[1] 张海英, 韩涛, 田磊, 等. 草莓叶面施硒对其重金属镉和铅积累的影响[J]. 园艺学报, 2011, 38(3): 409-416.
[2] 王凤文. 微量元素Ca、Zn、Fe对草莓产量与品质的影响[J]. 白城师范学院学报, 2009, 23(3): 66-70.
[3] 陈丽璇, 汤惠华, 陈丽虹, 等. 外源钙与草莓叶果营养元素含量的相关性[J]. 热带作物学报, 2008, 29(6): 720-724.
[4] 李青云, 陶秀娟, 黄瑞虹, 等. 不同栽培基质对草莓植株营养生长的影响[J]. 农业工程技术: 温室园艺, 2007(6): 122-128.
[5] 曾宪津, 李秋堂, 刘春兰, 等. 生物样品中的微波-消解电感耦合等离子体原子发射光谱多元素同时分析[J]. 分析化学, 1991, 19(5): 605-608.
[6] GB 2762—2005 食品中污染物限量[S].
[7] KHAN S, CAO Q, ZHENG Y M, HUANG Y Z, et al. Health risks of heavy metals in contaminated soils and food crops irrigated with wastewater in Beijing, China[J]. Environmental Pollution, 2008, 152(3): 686-692.
[8] SNEŽANA S, MITIĆ MIRJANA V, OBRADOVIĆ MILAN N, et al. Elemental composition of various sour cherry and table grape cultivars using inductively coupled plasma atomic emission spectrometry method (ICP-AES)[J]. Food Analytical Methods, 2012, 5(2): 279-286.
[9] YAN Qing-hua, YANG li, WANG Qing, et al. Determination of major and trace elements in six herbal drugs for relieving heat and toxic by ICP-AES with microwave digestion[J]. Journal of Saudi Chemical Society, 2012, 16(3): 287-290.
[10] 阳文琼, 邓振平. 微波消解-ICP-AES法测定代用茶桂花产品中的铁锌铜锰[J]. 食品科学, 2009, 30(10): 228-230.
[11] 丛俏, 蔡艳荣. 微波消解-ICP-AES 法测定蔬菜中重金属含量[J]. 食品科学, 2010, 31(20): 290-292.
[12] 陈美芬, 熊贤友, 万益群. 电感耦合等离子体原子发射光谱法同时测定江西脐橙中多种微量元素[J]. 食品科学, 2008, 29(11): 559-561.
[13] SAHAYAM A C, CHAURASIA S C, VENKATESWARLU G. Dry ashing of organic rich matrices with palladium for the determination of arsenic using inductively coupled plasma-mass spectrometry[J]. Analytica Chimica Acta, 2010, 661(1): 17-19.
[14] BAKIRCIOGLU D, BAKIRCIOGLU KURTULUS Y, UCAR G. Determination of some traces metal levels in cheese samples packaged in plastic and tin containers by ICP-OES after dry, wet and microwave digestion[J]. Food and Chemical Toxicology, 2011, 49(1): 202-207.
[15] CINDRIĆ I J, ZEINER M, KRPETIĆ M, et al. ICP-AES determination of minor and major elements in Cornelian cherry (Cornus mas L.) after microwave assisted digestion[J]. Microchemical Journal, 2012, 105: 72-76.

