脱酰胺改性蛋白和肽的研究进展
廖 兰,赵谋明*,汪少芸,黎清金
(1.福州大学生物科学与工程学院,福建 福州 350108;2.华南理工大学轻工与食品学院,广东 广州 510640)
脱酰胺反应是一种蛋白或肽分子修饰改性重要的手段。脱酰胺顾名思义为蛋白侧链酰胺的基团脱去转变为羧基的反应。自然界中大多数食物蛋白富含酰胺基团。该反应可快速改变蛋白电子分布状态,伸展食物蛋白分子空间结构,使食物蛋白获得良好的功能特性,拓宽其应用范围[1]。Matsudomi[2]、Hamada[3]等指出食物蛋白仅2%~6%的脱酰胺改性程度能显著地提高食物蛋白的功能特性。人体蛋白质和肽也发生着脱酰胺反应,且呈现周期性。该脱酰胺反应导致了人体蛋白和肽异构化,引发人体蛋白和肽的反转、延展和老化等,对人体衰老和免疫有重要影响[4-5],是导致人体亚健康、诱发各种医学难症的重要原因,如:阿尔茨海默病(Alzheimer’s disease)发病的神经原纤维团特征与大脑T-蛋白发生脱酰胺反应紧密有关;人体血清蛋白脱酰胺将改变了其抗原属性,导致自抗原效应。

图 1 蛋白酰胺基团直接水解机制Fig.1 Direct hydrolysis of the amides from proteins and peptides
科学家们研究发现蛋白或肽的酰胺基团脱去酰胺以两种机制进行[6]:l)直接水解反应机制(图1);2)β-转变机制(β-shift mechanism)(图2)。一般情况下,在pH<5的条件下,蛋白质或肽直接水解脱去酰胺基团,在较高的pH值条件下(pH>5)则发生β-转变机制。直接水解反应机制较易理解,即酰胺基团在H+或OH-或酶催化下,以水为反应介质,酰胺键断裂,形成羧基。因此,酰胺基团需先从蛋白质或肽聚集结构内暴露,转变成脱酰胺催化剂有效作用反应位点,并与水与H+接触,脱酰胺反应才可启动。
β-转变机制(图2)较复杂,除了酰胺基团首先需暴露,该反应生成了一种含有五或六元碳的酰胺中间体(琥珀酸亚胺中间物),该特殊中间体极不稳定,当释放氨后,立即水解生成“异头肽”(isoPeptide)[7](isoAsp–Xaa和isoAsp–Xaa混合体)。Aswad等[7]研究指出isoAsp异头肽的形成会显著降低蛋白的生物活性,使蛋白水解敏感性和自免疫力降低。通常,人体生理环境中性偏碱,人体生物蛋白或肽的脱酰胺反应以β-转变机制为主。

图 2 β-转变脱酰胺机制Fig.2 β-Shift mechanism of the amides from proteins and peptides
不管以何种机制进行脱酰胺反应,蛋白质或肽的酰胺基团暴露途径、暴露程度、催化剂作用位点的特点和作用效果、蛋白或肽聚集态和结构特征如何影响脱酰胺是本领域研究的关键点。一直以来,由于蛋白或肽本身体系组成复杂和结构多样,导致蛋白或肽脱酰胺的构效关系研究成为难点。本文通过综述以往文献关于各类脱酰胺改性蛋白和肽的报道及其原始蛋白或肽结构特征和改性过程中聚集态特征,在某种程度上对蛋白和肽的结构特征与其脱酰胺能力的关系进行归纳,并在此基础上提炼出对未来发展方向的预测。
1 脱酰胺改性蛋白和肽的方法研究进展
目前,脱酰胺改性蛋白常用的方法分为非酶法、酶法、混合脱酰胺3种。Zhang等[8]研究发现在无水的环境下也有脱酰胺的作用,且脱酰胺速率随反应时间延长而提高。在食品生产加工或者人体胃消化环境中,蛋白或肽常处于的偏酸条件环境,酶脱酰胺和非酶酸脱酰胺改性蛋白和肽的研究因而较多。非酶碱性脱酰胺会破坏Cys,形成赖氨酸丙氨酸,毒理研究表明赖氨酸丙氨酸对小鼠肾有毒害作用,导致蛋白营养价的下降。
1.1 酶法脱酰胺
酶法脱酰胺改性食品蛋白和肽已引起了众多学者的兴趣。如表1所示,目前用于脱酰胺改性食品蛋白的各种酶系及改性效果的研究[2-3,9-16]可知:具有脱酰胺作用酶系较丰富,效果明显。其中从微生物中提取分离纯化出肽谷酰胺酶(PGase)脱酰胺改性蛋白效果显著[3]。科学家研究认为PGase脱酰胺改性蛋白最实际、可行,但前提条件是蛋白质需先被其他蛋白酶或其他方法预处理才是最适底物,因为蛋白质分子的大小和构象显著地影响该酶的催化活性。酶法脱酰胺也可显著提高蛋白水解物的风味特性[16],Schlichtherle-Cerny等[16]分离纯化得到4个鲜味肽:Gln-Pro-Ser、Glu-Pro、Glu-Pro-Glu、Glu-Pro-Gln都是N端谷氨酰胺残基在脱酰胺过程中环化而形成。此外,从表1可知,碱性和低温是酶法脱酰胺改性蛋白常使用的条件,说明是酶法脱酰胺是改性食物蛋白制备良好功能特性的安全、高效方法之一,但同样,其缺点在于:底物需经一定的物理、化学或生物手段改性,使蛋白或肽的构象伸展,即酰胺基团需先充分暴露,改造成脱酰胺酶系有效作用反应位点,其脱酰胺作用才能有效被启动。相对而言,非酶脱酰胺更加直接高效。
1.2 非酶法脱酰胺
温度是影响蛋白和肽脱酰胺速率的重要条件之一,湿热成为非酶酸脱酰胺改性食物蛋白的必要条件。较高的温度提高了反应体系离子和分子的动能和内能,有利于增大催化剂与酰胺基团接触的几率,进而加快脱酰胺反应进程。盐离子和控制温度、湿度和pH值的双螺杆挤压法也会产生较好脱酰胺效果[8,17-21]。改性后蛋白电点随脱酰胺程度的增加,向低pH值移动,功能性质(乳化性能以及起泡性)均有不同程度的改善(表2)。

表1 脱酰胺改性蛋白或肽的酶系Table 1 Working enzymes for deamidation of proteins and peptides
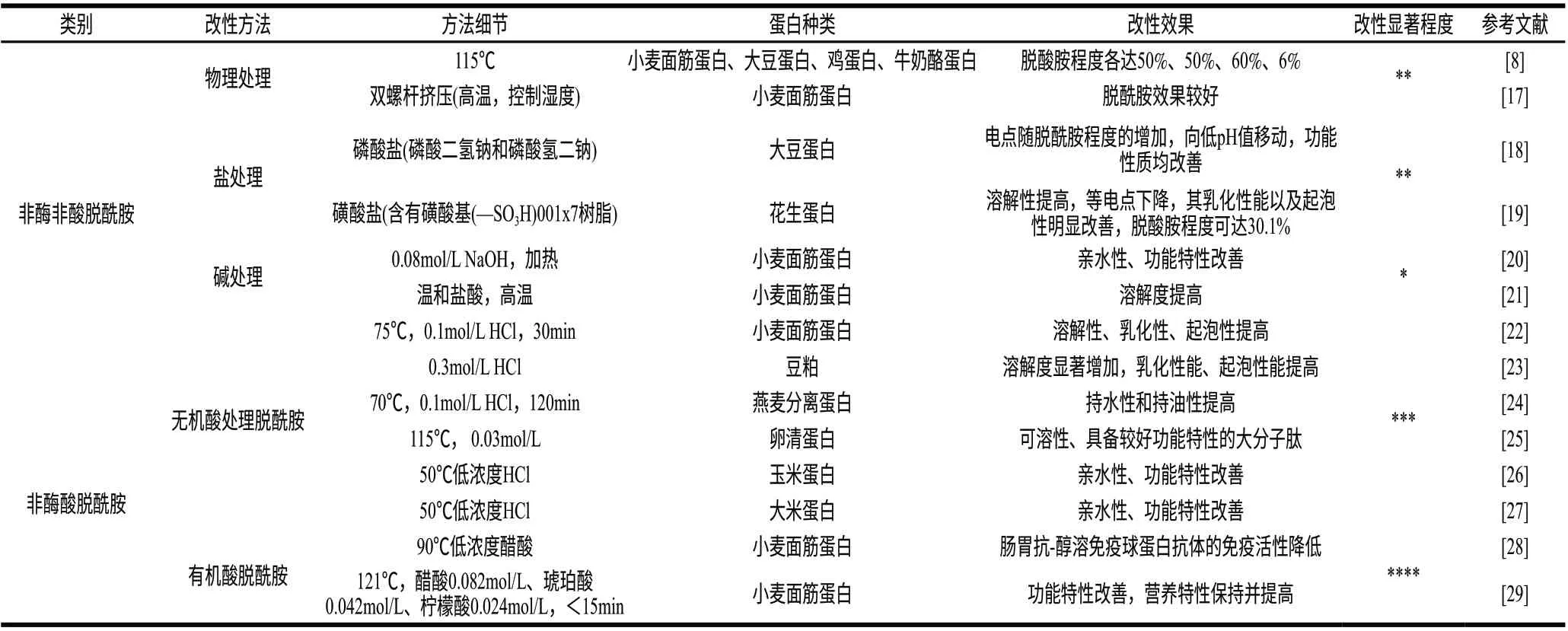
表2 非酶法脱酰胺改性蛋白或肽Table 2 Unenzymatic deamidation of proteins and peptides
酸是最常使用脱酰胺改性蛋白的催化剂。理论上,任何能电离出氢离子的酸都可作为蛋白或肽脱酰胺的催化试剂。湿热酸脱酰胺具有的优点是:1)改性蛋白质的脱酰胺度较高,改性蛋白的溶解度明显增加,其他性质例如乳化性和起泡性也显著提高;2)有利于增加必需氨基酸(如赖氨酸)的消化和吸收量。由于食物蛋白反应体系要求特别,国内外学者常采用低浓度盐酸应用于脱酰胺改性蛋白反应,但不管高还是低浓度盐酸都有如下明显的缺点:1)高温条件下高浓度盐酸水解脱酰胺蛋白,将产生致癌物氯丙醇,导致食品安全问题;2)高温低浓度盐酸催化蛋白脱酰胺,由于作用温度高,其肽键水解难控制,蛋白质易部分变性,引起一些氨基酸(如色氨酸、丝氨酸、苏氨酸以及含硫氨基酸)的异构化以及破坏。近年来,几种常用可食性有机弱酸开始作为脱酰胺催化试剂用于脱酰胺改性食物蛋白,特别是谷物蛋白,并取得了有益的研究成果(表2)[28-29]。值得提出的是,Berti等[28]研究指出高温湿热醋酸脱酰胺导致肠胃抗-醇溶免疫球蛋白抗体的免疫活性降低,TG酶法脱酰胺导致肠胃抗-醇溶免疫球蛋白抗体的免疫活性提高。并且,本课题组也研究指出有机弱酸在湿热条件下具有同强酸同等脱酰胺能力,且对肽键水解作用微弱,能更专一作用于蛋白侧链酰胺基团进行脱酰胺改性,可有效地伸展了小麦面筋蛋白的二级、三级结构,显著改善小麦面筋蛋白的功能特性,保持并提高了小麦面筋蛋白营养特性[29]。以上研究结果表明,高温湿热有机酸脱酰胺是一种既能提高小麦面筋蛋白功能特性,又能降低肠胃病人对小麦面筋不耐受症,是谷物蛋白脱敏的有效方法。
2 蛋白质或肽的原始结构对蛋白脱酰胺反应的影响
蛋白质或肽的结构特性是影响其脱酰胺处理和改性程度的重要因素。Robinson等[4]和Wright[10]两课题组提出了脱酰胺半衰期和分子钟假说,先后围绕着人工合成的肽和酰胺基侧链等较明确的蛋白立体化学,从蛋白或肽的主链、4种二级和三级结构入手,研究Asn或Gln发生脱酰胺速率的关联性和影响,阐述了各种环境条件下的不同蛋白中的酰胺基团断裂或周围肽键断裂的机制。
2.1 蛋白质或肽的主链(一级结构)对蛋白脱酰胺反应的影响
目前,主链对蛋白或肽脱酰胺反应的研究,是通过基因控制改变氨基酸序列,来调整蛋白脱酰胺速率。脱酰胺反应机制的经典理论认为,Asn残基脱酰胺速率高于Gln残基。有研究也发现,在Asn任何一侧的肽键断裂的速率是其他肽键断裂断裂速率的100倍以上[30],原因是邻近的主链上—NH基团到Gln侧链酰胺基团的距离大于到Asn侧链酰胺基团的距离。可以从脱酰胺的两种机制来解释:1)在直接水解机制中,—NH基团作为氢键的质子提供者稳定肽中Asn含氧阴离子的过渡态中间产物,但是只能对Gln的过渡态中间产物有非常弱的作用。第二个谷氨酰胺侧链基团的其他甲基因空间位阻作用使得-NH-基团到过渡态产物中负电氧距离较远,因而而不能形成较强作用的氢键。2)在β-转变机制中,当Asn左右紧邻氨基酸是Gly,此Asn发生脱酰胺速率远高于当Gln左右紧邻氨基酸是Gly的蛋白序列[31]。Geiger等[32]人工合成了六肽L-Val-L-Tyr-L-Pro-L-Asn-L-Gly-L-Ala,通过模拟改变蛋白结构和功能特性的自然处理条件,研究天冬氨酰胺脱酰胺和异构化反应。实验发现37℃、pH7.4条件下,该肽发生了快速的脱酰胺反应(半衰期只有1.4d),生成的了天门氨琥珀酸亚胺产物,并且在该条件下,生成的天门氨琥珀酸亚胺继续发生水解反应(半衰期2.3h)和异构化(半衰期19.5h),生成由L-和D-天门氨酰和β-异头天冬胺酰六肽组成的网络状混合物。他们也发现,当用天冬氨酸替代天冬氨酰胺残基,该六肽生成琥珀酸亚胺的速率下降34倍,伴随着非常明显的消旋,以及六肽的脱酰胺和异构化。并且,通过计算琥珀酸亚胺中间产物快速的异构化趋势,预测蛋白消旋后的产物,并指出:如果用较大空间结构的Leu或Pro残基替代了含有Asn的六肽中Gly残基,脱酰胺速率将降低33~55倍。该研究表明,天冬氨酰胺和天冬氨酸可能是蛋白非酶脱酰胺的热点,特别是在红细胞和眼球晶体细胞中,他们都各自有120d和80d的生命半衰期。蛋白脱酰胺过程中,肽键也会断裂,特别是在β-转变机制中,研究人员发现,Asn残基发生脱酰胺反应的同时,立刻发生肽键断裂[33-34]。Geiger等[32]在构建的肽模型中也发现了有限肽键断裂的现象。在此反应中Asn的侧链—NH2基团是亲核物,进攻其自身主链的蛋白羰基,替代Asn羰基一侧基团,使其成为不稳定的Asn。
但是近半世纪以来,科学家们所得的相关人体生物活性蛋白经典脱酰胺机制,主要是关于天冬氨酰胺在生理环境条件下的反应机制[6],而谷氨酰胺因其在人体生理环境下脱酰胺速率显著小于天冬氨酰胺[31],并且因在脱酰胺反应位点显著损伤,被学者关注较少。Asn残基的脱酰胺速率(包括直接水解机制和琥珀酸亚胺中间产物机制)主要受(n+1)的羰基侧链控制,较小受(n-1)氨基酸侧链的作用的影响[35]。然而,(n+1)的羰基侧链残基的大小或者电荷和脱酰胺的速率之间的相关性并不清楚。也有研究表明,Asn-Gly或Asn-Ser是脱酰胺最敏感的氨基酸序列[35-36]。对于β-转变机制,常规的研究思维是:首先,根据静电感应与作用和蛋白序列,得到(n+1)骨架的氮实际酸度;然后,为合理调试3D蛋白侧链或主链,对其结构重排、设计开、闭脱酰胺中间四、五元环,计算Asn残基附件有效的构象和空间位阻,以控制环合中间琥珀酸亚胺产物的形成。最后,计算水或者质子对Asn的接近程度,以分解循环四面体中间产物[35]。通过细致的研究,已发现人体生理溶液环境里的Asn残基的脱酰胺速率在很大程度上是受它们所存在的化学环境影响[36]。由此,Robinson等[4]研究了一种方法可定量估算人体蛋白天冬氨酰胺残基脱酰胺不稳定性,通过观察不同五肽中每一个Asn残基在蛋白三维立体环境中的几方面特征,并通过计算所得的观察值、主链氨基酸序列以及根据前面已形成的整套根据氨基酸序列决定Asn五肽脱酰胺速率的相关理论。在评估了的31种不稳定和167种稳定的Asn残基,以及在61种人体血红蛋白中报道的7种不稳定的和63种稳定的Asn残基后,他们认为主链结构和三维立体结构式影响Asn脱酰胺速率的相对重要性,并得到了以下重要规律:1)Asn和Gln前如果有极性的基团促进脱酰胺速率;2)Asn和Gln附近是Ser和Thr促进脱酰胺速率,它们能够提供质子使Asn远离或者稳定在过渡状态;3)Asn和Gln前如果有庞大的疏水性基团抑制脱酰胺;4)Asn前是Gly会延长Asn的脱酰胺半衰期到1.4d[35];5)中性条件下Asp、Glu和His侧链是亲核物,能够主动进攻酰胺键,可以作为碱性活泼亲核试剂激活酰胺键;6)Lys和Arg紧邻Asn和Gln可稳定脱酰胺过程中形成的含氧阴离子中间产物[37]。
2.2 蛋白质或肽的二级结构对蛋白脱酰胺反应的影响
Asn、Asp、Gln和Glu对不同的二级结构显示出不同的脱酰胺能力。虽然Asn、Asp、Gln和Glu在α-螺旋都可以形成,但Asp和Glu更易在α螺旋片段中形成[37-38]。在一个螺旋开端的蛋白肽链,Asn在大量的螺旋蛋白质二级构象中比在其他氨基酸构象中具有更显著更高的脱酰胺速率[39]。研究发现,Asn和Gln常存在于蛋白的表面[39],这样的蛋白结构特征非常有利于发生脱酰胺反应。天冬氨酰胺的脱酰胺反应中,α螺旋和β折叠都趋于稳定脱酰胺中的天冬氨酰胺残基。
2.3 蛋白质或肽的三级结构对蛋白脱酰胺反应的影响
蛋白质或肽脱酰胺速率易受其一级、二级结构影响,但Asn和Gln残基脱酰胺速率更易受到蛋白三级结构的变化的影响,特别是某些三级构象使Asn和Gln充分暴露促进了脱酰胺反应。Kossiakoff等[40]认为蛋白的三级结构是影响酰胺侧链脱酰胺敏感性的主要原因。他利用中子散射特性研究胰岛素酰胺基团(该蛋白中含有的天冬氨酰胺的多肽链,其附近的片段的氨基酸序列和构象具有显著的多样性)和脱酰胺过程中中子晶体结构,研究得出13个天冬氨酰胺残基中的3个被改性,发生了脱酰胺反应,并且发现改性后的残基和其他未改性的天冬氨酰胺残基具有非常不同的局部构象和氢键结构,因此他指出胰岛素脱酰胺的偏好性和侧链基团脱酰胺位点之间没有关联性。
3 脱酰胺改性蛋白和肽的结构和聚集态的变化
脱酰胺改性过程中,蛋白一边伸展也一边发生一定程度交联。蛋白分子聚集将改变蛋白分子质量、结构和分子柔性。特别是食物蛋白的功能特性与食物蛋白分子大小和结构特征紧密相关,分子质量合适且分子柔性好的食物蛋白的乳化稳定性和起泡稳定性更好[41]。因此,适度地伸展蛋白且保持一定聚集态(分子柔性、分子质量和分子构象),更利于提高蛋白功能特性。有趣的是,与结构化学家(2.3节)认为三级结构更易影响蛋白或肽的脱酰胺速率的结论相悖,部分学者研究表明脱酰胺改性并不影响蛋白二硫键(表3),进而不影响三级结构,但影响蛋白二级结构、热特性和分子质量分布(表3)。也有研究报道[42]脱酰胺改性后,改性蛋白在常温条件下存放也发生聚集现象。

表3 脱酰胺改性蛋白或肽结构和聚集态的研究Table 3 Conformation and aggregative behavior of proteins and peptides by deamidation
热作用是蛋白脱酰胺过程中发生聚集三级结构改变的主要诱因[17,24,29]。Matsudomi等[43]详细地研究了盐酸脱酰胺改性卵清蛋白过程中的卵清蛋白聚集机制,提出在热处理过程中,卵清蛋白首先通过疏水交互反应相互接近,再缓慢形成二硫键而形成可溶性聚集体,而在常温空气存放中,疏水键和二硫键使脱酰胺改性后的卵清蛋白发生聚集。并提出了一个简单的反应模型表述卵清蛋白在盐酸湿热脱酰胺过程中蛋白分子的聚集行为。该反应模型强调了卵清蛋白分子是通过分子内二硫键和非共价键相互作用形成的分子网络结构,达到一边脱酰胺一边展开分子构象而提高蛋白功能特性的目的。在Matsudomi等[43]提出的分子模型基础上,本课题组针对有机酸脱酰胺改性小麦面筋蛋白分子的聚集行为提出了全新聚集态变化模型,认为小麦面筋蛋白在改性过程中,酸脱酰胺产生的分子静电斥力和热效应产生的聚集力相互博弈,麦谷蛋白与醇溶蛋白经历了聚集、解离同时进行的过程[45]。但与表3李红梅[26]、Chiu[41]等不同的是,有机酸湿热处理脱酰胺会导致了小麦面筋蛋白发生聚集,分子内氢键和二硫键将发生重排,并认为蛋白不断增大静电斥力可能是导致蛋白聚集体粒径、构象突变的主要原因[44]。
4 结 语
综上所述,对于人体蛋白和肽,脱酰胺反应对蛋白反转和细胞老化至关重要;而食物蛋白,不管是非酶脱酰胺还是酶脱酰胺,脱酰胺可高效地改性食物蛋白,得到特征功能特性改善的功能性蛋白。特别是本文综述的脱酰胺改性条件,比如高温和低pH值,在食品和农产品加工中普遍使用,因此食物蛋白在食品和农产品加工中发生脱酰胺反应不可避免。从本质上,了解蛋白或肽酰胺基团暴露途径、暴露程度、催化剂作用位点的特点和作用效果、以及脱酰胺脱酰胺对蛋白结构和功能的决定条件和影响,对于深入研究蛋白或肽中酰胺基团的反应行为、进而寻找安全高效的脱酰胺改性食物蛋白和肽方法尤为重要。对于人体蛋白和肽,人工合成蛋白和肽应用于以在各种生物体系,进一步研究其作用机制和控制方法,将是未来该领域的发展趋势。
[1] MATSUDOMI N, KATO A, KOBAYASHI K. Conformation and surface properties of deamidated gluten[J]. Agricultural Biology and Chemistry, 1987, 46(6): 1583-1586.
[2] MATSUDOMI N, TANAKA A, KATO A, et al. Functional properties of deamidated gluten obtained by treating with chymotrypsin at alkali pH[J]. Journal of Agricultural and Biological Chemistry, 1986, 50: 1989-1994.
[3] HAMADA J S, MARSHALL W E. Preparation and functional properties of enzymatically deamidated soy proteins[J]. Journal of Food Science, 1989, 54: 598-601; 635.
[4] ROBINSON A B, RUDD C. Deamidation of glutaminyl and asparaginyl residues in peptides and proteins[J]. Current Topics in Cellular Regulation, 1974, 8: 247-295.
[5] GUPTA R, SRIVASTAVA O P. Deamidation affects structural and functional properties of human α-Crystallin and its oligomerization with α-Crystallin[J]. Journal of Biology and Chemistry, 2004, 279: 44258-44269.
[6] LURA R, SCHIRCH V. Role of peptide conformation in the rate and mechanism of deamidation of asparaginyl residues[J]. Biochemistry, 1988, 27: 7671-7677.
[7] ASWAD D W, PARANANDI M V, SCHURTER B T. Isoaspartate in peptides and proteins: formation, significance, and analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2000, 21: 1129-1136.
[8] ZHANG J, LEE T C. Thermal deamidation of proteins in a restricted water environment[J]. Journal of Agricultural and Food Chemistry, 1993, 41: 1840-1843.
[9] RIHA W E, IZZO H V, ZHANG J, et al. Nonenzymatic deamidation of food proteins[J]. Critical Review on Food Science and Nutrition, 1996, 36(3): 225-255.
[10] WRIGHT H T. Nonenzymatic deamidation of asparaginyl and glutaminyl residuea in proteins[J]. Critic Review on Biochemistry and Molecular Biology, 1991, 26: 1-51.
[11] MOTOKI M, SEGURO K, NIO N, et al. Glutamine-specific deamidation of α-casein by transglutaminase[J]. Agricultural Biology and Chemistry, 1986, 50: 3025-3030.
[12] SHIH F F. Deamidation during treatment of soy protein with protease[J]. Journal of Food Science, 1990, 55(1): 127-132.
[13] KATO A, ATSUSHI T. Effects of deamidation with chymotrypsin at pH 10 on the functional properties of proteins[J]. Journal of Agricultural and Biological Chemistry, 1987, 35: 285-288.
[14] KATO A, LEE Y, KOBAYASHI K. Deamidation and functional properties of food proteins by the treatment with immobilized chymotrypsin at alkaline pH[J]. Journal of Food Science, 1989, 54(5): 1345-1347.
[15] KATO A, TANAKA A, MASTUDOMI N, et al. Deamidation of food proteins by protease in alkaline pH[J]. Journal of Agricultural and Biological Chemistry, 1987, 35(2): 224-227.
[16] SCHLICHTHERLE-CERNY H, AMADO R. Analysis of taste-active compounds in an enzymatic hydrolysate of deamidated wheat gluten [J]. Journal of Agricultural and Food Chemistry, 2002, 6: 1515-1522.
[17] IZZO H V, LINCOLN M D, HO C T. Effect of temperature, feed moisture, and pH on protein deamidation in an extruded wheat fl our[J]. Journal of Agricultural and Food Chemistry, 1993, 41: 199-207.
[18] 吴向明, 雕鸿荪, 沈蓓英. 大豆蛋白脱酰胺改性的研究[J]. 食品与发酵工业, 1996, 21(5): 13-16.
[19] 卢寅泉, 肖红媚, 郑宗坤. 花生蛋白加工功能性改善的研究[J]. 食品科学, 1995, 16(6): 9-13.
[20] 史新慧, 王兰. 植物蛋白的改性[J]. 郑州粮食学院学报, 1996, 17(4): 61-65.
[21] McDONALD C E, PENCE J W. Wheat gliadin in foams for food products[J]. Food Technology, 1961, 15: 141-144.
[22] WOODAR J C, SHORT D D. Preparation and properties of acidsolubilized gluten conforamtion[J]. Journal of Nutrition, 1973, 24(3): 103-569.
[23] CHAN W M, MA C Y. Acid modification of proteins from soymilk residue (okara)[J]. Food Research International, 1999, 32: 119-127.
[24] MIRMOGHTADAIE L, KADIVAR M, SHAHEDI M. Effects of succinylation and deamidation on functional properties of oat protein isolate[J]. Food Chemistry, 2009, 114: 127-131.
[25] MATSUDOMI N, SASAKI T, TANAKA A, et al. Polymerization of deamidated peptide fragments obtained with the mild acid hydrolysis of ovalbumin[J]. Journal of Agricultural and Food Chemistry, 1985, 33(4): 738-742.
[26] 李红梅. 玉米蛋白脱酰胺改性的研究[J]. 粮食与饲料工业, 2007(4): 19-22.
[27] 孔祥珍, 周惠明. 小麦面筋蛋白脱酰胺改性的研究[J]. 食品科学, 2003, 24(12): 47-49.
[28] BERTI C, RONCORONI L, FALINI M L, et al. Celiac-related properties of chemically and enzymatically modifi ed gluten proteins[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 2482-2488.
[29] LIAO Lan, LIU Tongxun, ZHAO Mouming, et al. Functional, nutritional and conformational changes from deamidation of wheat gluten with succinic acid and citric acid[J]. Food Chemistry, 2010, 123(1): 123-130.
[30] HAN K K, RICHARD C, BISERTE G. Current developments in chemical cleavage of proteins[J]. International Journal of Biochemistry, 1983, 15(7): 875-884.
[31] WRIGHT H T, ROBINSON A B. Cryptic amidase active sites catalyze deamidation in proteins, in from cyclotrons to cytochromes[M]. New York: Academic Press, 1982: 727.
[32] GEIGER T, CLARK S. Deamidation, isomerization, and racemization at asparaginyl and aspartyl residues in peptides: succinimidelinked reactions that contribute to protein degradation[J]. Journal of Biological Chemistry, 1987, 262: 785-794.
[33] VOORTER C E M, HAARD-HOEKMAN W A, van DEN OETELAAR P J M, et al. Spontaneous peptide bond, cleavage in aging α-Crystallin through a succinimide intermediate[J]. Journal of Biological Chemistry, 1988, 263: 19020-19023.
[34] BLODGETT J K, LOUDON G M, COLLINS K D. Specific cleavage of peptides containing an aspartic acid (phydroxamic acid) residue[J]. Journal of the American Chemical Society, 1985, 107: 4305-4313.
[35] TYLER-CROSS R, SCHIRCH V. Effects of amino acid sequence, buffers, and ionic strength on the rate and mechanism of deamidation of asparagine residues in small peptides[J]. Journal of Biological Chemistry, 1991, 266: 22549-22556.
[36] PATEL K, BORCHARDT R T. Chemical pathways of peptide degradation. Ⅱ. Kinetics of deamidation of an asparaginyl residue in model hexapeptide[J]. Pharmaceutical Research, 1990, 25: 7703-7711.
[37] JENCKS W P. Catalysis in chemistry and enzymology[M]. New York: McGraw-Hill, 1969: 523-530.
[38] CHOU P Y, FASMAN G D. D-Turn in proteins[J]. Journal of Molecule Biology, 1977, 15: 135-175.
[39] RICHARDSON J S, RICHARDSON D C. Amino acid preference for specific locations at the end of ahelices[J]. Science, 1988, 240: 1648-1652.
[40] KOSSIAKOFF A A. Tertiary structure is a principal determinant to protein deamidaton[J]. Science, 1988, 240: 191-194.
[41] CHIU H, WU S, NAKAI W D, et al. Preparation and properties of acid-solubilized gluten[J]. Journal of Agricultural and Food Chemistry, 1976, 24(3): 504-510.
[42] MANNING M C, PATEL K, BORCHARDT R T. Stability of protein pharmaceutical[J]. Pharmaceutical Research, 1989, 6: 903-918.
[43] MATSUDOMI N, KUNIHIKO A, KOBAYASHI K. Conformation and surface properties of deamidated gluten[J]. Agricultural Biology and Chemistry, 1982, 46(6): 1583-1586.
[44] LIAO Lan, LIU Tongxun, ZHAO Mouming, et al. Aggregation behavior of wheat gluten during carboxylic acid deamidation upon hydrothermal treatment[J]. Journal of Cereal Sciences, 2011,54: 129-136.
[45] 易翠平, 姚惠源. 酸法脱酰胺对大米蛋白分子间作用力和二级结构的影响[J]. 中国粮油学报, 2007, 22(3): 1-4.
[46] PONNUSWAMY P K, MUTHUSAMY R, MANAVALAN P. Amino acid composition and thermal stability of proteins[J]. International Journal of Biological Macromolecule, 1982, 4: 186-190.

