过量表达乳酸脱氢酶的重组干酪乳杆菌构建及发酵性能
朱龙宝,葛 飞,李婉珍,陶玉贵*
(安徽工程大学生物与化学工程学院,安徽 芜湖 241000)
L-乳酸及其衍生物广泛应用于食品、日用化工、制药、纺织、环保和农业等诸多领域。目前工业生产乳酸方法主要有化学合成法、微生物发酵法和酶转化法[1-2],其中发酵生产乳酸菌是最具潜力的一种生产方式。主要的生产菌种是乳酸杆菌,体内的乳酸脱氢酶是糖酵解途径中的丙酮酸还原生成L-乳酸的关键酶,提高该酶的活力是乳酸工业菌种分子改造和提高乳酸产量的关键[3]。
利用重组DNA、代谢工程技术,有目的改变微生物中已有的代谢网络和表达调控网络是提高L-乳酸产量最有效的手段之一。通过过量表达ldh基因,在合适的宿主中高效表达来实现提高乳酸产量,杨登峰等[4]将Lactobacillus rhamnosus中的ldh基因转入E.coli F中,成功实现基因的表达,并成功生产获得纯度为99%的L-乳酸;Ferain等[5]克隆出ldh基因,导入Lactobacillus plantarum DG301中过量表达LDH,酶活较初始菌株提高13倍。安徽工程大学发酵工程(安徽省)技术中心实验室分离到一株干酪乳杆菌,以该菌株为出发菌,克隆出ldh基因,构建重组质粒pMG-ldh,将其转入出发菌株中,筛选出阳性重组菌,过量表达乳酸脱氢酶,提高乳酸产量,为其工业化生产提供参考。
1 材料与方法
1.1 菌种及试剂
干酪乳酸菌(L.casei) 安徽工程大学发酵工程(安徽省)技术中心实验室分离;E.coli JM109、E.coli BL21(DE3) 生工生物工程(上海)股份有限公司;pMG36e 长沙赢润生物技术有限公司。
pfu DNA聚合酶、连接酶、Marker、DNA回收试剂盒、基因组和质粒提取试剂盒等 生工生物工程(上海)股份有限公司;各种限制性内切酶 日本TaRaKa公司;烟酰胺腺嘌呤二核苷酸(NADH)、果糖-1,6-二磷酸(FBP) 美国Sigma公司;其他试剂 国药集团化学试剂有限公司。
1.2 仪器与设备
凝胶成像系统、蛋白电泳仪、电转仪 美国Bio-Rad公司;PCR扩增仪 德国Eppendorf公司;高速台式离心机 日本日立公司;液相色谱仪 美国Waters公司;SBA40-E生物传感分析仪 山东省科学院生物研究所。
1.3 培养基
种子培养基(g/L):葡萄糖25、玉米浆40、(NH4)2SO45、KH2PO41、MgSO4·7H2O 0.5、CaCO310,用于干酪乳杆菌培养;LB培养基(g/L):蛋白胨10、酵母提取物5、NaCl 10,用于大肠杆菌培养,固体培养基加2%的琼脂;MRS培养基(g/L):葡萄糖40、酵母提取物5、蛋白胨10、牛肉膏10、CH3COONa·3H2O 5、MgSO4·7H2O 0.2、MnSO4·4H2O 0.05、KH2PO41、C6H17N3O72、吐温-80 1,用于干酪乳杆菌培养。固体培养基加2g/100mL的琼脂。
发酵培养基(g/L):葡萄糖120、酵母提取物7.5、蛋白胨15、牛肉膏10、MgSO4·7H2O 0.2、MnSO4·4H2O 0.05、吐温-80 1、CaCO3100,调pH值为7.0。
1.4 方法
1.4.1 基因克隆
基因组DNA、质粒DNA的提取、酶切、连接、转化和感受态细胞制备均参照文献[6],根据GenBank(M76708.1)中公布的干酪乳杆菌LDH基因序列,设计ldh基因的特异性引物P1(5’- GCTCTAGAGTGGCAAGTATTAC-3’)和P2(5’- AACTGCAGTTACTGACGGGTTT-3’)。PCR扩增条件为:94℃预变性3min;94℃变性1min,52℃退火30s,72℃延伸1min,25个循环。
1.4.2 干酪乳杆菌感受态细胞的制备及转化
将斜面菌种接种于5mL的MRS培养基中,40℃、150r/min培养12h,按1%的接种量接入新鲜的50mL MRS培养基中,40℃振荡培养至OD600nm为0.4,无菌操作将50mL菌液冰上冰浴15min后,4℃、3000r/min离心5min,弃上清,用预冷的10%甘油充分悬浮菌体,4℃、3000r/min离心5min,弃上清,重复两次;用400μL预冷的10%甘油重悬菌体,以每离心管100μL分装,置于冰上备用。干酪乳杆菌电转化法,参照文献[7]方法。
1.4.3 重组质粒pMG-ldh的构建
PCR产物和载体pMG36e分别用XbaⅠ和PstⅠ双酶切,用T4 DNA连接酶16℃过夜连接,转化到E.coli JM109感受态细胞中,涂布LB平板培养12h后挑单菌落至液体培养基中37℃培养10h,收集菌体,抽提质粒并双酶切鉴定阳性克隆重组质粒,送生工生物工程(上海)股份有限公司测序。
1.4.4 目的基因在干酪乳杆菌中表达
将构建好的重组质粒pMG-ldh电转干酪乳杆菌感受态,以空质粒pMG36e做对照,均匀涂布含5μg/mL红霉素的MRS平板上,40℃培养36~48h。挑取平板上的单菌落,接种于含5μg/mL的MRS液体培养基中,抽提质粒进行双酶切,确定重组菌L.casei pMG-ldh。
将含重组pMG-ldh的干酪乳杆菌接种于MRS液体培养基中,37℃、100r/min过夜培养,按1%的接种量接种新鲜培养基,培养至对数期后期,收集菌体进行全细胞SDS-PAGE。
1.4.5 乳酸、丙酮酸的测定
样品预处理方法:取适量发酵液8000r/min离心15min,取上清液,加入适量1mol/L硫酸溶液酸解12h后8000r/min离心15min,取上清液,过0.22μm混合纤维素酯微孔滤膜后备用,标准品都为现配现用。
采用高效液相色谱法测定,检测条件为:色谱柱为COSMOSIL5C18-PAQ(4.6mm×250mm,5μm);流动相为0.2mol/L KH2PO4溶液加1%的乙腈;调pH值至2.6~2.8;真空抽滤,流速1.0mL/min;检测波长210nm;柱温25℃;进样量为10μL。
1.4.6 NADH的测定
样品预处理方法:取10mL发酵液,8000r/min离心10min,弃上清液,收集菌体,迅速移入液氮中以阻断微生物细胞代谢,解冻后再以预冷的缓冲液洗涤2~3次,超声波破碎10min后8000r/min离心10min,上清液用0.22μm混合纤维素酯微孔滤膜。
按Koning[8]和陈定强[9]等的方法测定,色谱分析条件为:色谱柱为COSMOSIL5C18-PAQ(4.6mm×250mm);流动相为0.2mol/L磷酸钠缓冲液(含10%的乙腈和10mmol/L四丁基溴化铵),调节pH 6.5,真空抽滤;流速1.0mL/min,检测波长254nm;柱温40℃;进样10μL。
1.4.7 残糖测定
采用李宪民等[10]的测定方法,利用生物传感器分析仪测定,取20μL发酵液上清液稀释100倍,取20μL进样测定。
1.4.8 细胞干质量测定
取适量发酵液,8000r/min离心5min,弃上清液,收集菌体,用1mol/L的HCl溶液洗涤除去CaCO3固体,重复2次,再用蒸馏水悬浮菌体放置烘箱中烘干,称得菌体干质量(DCW),确定DCW与菌体OD600nm值的对应关系。
1.4.9 乳酸脱氢酶活性测定
L-LDH酶活性分析参见文献[11],丙酮酸钠和NADH分别用0.05mol/L乙酸缓冲液溶解,取2支比色皿,一支加入3mL丙酮酸钠溶液作为空白对照,另一支3mL反应体系中依次加入2.9mL丙酮酸钠溶液和0.1mL NADH溶液并混匀,检测初始NADH吸光度,待稳定后,迅速加入2μL酶液,开始光度计读数,每15s测定一次吸光值,反应结束后得到ΔA340nm/min值,根据下述公式计算酶活力。酶活的定义为:在40℃、pH6.7时,每分钟氧化1μmol的NADH所用的酶量为1个酶活力单位(U)。
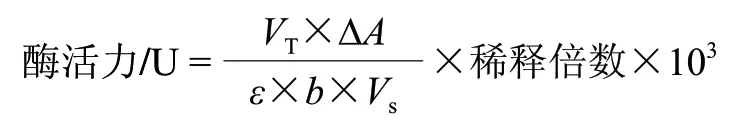
式中:VT为反应总体积/mL;VS为样品体积/mL;ΔA为每分钟吸光度的降低值;b为比色皿光程/cm;ε为NADH消光系数(6.22×103L/(mol·cm))。
2 结果与分析
2.1 ldh基因克隆
以干酪乳杆菌基因组为模板,利用引物P1和P2进行PCR扩增获得ldh基因,PCR产物经琼脂糖凝胶电泳检测,结果如图1所示,泳道中1kb位置出现目的条带,克隆的基因和目的基因大小一致。
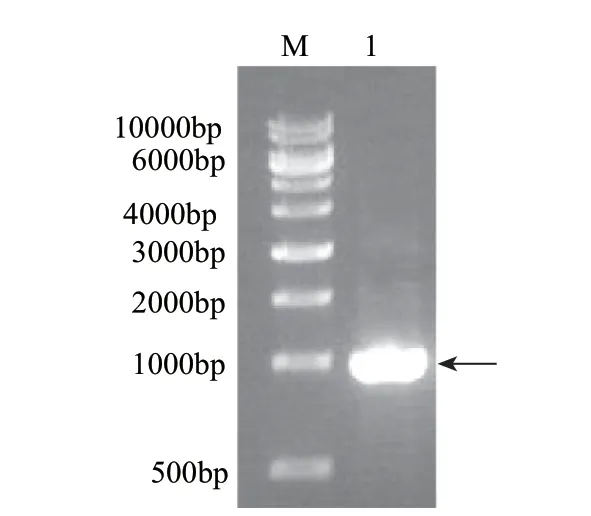
图 1 ldh基因的PCR电泳图Fig.1 PCR amplification of ldh genes from L. casei
2.2 重组质粒pMG-ldhL的构建
PCR产物和质粒pMG36e经XbaⅠ和PstⅠ双酶切后,16℃过夜连接,将连接产物转化E.coli JM109,涂布LB平板培养12h,挑选单菌落液体培养,提质粒,经双酶切鉴定获得阳性克隆质粒pMG-ldh,结果见图2,泳道1中出现1000bp目的条带,将pMG-ldh送上海生工测序,确定正确的阅读框。
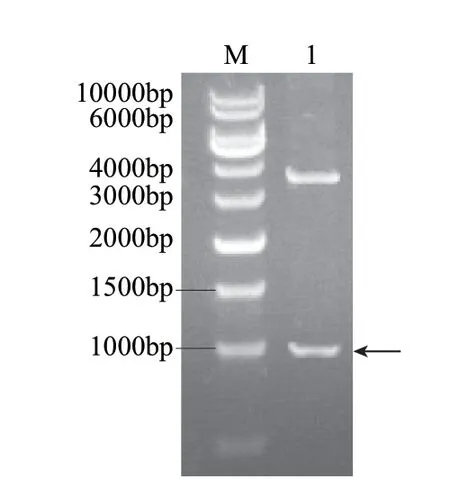
图 2 重组质粒pMG-ldh的酶切鉴定Fig.2 Identification of recombinant plasmid pMG-ldh by double enzyme digestion
2.3 ldh在干酪乳杆菌中的表达
空质粒pMG和重组质粒pMG-ldh分别电转化至干酪乳杆菌感受态细胞中,分别将其接种于含红霉素的MRS液体培养基中培养至对数期后期收集菌体,进行全细胞SDS-PAGE电泳,结果如图3,重组菌株经培养后,与对照菌株相比,约在37kD处出现明显蛋白条带,说明基因在干酪乳杆菌中高效表达。

图 3 L.casei pMG-ldh在干酪乳杆菌中的表达Fig.3 SDS-PAGE analysis of PMG-ldh expression in L. casei
2.4 L.casei pMG-ldh摇瓶发酵培养
2.4.1 L.casei pMG-ldh与原始菌发酵过程中乳酸脱氢酶的变化
为了比较重组菌L.casei pMG-ldh和原始菌表达乳酸脱氢酶,进行了摇瓶发酵实验,分别将重组菌和原始菌接入装有50mL发酵培养基的250mL三角瓶,40℃、100r/min摇瓶培养48h,测定发酵过程中LDH活性,结果如图4所示,在发酵24h左右原始菌中LDH达到最大23U/mL,而重组菌L.casei pMG-ldh中酶活力达95U/mL,是原始菌的4.1倍。
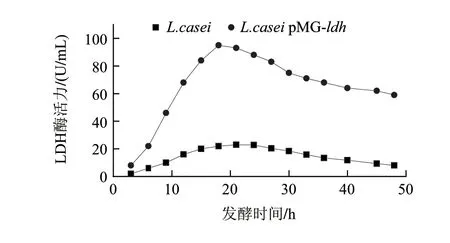
图 4 出发菌株和L.casei pMG-ldh发酵过程中酶活力的变化Fig.4 LDH activity of wild type and the recombinant L.casei strains
2.4.2 重组菌与原始菌的生产性能比较
从上述结果可知,重组菌过量表达了乳酸脱氢酶,为了进一步研究其产乳酸性能,进行了摇瓶发酵实验,分别将重组菌和原始菌接入装有50mL发酵培养基的250mL三角瓶,40℃、100r/min摇瓶培养48h,测定发酵过程中发酵参数,结果如表1所示,虽然重组菌的LDH活性大幅度提高,但乳酸的产率并没比原始菌有大幅度的提高,分别为1.98g/(L·h)和2.1g/(L·h)。通过分析发现,虽然重组菌的LDH活性高于原始菌,重组菌细胞内NADH和丙酮酸与原始菌相差不大,丙酮酸和NADH水平直接影响了其发酵性能。为了进一步提高其生产产量,分别添加4mmol/L激活剂果糖-1,6-二磷酸(FBP)和8mg/L NADH的前体物烟酸,结果发现往原始菌中添加激活剂和前体物烟酸,乳酸产量为105.6g/L,而L.casei pMG-ldh积累L-乳酸达128.2g/L,比原始菌提高了21.4%,原始菌在未添加激活剂和烟酸的条件下提高35%。重组菌在添加激活剂和烟酸的条件下生产强度达到3.04g/(L·h),相比原始菌株L.casei提高53%。添加激活剂和烟酸后,葡萄糖消耗速度明显加快,发酵到42h葡萄糖基本耗尽,发酵提前结束,发酵周期缩短了6h。
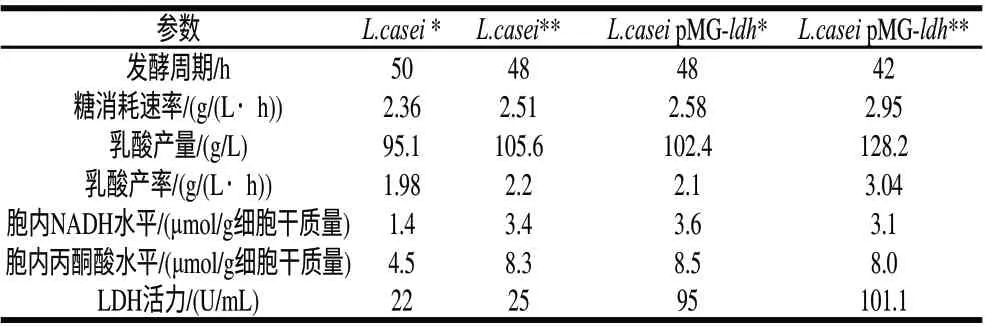
表 1 原始菌株和重组菌发酵过程参数比较Table 1 Fermentation parameters of wild type L.casei and the recombinant L.casei pMG-ldh strains
3 讨 论
为了加强糖酵解速率以提高葡萄糖代谢速度,提高最终产物乳酸浓度,一种方法是通过过量表达关键酶或者改变营养环境条件提高EMP途径磷酸果糖激酶等关键酶的酶活力[12-14];另外可通过添加合成NAD+前体物、改变溶氧、温度、过量表达NADH代谢相关酶等手段调节胞内能量水平、还原力水平来实现对NADH代谢的调控[15],来实现乳酸产量的提高。
Porro等[16]将乳酸乳酸脱氢酶基因转入野生型K.lactis酵母中过量表达乳酸脱氢酶,乳酸产量达109g/L,生产强度达0.91g/(L·h),成功实现在外源宿主中实现乳酸脱氢酶的过量表达,并获得较高的乳酸生产率。Saitoh等[17]将L-乳酸脱氢酶基因整合在酿酒酵母的染色体上,成功构建6个拷贝的重组酵母生产L-乳酸,产量达122g/L,且光学纯度达到99.9%。这些现象说明增加乳酸脱氢酶基因拷贝数能够提高乳酸的产量。本实验室筛选到一株高产的乳酸菌,为进一步提高其生产应能,增加乳酸脱氢酶的基因拷贝数,将乳酸脱氢酶导入生产菌中实现高效表达。但是Ferain[5]、Davidson[18]等将乳酸脱氢酶导入到宿主Lactobacillus plantarum TF101中增加其拷贝数,结果发现乳酸产量没有大幅度的提高。这可能是由于糖代谢速率并没有提高,增加基因的拷贝数的同时应该提高乳酸合成途径的代谢通量。
本实验以L.casei基因组为模板,PCR扩增得到ldhL基因,构建重组质粒pMG-ldhL,将重组质粒转入L.casei,获得重组菌L.casei pMG-ldh,培养重组菌表达目的蛋白,与对照初始菌株相比,约在37kD处出现明显蛋白条带,酶活力有较大幅度的提高。在此基础上,进一步考察激活剂和前体物烟酸对产酸的影响,结果发现具有高LDH活性的重组均产酸速率快,生产强度提高了53%,发酵周期缩短6h,乳酸积累达128.2g/L。通过表达乳酸脱氢酶以及改变乳酸脱氢酶的基因拷贝数,过调节乳酸脱氢酶的表达量和异源表达乳酸脱氢酶等手段可有效地改善了菌株合成乳酸的效率和所产乳酸的光学纯度。胞内能量和还原力水平对微生物代谢的调控是相辅相成的,可通过调节胞内NADH的形式及浓度以及所产生的ATP 直接或间接调节代谢途径中关键酶的活性,从而影响微生物细胞的生长及代谢功能,实现对碳代谢流及通量的调控,后续实验还需要进一步深入研究细胞内LDH、ATP和还原力NADH对糖降解速率的影响,优化最佳的代谢流控制途径,进一步提高产量。
[1] ZHENG Zhaojuan, SHENG Binbin, MA Cuiqing, et al. Relative catalytic efficiency of ldhL- and ldhD-encoded products is crucial for optical purity of lactic acid produced by Lactobacillus strains[J]. Applied and Environmental Microbiology, 2012, 78(9): 3480-3483.
[2] JIN Q, JUNG J Y, KIM Y J, et al. Production of L-lactate in Leuconostoc citreum via heterologous expression of L-lactate dehydrogenase gene[J]. Journal of Biotechnology, 2009, 144(2): 160-164.
[3] GE Y Y, YUAN J, QIN H, et al. Improvement of L-lactic acid production by osmotic-tolerant mutant of Lactobacillus casei at high temperature[J]. Applied Microbiology and Biotechnology, 2011, 89(1): 73-78.
[4] 杨登峰, 潘丽霞, 黄日波, 等. 产高纯度L-乳酸大肠杆菌基因工程菌的初步研究[J]. 现代食品科技, 2010, 26(2): 126-128.
[5] FERAIN T, GARMYN D, BERNARD N. Lactobacillus plantarum ldhL gene: overexpression and deletion[J]. Journal of Bacteriology, 1994, 176(3): 596-601.
[6] SAMBROOK J, RUSEEL D W. Molecular cloning[M]. New York: Cold Spring Harbor Laboratory Press, 2001.
[7] 格日勒图, 王艳霞, 张和平, 等. 电转化方法将外源性质粒导入干酪乳杆菌的研究[J]. 中国乳品工业, 2009, 37(2): 9-13.
[8] de KONING W, van DARN K. A method for the determination of changes of gtycolytic metabolites in yeast on a subsecond time scale using extraction at neutral pH[J]. Anal Biochem, 1992, 204: 118-123.
[9] 陈定强, 詹晓北, 郑志永, 等. 粪产碱杆菌胞内核苷酸的反相高效色谱法测定[J]. 食品工业科技, 2010, 31(1): 391-394.
[10] 李宪民, 丁芳, 樊伟丽, 等. 生物传感分析仪测定葡萄糖和L-乳酸的影响因素研究[J]. 食品工业科技, 2009, 30(2): 289-291.
[11] 李建武, 萧能, 余瑞元, 等. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 1997: 351-353.
[12] 贾江花, 沐万孟, 张涛, 等. 重组L-乳酸脱氢酶在大肠杆菌中的表达、纯化及活性研究[J]. 食品与发酵工业, 2009, 35(5): 22-25.
[13] CAUSEY T B, SHANMUGAM K T, YOMANO L P, et al. Engineering Escherichia coli for efficient conversion of glucose to pyruvate[J]. PNAS, 2004, 101(8): 2235-2240.
[14] 秦义, 董志姚, 刘立明, 等. 工业微生物中NADH的代谢调控[J]. 生物工程学报, 2009, 25(2): 161-169.
[15] 刘立明, 邓禹, 李寅, 等. 营养和环境条件对光滑球拟酵母葡萄糖代谢速度的影响[J]. 应用与环境生物学报, 2006, 12(5): 688-692.
[16] PORRO D, BIANCHIM M, BRAMBILLA L, et al. Replacement of a metabolic pathway for large scale production of lactic acid from engineered yeasts[J]. Applied and Environmental Microbiology, 1999, 65(9): 4211-4215.
[17] SAITOH S, ISHIDA N, ONISHI T, et al. Genetically engineered wine yeast produces a high concentration of L-lactic acid of extremely high optical purity[J]. Applied and Environmental Microbiology, 2005, 71(5): 2789-2792.
[18] DAVIDSON B E, LLANOS R M, CANCILLA M R, et al. Current research on the genetics of lactic acid production in lactic acid bacteria[J]. International Dairy Journal, 1995, 5(8): 763-784.

