热处理对牛乳铁蛋白促成骨细胞增殖活性影响
刘 猛,杜 明*,孔莹莹,徐伟丽,宋 微,张兰威
(哈尔滨工业大学食品科学与工程学院,黑龙江 哈尔滨 150090)
乳铁蛋白(Lf)又称乳铁传递蛋白,主要存在于哺乳动物的各种外分泌物中,如乳汁、泪液或唾液等[1]。Lf可以作为一种铁强化剂调控铁的生物利用率,此外,Lf还具有多种其他生物功能,例如抗菌、抗病毒和抗氧化作用,参与机体免疫调节,增强机体抗病能力[2]等。近期,乳铁蛋白被发现具有促骨生长的功效[3-4]。诸多研究表明,Lf既能刺激成骨细胞(osteoblast,OB)增殖,促进成骨细胞增殖与分化、也能抑制破骨细胞生长与活性、诱导破骨细胞(osteoclast,OC)凋亡[5-6]。体内研究表明,乳铁蛋白在骨生长和代谢中起到一定的生理作用,能促进骨骼生长[7]。在乳品加工业中,热处理是最为常见的操作单元,然而迄今为止,热处理对乳铁蛋白活性的影响研究主要集中在抗菌活性等方面。热处理对乳铁蛋白成骨作用的影响报道很少,本实验主要研究热处理(温度和时间)对乳铁蛋白成骨活性的影响。
1 材料与方法
1.1 材料、试剂与仪器
SD大鼠乳鼠(72h以内)由哈尔滨医科大学第二附属医院提供。
乳铁蛋白(>94%)、Ⅱ型胶原酶、MTT 美国Sigma公司;α-MEM培养基、胎牛血清 美国Hyclone公司;胰蛋白酶-EDTA消化液 Solarbio公司;二甲基亚砜(DMSO)、巴比妥钠 美国Gibco公司。
倒置式生物显微镜 日本Nikon公司;Eon型酶标仪 美国BioTek公司;HEPA class 100型细胞培养箱 美国Thermo公司。
1.2 方法
1.2.1 成骨细胞分离鉴定
从新生SD大鼠乳鼠中提取成骨细胞,通过形态观察、HE 染色、碱性磷酸酶染色及矿化结节染色来鉴定成骨细胞[8]。
1.2.2 实验分组及热处理
样品分组:Lf低质量浓度组(50μg/mL)、中质量浓度组(100μg/mL)、高质量浓度组(500μg/mL)。热处理条件:62~65℃处理 30min、72℃处理 10s、85℃处理10min以及95℃处理10min。以未经加热的乳铁蛋白(Native-Lf)为对照。
1.2.3 MTT法测定成骨细胞增殖
调节细胞质量浓度为每孔l×105个/mL接种于96孔培养板中,每孔加入100μL细胞悬液。细胞贴壁后,弃培养液,每孔再加入95μL培养液以及5μL样品溶液。测定前4h,加10μL 0.5mg/mL MTT(pH7.2 0.01mol/L PBS配制),培养箱中孵育4h。弃去培养液,每孔加150μL DMSO,振荡10min使结晶溶解。波长490nm 处测定OD490nm[9]。
1.2.4 统计学分析及绘图
数据采用 Origin8.0软件进行计算绘图。采用SPSS 17.0统计软件,One-way ANOVA进行显著性检验。数据以±s表示,P<0.05为显著性差异,P<0.01为极显著性差异。
2 结果与分析
2.1 成骨细胞的鉴定
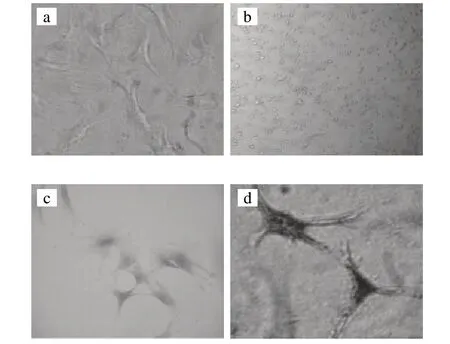
图 1 SD大鼠乳鼠成骨细胞分离与鉴定Fig.1 Isolation and identifi cation of osteoblasts from newborn SD rats
倒置显微镜观察成骨细胞,以不规则形、长梭形、三角形为主,相邻细胞彼此贴靠,边界难以分清,结果如图1a所示,HE染色、碱性磷酸酶染色、矿化结节染色分别如图1b~d所示,这些染色结果均表明分离的细胞具有成骨细胞的所有特征[8]。
2.2 Native-Lf对成骨细胞增殖的影响
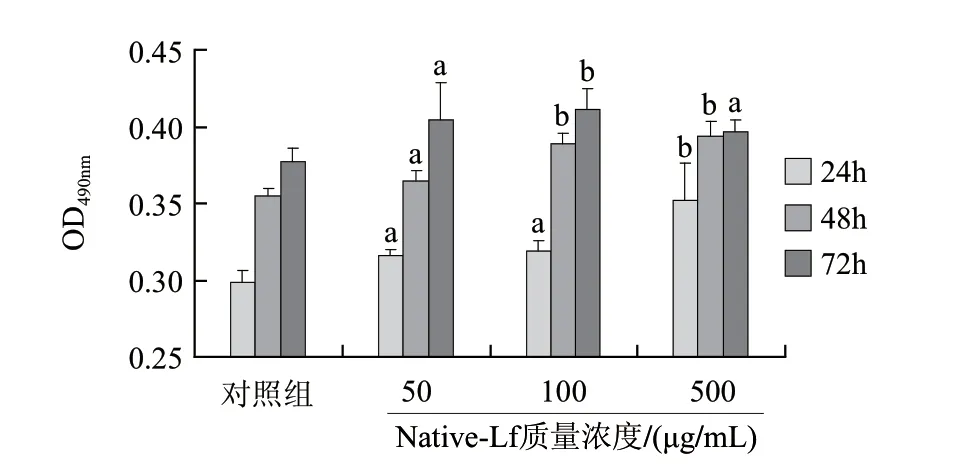
图 2 未经过热处理的Lf对成骨细胞增殖的促进作用Fig.2 Osteoblast-promoting activity of lactoferrin without heat treatment
Native-Lf对成骨细胞增殖作用影响如图2所示,Native-Lf低质量浓度组(50μg/mL)在24、48、72h对成骨细胞增殖具有显著的促进作用;中质量浓度组(100μg/mL)作用细胞24h能显著性促进成骨细胞增殖,48h和72h能极显著促进细胞增殖;高质量浓度组(500μg/mL)在24h和48h能极显著促进细胞增殖,在72h时显著促进成骨细胞增殖。在一定质量浓度范围内,Native-Lf对成骨细胞增殖作用呈剂量依赖关系,这与文献[5,10]报道具有一致性。但24~72h不同时间点表现出的趋势略有不同,24h条件下,高质量浓度 Native-Lf活性最高,与中质量浓度和低质量浓度组差异显著;48h中质量浓度和高质量浓度组Native-Lf活性显著高于低质量浓度组;72h条件下,中质量浓度的活性显著高于低质量浓度组和高质量浓度组。整体上看,随着作用时间的延长,Native-Lf的最佳作用质量浓度有一定的下降趋势。
2.3 不同温度热处理对乳铁蛋白成骨细胞增殖的影响
2.3.1 65℃加热处理Lf对成骨细胞增殖作用影响
Lf经过65℃加热处理30min,对成骨细胞作用结果如图3所示。24h,质量浓度在50~500μg/mL时能显著促进成骨细胞增殖;48h和72h,低质量浓度组可显著促进成骨细胞增殖,在Lf为100μg/mL时能极显著促进成骨细胞增殖。高质量浓度组在48h和72h相对于对照组,有少量增加,但差异不显著。这些结果说明65℃/30min对Lf的活性影响在50~100μg/mL范围内几乎无显著影响,对于高质量浓度组有一定的影响。研究表明,这4种加热参数对于乳铁蛋白热聚集的诱导作用是不同的,随着加热强度的提高,乳铁蛋白的热聚集作用增强。高质量浓度时,Lf热聚集的趋势相应增强,相应地Lf的生理活性受影响也较为明显。

图 3 65℃/30min处理的Lf对成骨细胞增殖的影响Fig.3 Effect of 65 ℃/30 min on the osteoblast-promoting activity of lactoferrin
2.3.2 72℃加热处理Lf对成骨细胞增殖作用影响
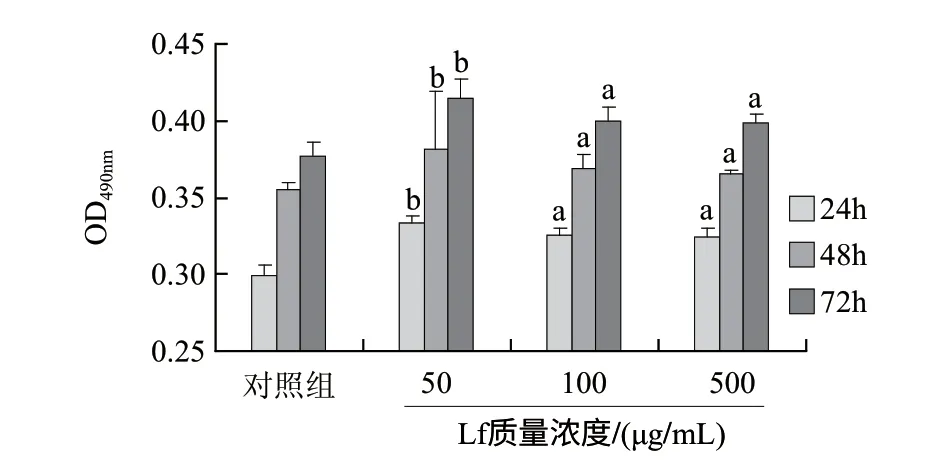
图 4 72 ℃/10s处理LF对成骨细胞增殖的影响Fig.4 Effect of 72 ℃/10 s on the osteoblast-promoting activity of lactoferrin
Lf经72℃加热处理10s,对成骨细胞增殖作用结果如图4所示。在各个时间点条件下,各质量浓度组均可显著促进成骨细胞增殖,而且低质量浓度组(50μg/mL)显著高于中质量浓度组(100μg/mL)和高质量浓度组(500μg/mL)。整体趋势与未经加热处理的Lf相差不大,这说明72℃/10s对Lf的活性影响相对较小,尤其对于质量浓度较低的情况影响较小。
2.3.3 85℃加热处理Lf对成骨细胞增殖作用影响
Lf经85℃加热处理10min,对成骨细胞增殖作用如图 5所示。24h时,低质量浓度组可极显著促进细胞增殖,中质量浓度组与对照组差异显著,高质量浓度组则极显著抑制细胞增殖;48h时,Lf在中低质量浓度时与对照组差异不显著,在高质量浓度时则极显著抑制成骨细胞增殖;72h,低质量浓度组可极显著促进细胞增殖,中质量浓度组时与对照组相比无显著差异,高质量浓度组则显著性抑制成骨细胞增殖。这些结果表明,85℃/10min对Lf活性影响较大,整体上呈下降趋势,在高质量浓度组影响较大。而且在不同时间点,活性表现不同,分析可能是由于Lf对调控成骨细胞增殖的信号通路调控作用不同造成的[11-12]。
成骨细胞的生长分化主要由以丝裂原活化蛋白激酶(MAPK)细胞信号转导通路介导。主要包括ERK、JNK 和p38MAPK 3个亚通路。有研究报导了Lf调控成骨细胞p42/44MAPK等信号转导通路促进成骨细胞分化增殖,并明显地抑制成骨细胞凋亡[12]。因此,有本研究结果推测,Lf对这些信号通路的调控可能发生在不同的阶段,由此造成了上述现象。
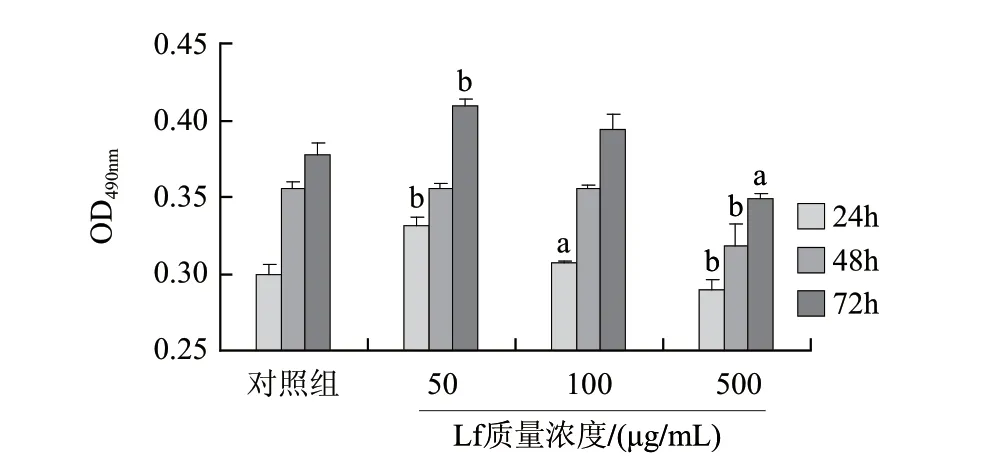
图 5 85℃/10min处理Lf对成骨细胞增殖的影响Fig.5 Effect of 85 ℃/10 min on the osteoblast-promoting activity of lactoferrin
2.3.4 95℃加热处理Lf对成骨细胞增殖作用影响
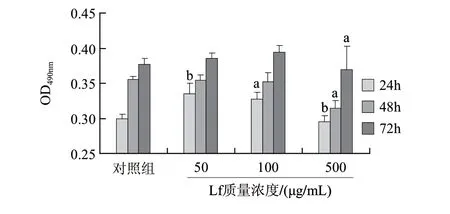
图 6 95℃/10min处理Lf对成骨细胞增殖的影响Fig.6 Effect of 95 ℃/10 min on the osteoblast-promoting activity of lactoferrin
Lf经95℃加热处理10min,对成骨细胞增殖作用如图6所示。24h时,低、中质量浓度组的Lf可显著性促进成骨细胞增殖,高质量浓度组(500μg/mL)则极显著性抑制成骨细胞增殖;48h与72h时,中低质量浓度组与对照组无显著差异,高质量浓度组显著性抑制成骨细胞增殖;这说明95℃加热处理10min对乳铁蛋白的活性具有明显影响,趋势与85℃/10min处理组相似。
Rüegg等[13]研究发现在pH值为6.6时,Lf在65~69℃时开始失活。研究发现Lf的Tm随pH值减小而降低,当体系pH值由7.0降至3.0时,牛乳乳铁蛋白(bLf)的Tm由70℃变化为39℃,且bLf的变性是不可逆的。程金波等[14]研究发现不同的温度与时间的热处理方式组合可以显著的影响乳中Lf的活性。有研究表明,巴氏杀菌对bLf结构及抗菌活性基本上没影响[15]。另外,蛋白质的结构决定其功能。Lf发挥功能过程中可能以骨桥蛋白(OPN)作为运转载体[16-17],并主要通过LRP1/2介导的细胞内吞作用进入成骨细胞[18],这些蛋白间的相互作用也随着Lf结构的变化而变化。本小组此前的研究报道了Native-Lf的变性温度为73.1℃,当处理温度大于73.1℃时,Lf发生结构变化,与OPN和LRP1等的相互作用也将发生改变,活性也将受到影响。因此本研究中65℃/30min和72℃/10s对Lf活性影响较小,85℃/10min和95℃/10min对Lf活性的影响较大,这些热处理对Lf促成骨活性的影响程度从小到大的顺序为72℃/10s<65℃/30min<85℃/10min< 95℃/10min。
3 结 论
未经加热处理的乳铁蛋白具有良好的促进成骨细胞增殖活性,在50~500μg/mL可促进成骨细胞增殖,并呈现剂量依赖关系。一定强度的热处理将破坏乳铁蛋白的促成骨活性,随着热处理强度的提高,该活性损失程度逐渐增加。65℃/30min和72℃ 10s对Lf的活性无显著影响,85℃/10min和95℃/10min对Lf成骨活性影响显著,尤其是对高质量浓度的剂量组。不同时间点,Lf对成骨细胞增殖活性的影响表现不同。
[1] BAKER E N, BAKER H M. A structural framework for understanding the multifunctional character of lactoferrin[J]. Biochimie, 2009, 91(1): 3-10.
[2] FARNAUD S, EVANS R W. Lactoferrin: a multifunctional protein with antimicrobial properties[J]. Mol Immunol, 2003, 40(7): 395-405.
[3] NAOT D, GREY A, REID I R, et al. Lactoferrin: a novel bone growth factor[J]. Clin Med Res, 2005: 3(2): 93-101.
[4] CORNISH J, PALMANO K, CALLON K E, et al. Lactoferrin and bone; structure activity relationships[J]. Biochem Cell Biol, 2006, 84(3): 297-302.
[5] CORNISH J, CALLON K E, NAOT D, et al. Lactoferrin is a potent regulator of bone cell activity and increases bone formation in vivo[J]. Endocrinology, 2004, 145(9): 4366-4374.
[6] KRUGER M C, POULSEN R C, SCHOLLUM L, et al. A comparison between acidic and basic protein fractions from whey or milk for reduction of bone loss in the ovariectomized rat[J]. International Dairy Journal, 2006, 16(10): 1149-1156.
[7] 肖晖, 刘宁. 牛源乳铁蛋白对体外培养大鼠成骨细胞 RANKL 和OPG mRNA 表达的影响[J]. 中国骨质疏松杂志, 2008,14(7): 463-466.
[8] 曹阳阳, 张楠楠, 李丹丹, 等. 铁饱和乳铁蛋白对大鼠成骨细胞增殖与分化的影响[J]. 中国骨质疏松杂志, 2009, 15(10): 752-755.
[9] 王洪复. 骨细胞图谱与骨细胞体外培养技术[M]. 上海: 上海科学技术出版社, 2001.
[10] 肖晖, 刘宁. 乳铁蛋白对大鼠成骨细胞增殖与分化的影响[J]. 国际骨科学杂志, 2008, 29(3): 198-201.
[11] MAGDALENA C, MARLENA C K. Osteoprotegerin-receptor activator of nuclear factor-κB ligand ratio: a new approach to osteoporosis treatment[J]. Southern Medical Journal, 2004, 97(5): 506-511.
[12] 孔莹莹, 杜明, 刘猛, 等. 乳铁蛋白理化性质及其成骨作用研究进展[J]. 食品科学, 2012, 33(21): 318-322.
[13] RUEGG M. A calorimetric study of the thermal denaturation of whey proteins in simulated milk ultrafi ltrate[J]. Journal of Dairy Research, 1977, 82(3): 1082-1085.
[14] 程金波, 王加启, 李珊珊, 等. 不同热处理方式对牛奶中IgG和乳铁蛋白的影响[J]. 华北农学报, 2010, 25(增刊1): 170-174.
[15] SREEDHARA A, FLENGSRUD R, PRAKASH V, et al. A comparison of effects of pH on the thermal stability and conformation of caprine and bovine lactoferrin[J]. International Dairy Journal, 2010, 20(7): 487-494.
[16] AZUMA N, MAETA A, FUKUCHI K, et al. A rapid method for purifying osteopontin from bovine milk and interaction between osteopontin and other milk proteins[J]. International Dairy Journal, 2006, 16(4): 370-378.
[17] DU Ming, XU Weili, YI Huaxi, et al. Protective effects of bovine colostrum acid proteins on bone loss of ovariectomized rats and the ingredients identification [J]. Mol Nutr Food Res, 2011, 55(2): 220-228.
[18] GREY A, ZHU Q, WATSON M, et al. Lactoferrin potently inhibits osteoblast apoptosis, via an LRP1-independent pathway[J]. Molecular and Cellular Endocrinology, 2006, 251(1): 96-102.

