醋酸纤维素-聚丙烯复合膜固定化转谷氨酰胺酶的研究
时 敏,王 雪,马丽娜,于殿宇
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
蛋白质-谷氨酰胺γ-谷氨酰胺基转移酶(MTG,EC2.3.2.13,简称转谷氨酰胺酶)是一种能催化转酰基反应,催化蛋白质中的赖氨酸上的ε-氨基和谷氨酸上的γ-羟酰胺基之间的结合反应,从而导致蛋白质(或多肽)之间发生共价交联形成共价化合物的聚合酶[1]。它可通过胺的导入、交联以及脱胺3种途径改善蛋白质的功能特性[2-3]。这种酶不仅可以改善食品的功能特性,通过交联作用还可以开发新的具有更高营养特性的新食品资源[4-7],因此在食品类生产中有着广泛的应用。而转谷氨酰胺酶的稳定性较差,在常态条件下易失活[8]。文献[9-11]采用将酶制成酶晶体,用磁性壳聚糖固定等方法提高酶的稳定性、延长贮藏期,并提高其重复使用率。虽然对聚丙烯膜进行处理的方法有很多种[12-13],但是将其表面涂层醋酸纤维素固定转谷氨酰胺酶却未见报道。以高分子分离膜作为载体的固定化酶膜能够将酶的催化特性和膜的优良分离性能进行有机地结合,成为了近年来的研究热点[14-16]。
醋酸纤维素-聚丙烯复合膜具有一定的吸附性、化学稳定性、疏水性和机械性能优良等优点,用其固定化酶可提高酶在反应体系中的活性和稳定性,从而有利于酶的回收和产品的生产。本实验利用醋酸纤维素-聚丙烯复合膜为载体固定转谷氨酰胺酶,研究不同固定化条件对固定化效率和催化效果的影响,并对固定化转谷氨酰胺酶酶学性质进行探讨。
1 材料与方法
1.1 材料与试剂
醋酸纤维素 北京惠宝联化科技有限公司;聚丙烯膜 北京塑料研究所;转谷氨酰胺酶 上海线磊生物科技有限公司。
丙酮 天津市基准化学试剂有限公司;磷酸氢二钠天津基准化学试剂有限公司;N-α-CBZ-Gln-Gly 上海竹源生物科技有限公司 ;三氯乙酸、FeCl3·6H2O 苏州源景化工有限公司;L-谷氨酸γ-单羟肟酸 深圳市迪肯科技有限公司。
1.2 仪器与设备
UV-260紫外分光光度计 上海元析仪器有限公司;高速离心机 北京医药公司;DF-101S焦热式恒温加热磁力搅拌器 郑州金育科贸有限公司;PHS-3C精密酸度计 瑞士梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 醋酸纤维素-聚丙烯复合膜的制备
将5g醋酸纤维素溶于100mL丙酮中,待溶解完全成均一的膜液后,取聚丙烯膜浸于溶有醋酸纤维素的丙酮溶液中,自然成膜,以去离子水冲洗醋酸纤维素-聚丙烯复合膜数次干燥备用[17]。
1.3.2 转谷氨酰胺酶的固定
采用吸附、交联相结合的固定化方法,取若干1cm2的醋酸纤维素-聚丙烯复合膜于三角瓶中,加入一定质量浓度的转谷氨酰胺酶液和pH6.0的磷酸盐缓冲液中,吸附一定时间。再加入一定量戊二醛进行交联反应,反应结束后将膜取出,用磷酸盐缓冲溶液冲洗后干燥。并将干燥好的固定化酶膜浸入磷酸盐缓冲液中贮存备用。
1.3.3 酶活力测定
采用Folk等[18]的分光异羟肟酸(hydroxamate)分析法测定。1个酶活力单位定义为:37℃时每分钟催化1μmol N-α-CBZ-Gln-Gly生成单羟肟酸的酶量,单位是U/g膜。相对酶活力以每组中所测酶活力与该组中最高酶活力的相对百分比表示。
1.3.4 固定化转谷氨酰胺酶酶学性质
固定化转谷氨酰胺酶酶学性质包括对固定化酶的最适温度和最适pH值[19]。
1.3.5 电镜扫描(SEM)
将聚丙烯膜、醋酸纤维素-聚丙烯复合膜及在相同条件下,聚丙烯膜固定的转谷氨酰胺酶膜和醋酸纤维素-聚丙烯复合膜固定的转谷氨酰胺酶膜进行电镜扫描。
2 结果与分析
2.1 酶液质量浓度对固定化效果的影响
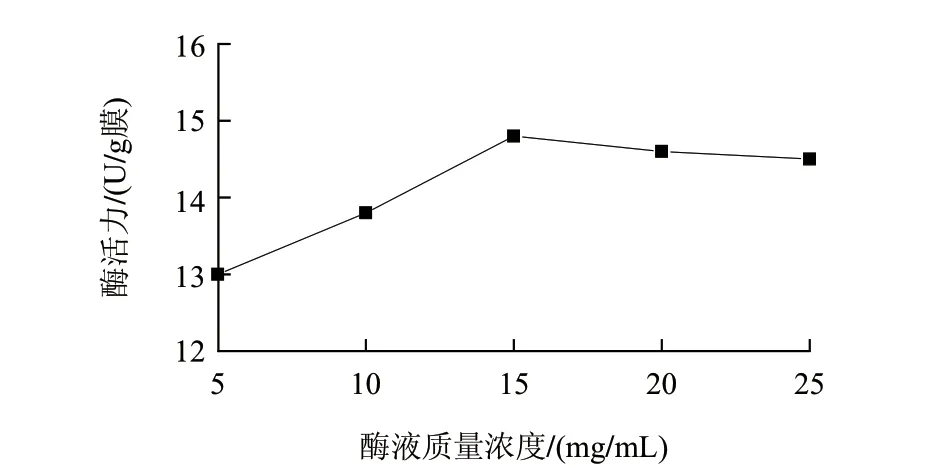
图 1 酶液质量浓度对固定化酶膜酶活力的影响Fig.1 Effect of enzyme concentration on the activity of immobilized enzyme membrane
在吸附时间4h、戊二醛添加量0.3g/100mL、戊二醛交联时间4h的条件下,分别考察酶液质量浓度为5、10、15、20、25mg/mL对固定化酶活力的影响。由图1可知,酶活力随着酶液质量浓度的增加而增大,在15mg/mL时达到最大值,随后随着酶液质量浓度的增加而缓慢降低。说明醋酸纤维素-聚丙烯复合膜作为载体固定化转谷氨酰胺酶的量是有限的,酶液质量浓度达到一定量后,醋酸纤维素-聚丙烯复合膜吸附的转谷氨酰胺酶相互聚集,从而使酶活力降低。
2.2 吸附时间对固定化效果的影响
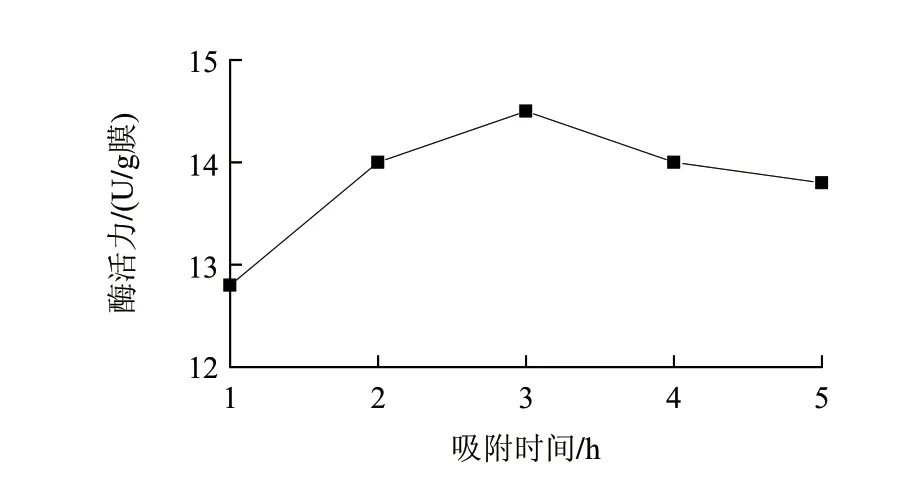
图 2 吸附时间对固定化酶膜酶活力的影响Fig.2 Effect of adsorption time on the activity of immobilized enzyme membrane
在酶液质量浓度15mg/mL、戊二醛添加量0.3g/100mL、戊二醛交联时间4h的条件下,考察吸附时间为1、2、3、4、5h对固定化酶活力的影响。由图2可知,酶活力随着吸附时间的延长而增大,在3h达到最大值,随后随着吸附时间的进一步延长而降低。说明酶分子与载体反应基团可相互结合,尤其在3h最为充分,此后酶分子相互聚集导致酶的活性中心互相遮盖而使酶活力逐渐降低。
2.3 戊二醛添加量对固定化效果的影响
在酶液质量浓度15mg/mL、吸附时间3h、戊二醛交联时间4h的条件下,采用戊二醛添加量为0.、0.2、0.3、0.4、0.5g/100mL对固定化磷脂酶活力的影响。由图3可知,固定化酶活随着戊二醛添加量的增加而增加,在0.3g/100mL时固定效果最好,之后则随着添加量的进一步增加而降低。这是因为在反应开始时,转谷氨酰胺酶被戊二醛充分交联,随后达到饱和,进一步增加戊二醛的添加量那么戊二醛对酶就会产生一定的抑制作用,从而导致酶活力降低。
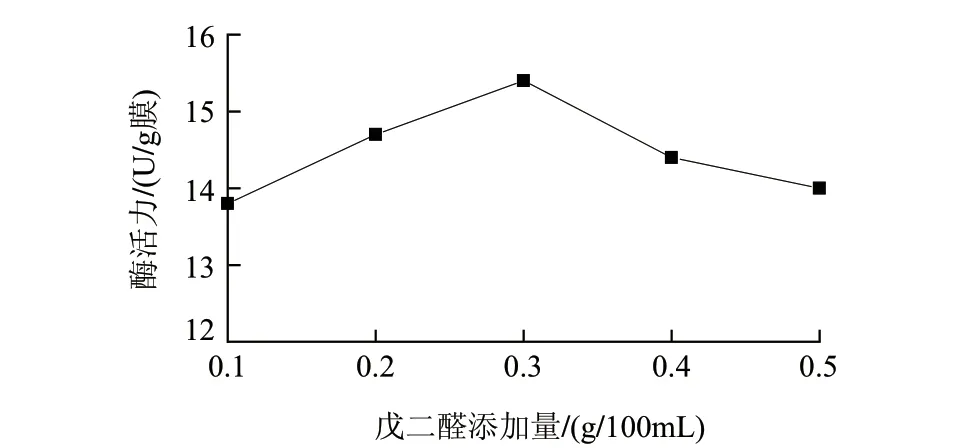
图 3 戊二醛添加量对固定化酶膜酶活力的影响Fig.3 Effect of glutaraldehyde concentration on the activity of immobilized enzyme membrane
2.4 戊二醛交联时间对固定化效果的影响
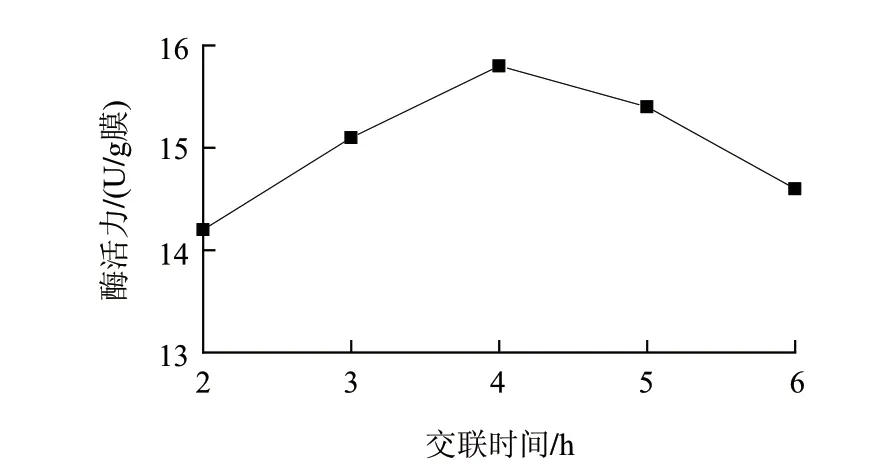
图 4 戊二醛交联时间对固定化酶膜酶活力的影响Fig.4 Effect of cross-linking time on the activity of immobilized enzyme membrane
在酶液质量浓度15mg/mL、吸附时间3h、戊二醛添加量0.3g/100mL的条件下,考察戊二醛交联时间为2、3、4、5、6h对固定化酶活力的影响。由图4可知,转谷氨酰胺酶的酶活力随着戊二醛交联时间的延长而增加,在4h时达到最大值,之后随着交联时间的进一步延长而减小。引起这一现象的原因可能是超过4h后时间过长,交联程度过高,酶的活性中心被破坏,从而是的酶活力下降。
2.5 固定化酶膜最适pH值
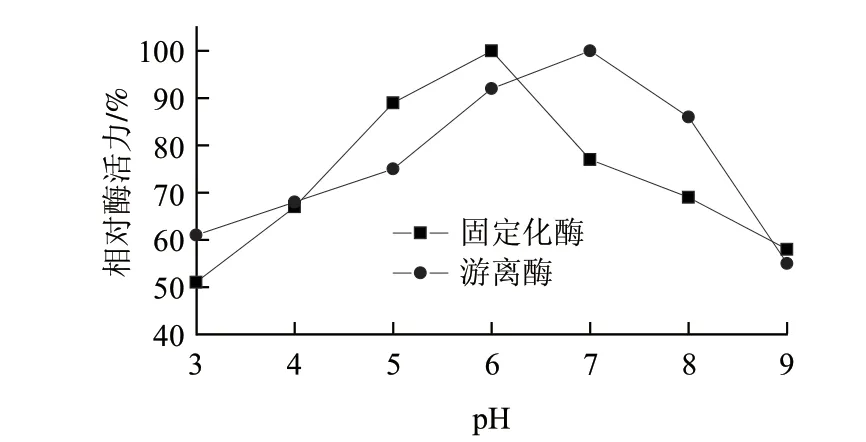
图 5 固定化酶膜与游离酶最适pH值Fig.5 Optimal pH of immobilized enzyme membrane and free enzyme
其他条件不变,分别在各自最适温度条件下,在pH值为3~9范围内测定固定化酶和游离酶活力,并计算相对酶活力。由图5可知,在相同设定条件下,固定化酶膜最适pH值为5~6,游离酶最适pH值为6~7,这与Ando等[19]报道的转谷氨酰胺酶的最适pH6~7相一致。说明酶经固定化以后对pH值的敏感性降低。还可以看出,固定化酶膜在偏酸性的环境中比在偏碱性的环境中相对酶活力降低的幅度要小,原因可能是固定在膜上的酶构象发生了变化,引起其对酸性环境的适应性增强。
2.6 固定化酶膜最适温度
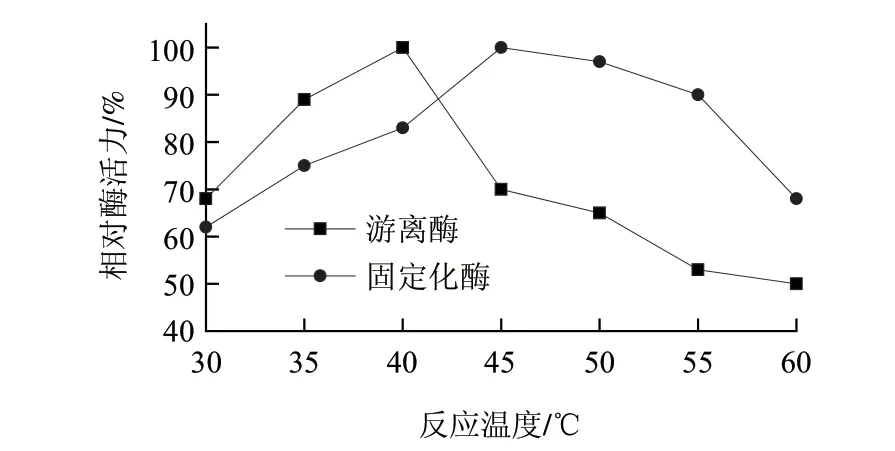
图 6 固定化酶膜及游离酶的最适温度Fig.6 Optimal temperature of immobilized enzyme membrane and free enzyme
其他条件不变,分别在各自最适pH值条件下,在温度范围30~60℃水浴锅内测定固定化酶和游离酶活力,并计算相对酶活力。由图6可知,在相同实验设定条件下,游离酶最适温度为35~40℃,当温度超过40℃时相对酶活力显著下降,而固定化酶最适温度为45~50℃,当温度超过50℃相对酶活力显著下降。
2.7 电镜扫描结果
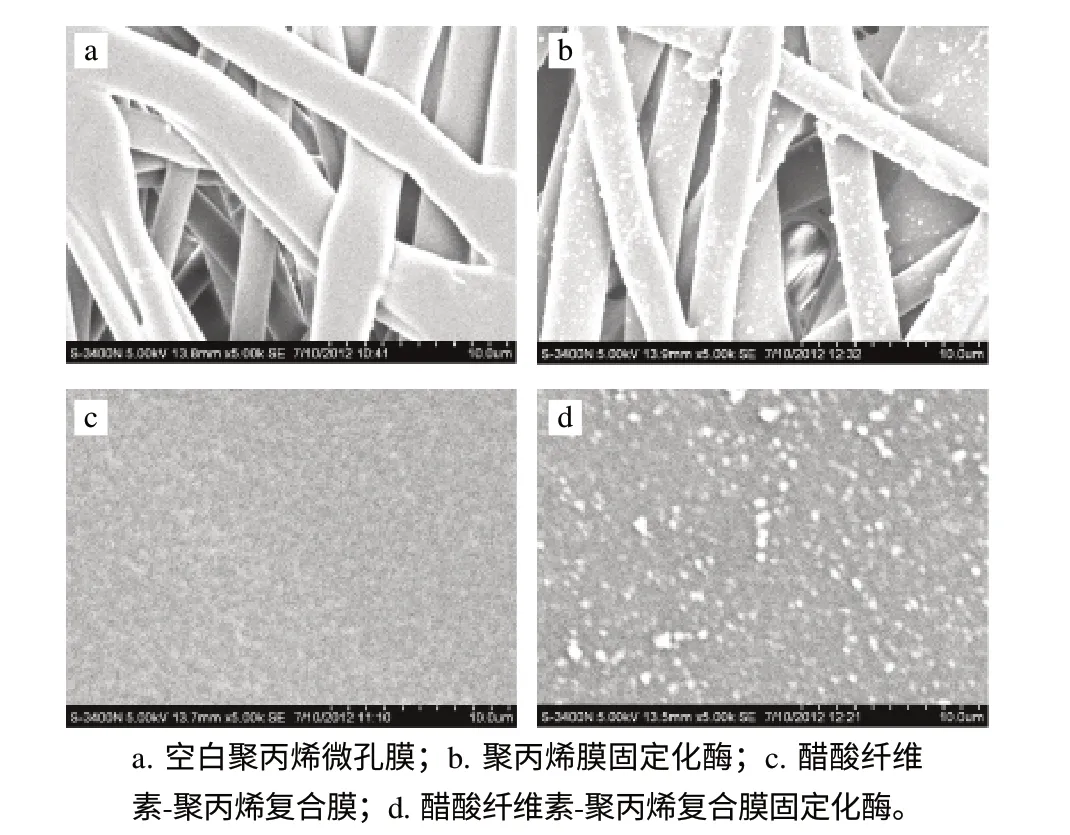
图 7 微孔膜及固定化酶的电镜扫描图Fig.7 Scanning electron microscopic images
图7a中,膜呈纤维状,错乱交叉,排列不规则,但表面平整光滑。图7b显示,固定化后的膜的纤维表面附着一些颗粒或团状的物体而显得有些粗糙,但由于结构松散,膜上固定的酶容易脱落[20]。图7c中,膜表面致密、均匀,利于转谷氨酰胺酶的固定。图7d中,膜表面大部分被酶覆盖,且酶堆积的均匀,表明大部分酶固定在醋酸纤维素-聚丙烯复合膜的界面上,这种结构较利于转谷氨酰胺酶的固定。
3 结 论
通过醋酸纤维素-聚丙烯复合膜对转谷氨酰胺酶进行固定,进行单因素试验确定最佳固定化条件为:酶液质量浓度15mg/mL、吸附时间3h、戊二醛添加量0.3g/100mL、戊二醛交联时间4h。在最佳固定化条件下固定的酶活力可达16.1U/g膜。对固定化酶和游离酶的酶学性质进行比较,得出游离酶最适温度为35~40℃,而固定化酶膜最适温度为45~50℃;游离酶最适pH值为6~7,固定化酶膜最适pH值为5~6,固定化酶比游离酶向酸性偏移。SEM图显示醋酸纤维素-聚丙烯复合膜表面结构有利于转谷氨酰胺酶的固定。
[1] VARGAS M, ALBORS A, CHIRALT A, et al. Characterization ofchitosan- oleic acid composite f ilms[J]. Food Hydrocolloids, 2009,23: 536-547.
[2] ZHONG Yu, SONG Xiaoyong, LI Yunfei. Antimicrobial, physical and mechanical properties of kudzu starch-chitosan composite f ilms as a function of acid solvent types[J]. Carbohydrate Polymers, 2011, 84(1):335-342.
[3] 王爱勤. 甲壳素化学[M]. 北京: 科学出版社, 2008: 42-43.
[4] 吕心泉, 安辛欣. 谷氨酞胺转氨酶在肉制品中的应用研究[J]. 食品工业科技, 2002, 23(4): 86-88.
[5] 梁海燕, 马俪珍. 谷氨酰胺转胺酶在肉制品加工中的应用[J]. 肉类工业, 2004(5): 38-40.
[6] ANDO H, ADACHI M, UMEDA K, et al. Purification and characteristics of a novel transgloutaminase derived from microorganism[J]. Agric Biol Chem, 1989, 53: 2613-2617.
[7] 周楠迪, 陈坚. 谷氨酸胺转胺酶的功能性质及其在食品中的应用方法[J]. 中国食品添加剂, 2000(1): 54-59.
[8] 马永强, 韩春然. 转谷氨酰胺酶交联酶晶体的制备及其酶学性质研究[J]. 食品工业科技, 2011(8): 150-156.
[9] 韩春然, 张娜. 转谷氨酰胺酶交联酶晶体的制备及其结构表征[J].中国食品学报, 2011, 11(4): 42-47.
[10] 刘颖, 王鑫. 磁性壳聚糖固定化转谷氨酰胺酶的研究[J]. 现代食品科技, 2011, 27(9): 1081-1095.
[11] 李鸿玉, 厉重先, 李祖明. 磁性壳聚糖固定化果胶酶的研究[J]. 食品科学, 2008, 29(9): 399-403.
[12] 尹艳红, 王辉. 聚丙烯微孔膜表面接枝聚合丙烯酰胺的改性研究[J].膜科学与技术, 2008, 28(1): 55-59.
[13] 朱建明. 烯丙胺等离子体处理聚丙烯膜的酶固定化[J]. 厦门大学学报, 2007, 46(2): 213-216.
[14] DI M, SITTINGER M, RISBUD M. Chitosan: a versatilebiopolymer for orthopaedic tissue engineering[J]. Biomaterials, 2005, 26: 5983.
[15] MOORE C M, AKERS N L, HILL A D, et al. Improving the environment for immobilized dehydrogenase enzymes by modifying Nafion with tetraalkylammonium bromides[J]. Biomacromolecules,2004, 5: 1241-1247.
[16] KATYAKIN A A, KOTEL'NIKOVA E A, LUKACHOVA L V, et al. Optimal environment for glucose oxidase in perfluorosulfonated ionomer membranes: improvement of first-generation biosensors[J].Anal Chem, 2002, 74: 1597-1603.
[17] 林繁华, 张庆庆, 汤斌, 等. 醋酸纤维素/聚丙烯复合膜固定化脂肪酶的研究[J]. 安徽工程科技学院学报, 2007, 22(3): 16-19.
[18] FOLK J E, COLE P W. Structural reqyurements of specif ic substrates for guinea pig liver transglutaminase[J]. Biol Chem, 1965, 240(7):2951-2960.
[19] ANDO H, ADACHI M, UMEDA K. Purif ication and characteristics of novel transglutaminase derived from microorganisms[J]. Agric Biol Chem, 1989, 53(10): 711-716.
[20] 徐坚, 王玉军, 骆广生, 等. 利用醋酸纤维素/聚四氟乙烯复合膜中的微结构固定化脂肪酶[J]. 化工学报, 2006, 57(10): 2372-2376.

