壳聚糖交联树脂的制备及对Cu(Ⅱ)吸附性能的研究
关桦楠
(哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
近年来,饮用水安全是一个受到广泛关注的食品安全问题,一系列的饮用水污染事件说明我国目前的饮用水还存在许多的安全隐患[1]。伴随着工业“三废”和汽车尾气的大量排放以及农药残留的普遍存在,重金属离子已成为饮用水中常见的污染物,也是饮用水质量衡定的重要指标[2]。如何有效的去除饮用水中的重金属离子污染,对食品安全的改良和人类的健康具有重要意义。壳聚糖是一种天然高分子多糖,无毒,具有良好的生物相容性,分子内的羟基和氨基基团使其具有优良的吸附、交联、螯合及架桥作用,可作为絮凝剂和金属螯合剂处理饮用水中的重金属离子污染,具有显著的环境效益[3-5]。壳聚糖本身为线性高分子材料,会溶解在一些弱酸中,限制了其应用范围。研究表明,通过交联剂修饰的壳聚糖可以增强其抗酸碱及一些化学溶剂的能力,扩大其应用范围[6]。本研究以戊二醛作为交联剂合成新型壳聚糖交联吸附树脂,以Cu(II)作为重金属模型,研究了其对Cu(II)吸附性能和吸附条件,并对交联树脂的结构进行了表征,为饮用水中重金属污染的治理提供理论基础。
1 材料与方法
1.1 材料与仪器
壳聚糖(脱乙酰度85%) 购自于成都科龙化工试剂;冰乙酸和戊二醛 均购自于天津天泰精细化学品公司;硫酸铜 购自于江苏科威公司;其余化学试剂 均为分析纯;水 为Millipore二次去离子水。
UV-1700型可见光分光光度计 日本岛津公司;傅立叶红外光谱仪MAGNA-IR560E.S.P 美国Nicolet公司。
1.2 实验方法
1.2.1 壳聚糖交联树脂的制备 将1.5g壳聚糖置于500mL烧杯中用250mL 2%醋酸溶液使其溶解,用磁力搅拌器以一定速度搅拌混和液,并搅拌至均相,使壳聚糖溶液均匀的分散在液体中,大约需要十分钟时间。取4mL戊二醛滴入烧杯中,以一定速度,恒定温度60℃搅拌1h,期间液体从澄清至浅黄。向烧杯中加入2mol/L的NaOH溶液50mL,以上述速度,恒定温度60℃搅拌30min,在中性或弱碱性条件下,戊二醛的两个醛基与壳聚糖的氨基或乙酰氨基交联,使戊二醛交联壳聚糖完全沉淀。反应结束后冷却至室温,用布氏漏斗在真空条件下抽滤混合液,得到壳聚糖树脂。然后,将壳聚糖树脂用蒸馏水反复洗涤至中性。抽滤除去树脂中的蒸馏水,在60℃下真空干燥得到干燥的壳聚糖树脂(约8h),晾干研磨成粉末后干燥至恒重。采用傅立叶红外光谱仪对壳聚糖交联前后和吸附铜离子前后的结构差异进行表征。
1.2.2 铜离子浓度对吸附性能的影响 将2g硫酸铜粉末溶于100mL蒸馏水中,配制浓度为80、40、16、8、4、2和1g/L的铜离子标准液100mL。静置20min,分别吸取3mL不同浓度标准溶液加入到比色皿中,利用分光光度计在794nm下测试不同浓度铜离子标准液的吸光度值,以蒸馏水为对照。每个样品测定三次,取平均值绘制标准曲线。将若干份0.2g的壳聚糖交联树脂置于烧杯中,分别加入20mL一定浓度的CuSO4去离子水溶液(1、5、10、15、20、30和40g/L),轻微摇晃以确保固体完全浸泡。搅拌1h,然后室温静置2h,反应结束后,吸取3mL上清液,用分光光度计对上清液进行测试,每个样品测定3次,以未加入壳聚糖树脂的CuSO4去离子水溶液为原始溶液对照,采用分光光度计在794nm下测定吸光度,根据铜离子吸光度标准曲线,构建以吸附量为纵坐标,铜离子浓度为横坐标的曲线。计算平衡吸附量,绘制吸附容量随硫酸铜初始浓度变化的Q-Ce曲线。根据下式计算吸附量[7]:
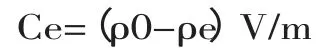
式中:Ce为平衡吸附量(mg/g);ρ0和ρe分别为原溶液和吸附后溶液铜离子浓度(mg/L);V为溶液体积(L);m为交联树脂的质量。
1.2.3 pH对吸附性能的影响 取若干份0.2g的壳聚糖树脂置于烧杯中,分别加入20mL浓度为20g/L的CuSO4去离子水溶液,轻微摇晃以确保固体完全浸泡,调节体系pH为(2.0、2.5、3.0、3.5、4.0、4.5)。搅拌1h,然后室温静置2h,反应结束后,吸取3mL上清液,用分光光度计对上清液进行测试,每个样品测定3次,以未加入壳聚糖树脂的CuSO4去离子水溶液为原始溶液对照,构建以吸附量为纵坐标,pH为横坐标的曲线。计算平衡吸附量,绘制Q-pH曲线。
1.2.4 温度对吸附性能的影响 取若干份0.2g的交联壳聚糖树脂置于室温(大约20℃)、30、40、50、60℃的恒温烧瓶中(水浴加热),分别加入20mL一定浓度的CuSO4溶液,搅拌使固体完全浸泡,水浴2h后,取上清液3mL,每个样品测定3次,以未加入壳聚糖树脂的CuSO4去离子水溶液为原始溶液对照,构建以吸附量为纵坐标,温度为横坐标的曲线。计算吸附容量,绘制吸附容量随温度变化的Q-T曲线。
2 结果与分析
2.1 壳聚糖交联树脂的表征
采用红外光谱仪测定壳聚糖粉末和壳聚糖交联树脂的FTIR光谱,分析它们的结构特点,见图1。以2cm-1速度进行扫描,扫描波长范围为400~4000cm-1。从图1中可以看出,在3352.63cm-1附近是强而宽的氨基的伸缩振动峰,2867.37cm-1附近是脂肪族C-H伸缩振动峰,图中交联壳聚糖树脂在2867.37cm-1处有双峰,这是树脂中“悬垂”醛基的Femi振动峰,说明在某些情况下,有些戊二醛分子中一个醛基与壳聚糖分子中自由氨基反应,而另一个醛基因空间结构不匹配不能与附近氨基反应,成为“悬垂”醛基。在1589.21cm-1处有一个C=N的伸展峰,在1419.22cm-1处有一个-CO2-伸展峰,在1375.00cm-1处有一个OH的弯曲峰,在1022.94cm-1处有C-O伸展峰,而经过交联之后的壳聚糖树脂在1023.43cm-1处出现了一个强峰。该峰是因为C=N基团伸缩振动而产生的,这表明了戊二醛交联剂的羰基基团与壳聚糖的胺基基团发生了Schiff碱反应,证明交联反应成功[8]。同时,在3292.48cm-1处仍含有壳聚糖的特征峰N-H的伸展峰,在2923.23cm-1处仍有壳聚糖CH2的峰[9]。
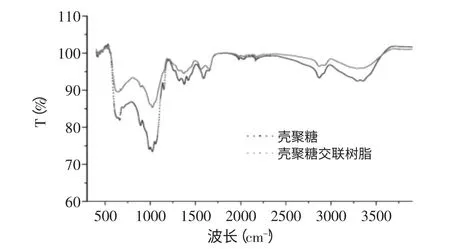
图1 壳聚糖与壳聚糖交联树脂的红外光谱Fig.1 FTIR spectra of chitosan and chitosan resin
2.2 铜离子浓度对吸附量的影响
利用分光光度计在波长794nm条件下测试不同浓度铜离子标准液的吸光度值,以去离子水为对照,绘制铜离子浓度标准曲线。
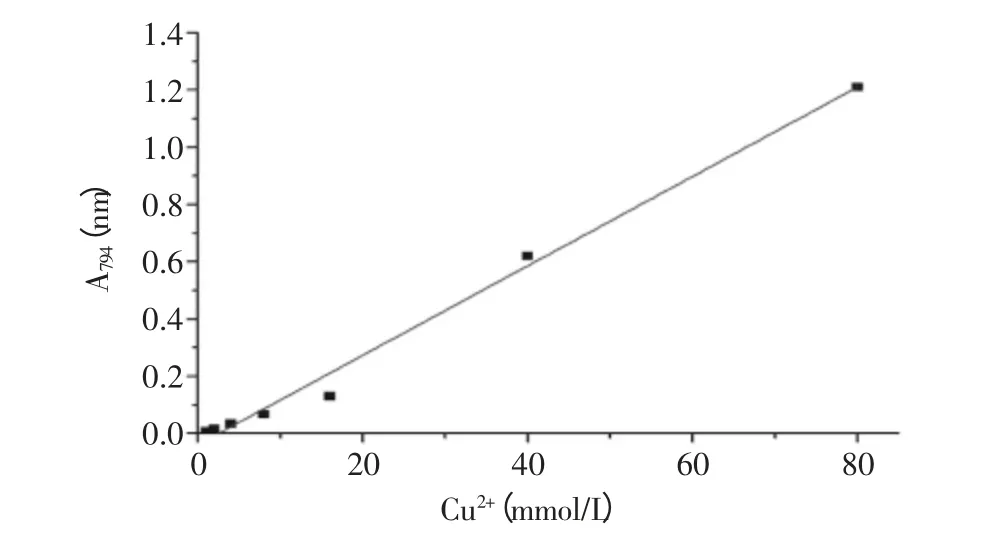
图2 Cu(II)浓度标准曲线Fig.2 Calibration curve of Cu(II)
由图2可知,分光光度计在794nm下铜离子浓度与A值存在明显的线性关系,标准曲线方程为y=0.01561x-0.03848,R2值为0.9906,伴随铜离子浓度的增加吸光度值也随之增大,结果表明该曲线可以用来参与测定壳聚糖树脂对铜离子的吸附量。
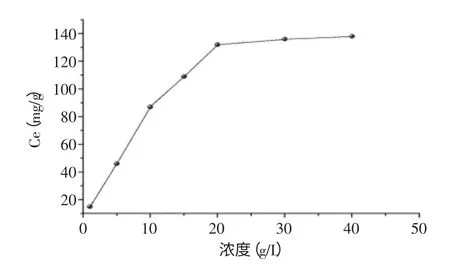
图3 铜离子浓度对交联树脂吸附量的影响Fig.3 Effect of Cu(II)concentration on the adsorption quantity of chitosan resin
实验中,采用相同质量的壳聚糖交联树脂分别溶于不同浓度的铜离子溶液进行吸附,考察铜离子浓度对吸附效果的影响,结果见图3。由图3可知,在一定范围内,壳聚糖树脂的吸附量伴随铜离子浓度的增加而增加,当达到20g/L时,随着铜离子浓度的升高,壳聚糖树脂的吸附量缓慢增加,变化不大。由图3中的曲线可以看出,改变Cu(II)溶液的初始浓度时,树脂对Cu(II)的吸附情况大致相同。初始浓度不同的条件下,达吸附平衡时,壳聚糖树脂对较大浓度Cu(II)溶液的吸附率较大。吸附过程是一个动态过程,达平衡时,其他条件一定时,液相中吸附质的浓度增大,使平衡向着吸附的方向移动[10]。因而,Cu(II)溶液的初始浓度高时,壳聚糖树脂对Cu(II)的平衡吸附率较大[11],综合考虑,选择20g/L吸附实验的最适浓度。
2.3 pH对吸附量的影响
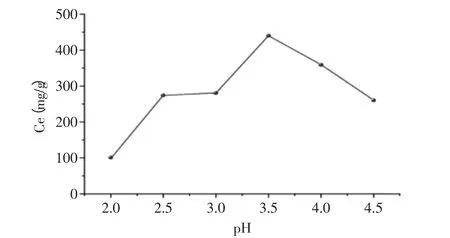
图4 pH对交联树脂吸附量的影响Fig.4 Effect of pH value on the adsorption quantity of chitosan resin
不同的pH条件下,考察pH对吸附量的影响。如图4所示,体系中pH对吸附量的影响较大。当pH在2~3.5时,随着体系pH的升高,壳聚糖交联树脂对铜离子的吸附量呈上升趋势。这是因为随着pH的增大,游离氨基的含量增加,其对铜离子络合能力逐渐提高。当pH>3.5时,吸附量随着体系pH的升高而迅速下降,这是由于碱性pH调节剂易与铜离子发生络合或沉淀等现象,导致吸附能力降低。由此可以确定,吸附过程的最佳pH为3.5。
2.4 温度对吸附量的影响
实验中,采用等质量交联树脂在不同的温度下对相同浓度的铜离子溶液进行吸附实验,考察温度对吸附性能的影响。由图5可知,戊二醛交联后的壳聚糖受温度影响较大,在温度为20~40℃时,平衡吸附量随温度升高而增加,当溶液温度升高时,溶液中离子运动速度随之加快,树脂活性增加,有利于进行吸附重金属离子,因此平衡吸附量增大。壳聚糖与Cu(II)吸附机理包括物理作用和化学吸附,其中化学吸附是通过壳聚糖表面部分-NH2提供孤对电子和金属离子形成了配位键[6]。在70℃之后的温度范围内,吸附量随温度升高而下降,这可能是因为在这一温度范围内树脂对Cu(II)吸附过程是以放热为主,根据吸附平衡理论,温度升高会影响吸附效果。
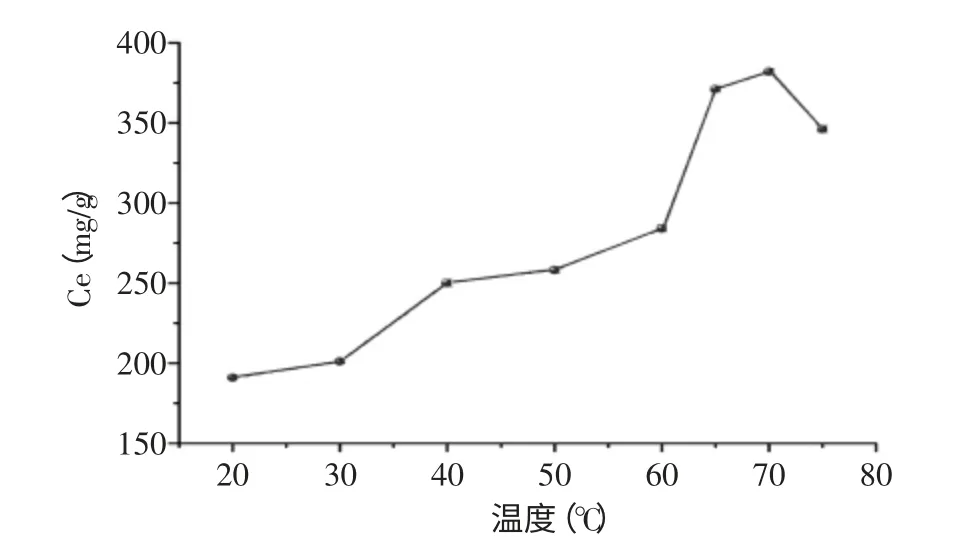
图5 温度对交联树脂吸附量的影响Fig.5 Effect of temperature on the adsorption quantity of chitosan resin
2.5 吸附铜离子前后壳聚糖树脂的结构表征
按照优化后的体系进行铜离子吸附实验,吸附量达到510mg/g并将吸附前后的树脂进行红外光谱比对,结果见图6。
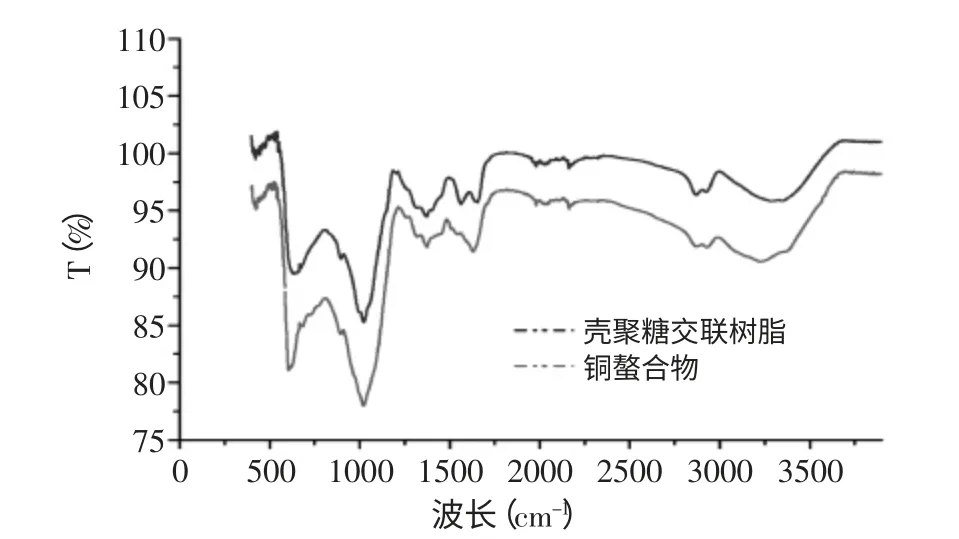
图6 壳聚糖交联树脂与铜螯合物的红外光谱图Fig.6 FTIR spectra of chitosan resin and chitosan resin-Cu(II)
图6中3292.48cm-1处有一个N-H伸展峰在与Cu(II)配合之后,该吸收峰移向低频,出现在3229.65cm-1位置并且变弱;1653.87cm-1处是-CONH的-NH伸缩振动,在螯合铜之后,该吸收峰红移至1628.34cm-1处,螯合铜之后,在606.36cm-1和1628.34cm-1处吸收峰明显较强。在吸附了Cu(II)后的戊二醛交联壳聚糖的红外谱图中,在3292.48cm-1(即N-H伸展峰)处的吸光度明显降低,说明在此处Cu(II)与交联物质发生了络合[12]。此外,在3000~3600cm-1之间的宽峰变窄。同时,1653.87cm-1处左右C=N键的伸缩振动峰都有所减弱,且吸光度也变小,这些变化均可说明壳聚糖树脂与Cu(II)发生了螯合作用;然而,在1000cm-1附近的C-OH位置无明显变化,说明羟基的配位作用不强,这说明Cu(II)主要是与壳聚糖分子上胺基反应。而在606.36cm-1和1628.34cm-1处吸收峰明显较强,可能是Cu(II)与壳聚糖交联树脂的氧原子和氮原子配位后,导致分子内氢键断裂的结果[11]。
3 结论
本文采用戊二醛作为交联剂制备并表征壳聚糖吸附树脂,红外光谱结果表明戊二醛交联剂的羰基基团与壳聚糖的胺基基团发生了Schiff碱反应。以铜离子作为重金属离子模型,探索交联树脂吸附铜离子的最适条件,即0.2g交联树脂在铜离子浓度为20g/L,pH为3.5,体系温度为70℃时吸附效果最好,吸附量达到510mg/g。吸附后的红外光谱表明,螯合铜之后,在606.36cm-1和1628.34cm-1处吸收峰明显较强,说明交联树脂与铜离子发生了螯合反应。
[1] 燕廷,朱定波,马强,等. 饮用水中镉(II)突发性污染监测技术[J]. 食品工业科技,2012,33(17):288-290.
[2] 谷传玲,王俊平,王硕. 饮用水中重金属的暴露评估[J]. 食品工业科技,2011,32(11):374-377.
[3] 王香爱,陈养民,王淑荣,等. 壳聚糖的研究进展及应用[J].应用化工,2007,36(11):1134 -1137.
[4] 李琼,余燕平,王振东. 壳聚糖对废水中铜离子的吸附研究[J]. 工业水处理,2003,23(4):30-32.
[5] 余艺华,孙彦,何炳林. 交联壳聚糖树脂的制备工艺及性能表征[J]. 天津大学学报,2000,33(1):113-117.
[6] 施酶,许文武,孟青,等. 戊二醛改性壳聚糖的制备及其对酚类化合物的吸附性能[J]. 卫生研究,2011,40(6):698-701.
[7] 滕艳华,陆斌,薛长国. 乙二醛交联壳聚糖树脂对Cu(II)吸附研究[J]. 化工新型材料,2011,39:119-121.
[8] 应国清,卢霞,易喻. 壳聚糖吸附剂的制备及性能[J]. 化工进展,2006,26(2):230-233.
[9] 马红梅,朱志良,张荣华,等. 弱碱性环氧阴离子交换树脂去除水中铜的动力学研究[J]. 离子交换与吸附,2006,22(6):519-526.
[10] 陈锐,黄进,叶萌,等. 巯基壳聚糖的合成、表征及其对Cu2+的吸附行为[J]. 应用化工,2011,40(7):1125-1130.
[11] 何炳林,黄文强. 离子交换与吸附树脂[M]. 上海:上海科技教育出版社,1995,109-112.
[12] 魏永锋,张苏敏,杭超伦,等.壳聚糖Cu(II)配合物的合成及吸附性能[J].西北大学学报:自然科学版,2005,35(4):413-415.

