基于非线性优化由近岸水总光谱吸收系数提取浮游植物光谱吸收系数方法研究
刘雪锋,张亭禄
(1.青岛工学院,山东 青岛 266300;2.中国海洋大学,山东 青岛 266003)
浮游植物吸收系数的测量具有重要的实用价值,如海洋初级生产力的估算、赤潮监测和水色卫星遥感模型的建立等。目前,广泛应用的浮游植物吸收系数方法是定量滤膜技术[1-2]。该方法,从海中采集水样,由玻璃纤维滤膜过滤,用分光光度计测量滤膜上颗粒物的吸光度,最后根据比尔定律及经验关系计算得出浮游植物的吸收光谱。很明显,这种测量方法很难实现浮游植物吸收光谱的在线测量。随着光电测量技术的发展,可实现在线测量水体吸收光谱的商品一一被开发出来[3-4],这些仪器可在水下长时间、连续地测量水体总的吸收光谱。如果建立一个有效的数学方法实现从总的吸收光谱中提取出浮游植物的光谱吸收系数,就可实现浮游植物吸收光谱的在线测量。
为此,本文提出了一种非线性优化方法。将浮游植物的吸收光谱分解成几个高斯光谱分布的迭加,经过验证,浮游植物的吸收光谱可以用13个高斯波段来拟合。黄色物质和非浮游植物粒子的吸收光谱都是随波长作指数衰减的,在本文中不给以区分,13个高斯光谱曲线和一个指数曲线一起用来拟合海水总光谱吸收系数,从而得到浮游植物的光谱吸收系数。本文最后将ac-s测量的海水总吸收系数(除去纯水)输入到该算法中,并将输出结果与同站位QFT方法测量的浮游植物吸收系数进行对比,结果表明,本文所用方法简捷快速,反演的准确性较高。
1 方法和数据
1.1 方法
经过大量的现场数据的实验,发现黄色物质和非浮游植物粒子的吸收光谱都符合指数衰减的形式[1,5]。因此,从遥感的角度出发,非浮游植物粒子和黄色物质成份可以一并考虑。Roesler et al.[6]的模型中,没有将二者加以区分,并选择440 nm作为参考波长,本文中,对非浮游植物粒子和黄色物质也不作区分,二者的综合吸收系数可表示为:

式中:adg(440)为adg在440 nm的吸收系数,S 的平均值为0.015 nm-1。因此水体的吸收光谱可以表示为:

在海洋以及许多技术领域中存在大量的共性问题:系统变量比较多,非线性程度很高,把它们完全简化成线性问题来处理是不妥当的。非线性最优化是解决这类问题的一个方法,包含两个研究问题,一是如何用数学模型表示非线性最优化问题,二是如何根据数学模型求出其最优解。Lee et al[7]利用非线性最优化的最小二乘方法成功地反演了研究海域的浅海水深和海水的光学性质。

可以看出,最小二乘法解决非线性问题的过程就是不断调整各个参数,直到模型输出的误差逐渐减少到可接受的程度。
从ac-s吸收衰减仪测量的海水总吸收系数提取出浮游植物的吸收系数,可以称为海洋光学中的逆向问题。该方法首先确定一个模型,然后通过调整作为模型输入的反演参数变量,在本文中,就是调整指数曲线的高度、宽度和高斯曲线高度和宽度,重复计算,尽量最大限度地减少模拟的海水总吸收光谱与测量总吸收光谱之间的误差χ2,当χ2达到设定的域值时,作为输入的反演参数变量就同时被反演出来。
由于浮游植物各种色素吸收光谱相互覆盖和交叉,浮游植物的吸收光谱基本上是连续的,这个特征使得很难估测各种色素的吸收对浮游植物吸收系数的贡献(AGUIRRE-GOMZ[8])。Hoepffner和Sathyendranath[9]用高斯曲线拟和的方法将几种不同藻类的浮游植物吸收光谱进行分解。同样,Stramskiet al[10]也用高斯曲线拟和的方式将浮游植物的吸收光谱aph分解为18个浮游植物吸收成分。
以上理论表明,浮游植物各色素的吸收光谱用高斯曲线来重构是可行的,浮游植物的吸收系数可以表示为浮游植物色素的比吸收系数(specific absorption coefficient,单位浓度的吸收系数)和相应色素的浓度的乘积之和。
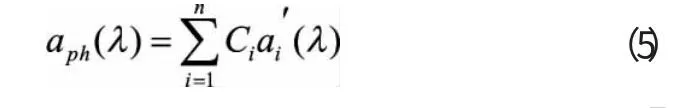
式中:Ci是第i 种色素的浓度;a'i(λ)是第i 种色素的比吸收系数;n 是所有色素的总数目。由式(5)可以看出,我们要利用此表达式得到浮游植物的吸收光谱,不仅需要n 个色素的浓度,还需要它们的比吸收系数。
目前随着技术的发展,叶绿素a和其它辅助叶绿素的浓度可以测量得到,但浮游植物比吸收系数的信息却很少得知。许多科学家在浮游植物比吸收光谱研究方面已开展了大量的工作。Hoepffner和Sathyendranath[9]第一次给出了4种主要色素(叶绿素a,叶绿素b,叶绿素c和类胡萝卜素)“真实”的比吸收系数,结果表明,这种方法成功地将浮游植物的吸收光谱分解为各个色素的高斯曲线吸收光谱,反之,基于各个色素浓度的数据,比吸收系数能够重构浮游植物的吸收光谱。
经过实验,Hoepffner和Sathyendranath[9]选择用13个高斯曲线来拟和浮游植物的吸收光谱(见表1)。
于是,aph(λ)可以表示为:



表1 高斯曲线的参数

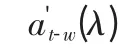
因此,由(7)式可以看出,在理论上,若已知中国近海海水的at-w(λ),就可以用非线性优化的方法得到浮游植物的吸收光谱。
1.2 数据
本文所采用的数据集来源于黄海,包括29个站位。黄海数据的海水总吸收光谱数据(除去纯水)是中国海洋大学海洋遥感研究所2006年4月用ac-s(WETlabs)测量得到的,这部分数据的采样深度在6 m以内。最后,将模型反演的结果与用实验室同步测量得到的浮游植物的吸收系数进行比较。该组数据输入为ac-s数据at-w(λ)。输出结果后与同步测量的aph(λ)进行比较。
由于一些客观情况(比如海面状况、仪器设备的不稳定因素以及人为的因素等)的存在,采集的数据中难免会包含一些噪音,反演结果的准确性就会受到一定的影响,因此,本文首先采用中值滤波方法降低噪声的影响,中值滤波可以有效地去除干扰脉冲信号。
初始值的确定对于最优化法是非常重要的,下面给出初始值的设定,这些初始值与实际测量的真值没有关系。
adg(440)初始值为at-w在440 nm的吸收系数的一半,变化范围在0至at-w在400 nm的吸收系数;Cchlain初始值为1.0 mg/m3,变化范围在0~10 mg/m3;Cchlbin初始值为0.5 mg/m3,变化范围在0~5 mg/m3;Cchlcin初始值为0.5 mg/m3,变化范围在0~5 mg/m3;Ccoratin初始值为0.5 mg/m3,变化范围在0~5 mg/m3;S 初始值为0.015 nm-1,变化范围在0.011~0.021 nm-1[11-12]。
从整个优化过程来看,除了at-w(λ)这一实测值,没有用到任何别的实测值。
2 结果与讨论
为了评价该模型的性能,将由最优化得到的浮游植物各波段的吸收光谱与现场测量结果进行比较。图1中,RMSE表示导出值和实测值的均方根误差,R2表示Pearson相关系数的平方。N 为所用的数据总数。由于数据变化范围比较大,因此坐标轴用对数坐标更加合理。

图1 非线性优化输出结果与实测数据的比较
由图1可以看出,在440 nm和675 nm处,由于浮游植物吸收比较明显,所以在这两个波段的相关性比较高,在其它波段准确性较差;一方面是由于ac-s的测量有误差;另一方面aph(λ)的测量值范围在0~0.2 m-1,adg(λ)的测量范围在0.1~0.97 m-1,后者相对较高,因此会引起较大误差。
该非线性优化模型输出的结果与现场数据产生误差的原因可能有下面几个:
(1)ac-s测量得到的现场数据包含测量误差:ac-s仪器的校正,现场测量的气候,气泡的存在会增大测量误差,以及人为的因素。
(2)当adg(440)与aph(440)的动态变化范围很大或者比值超过10时,aph(440)反演的结果比较差。
(3)表征黄色物质和非浮游植物粒子的光谱形状的参数S 变化比较大时,输出的浮游植物的吸收光谱与实测的吸收光谱会有较大差别。
(4)Hoepffner和Sathyendranath[9]给出的浮游植物比吸收系数会随着海区的不同有所差别,因此建议建立中国海的比吸收系数。另外,它们与各色素的吸收光谱之间不总是线性的关系。
(5)粒子包效应不能得到有效的校正。
3 结论
基于浮游植物各色素的吸收光谱可以用高斯曲线来重构的原理,本文用非线性最优化方法从二类水域的海水总吸收光谱反演浮游植物的吸收光谱。运用现场测量的ac-s数据验证该方法。总体误差在27%以内,因此,该方法需要进一步改进,以提高反演精度。这些结果同时表明该方法可以用于二类水域。
[1]Yentsch CS.Measurement of visiblelight by particulatematter in theocean[J].Limnol Oceanogr,1962,7:207-217.
[2]Kishino M,M Takahashi,N Okami,et al.Estimation of the spectral absorption coefficients of phytoplankton in the sea[J].Bull Mar Sci,1985,37:634-642.
[3]Zaneveld JRV,CMoore,A H Barnard,et al.Correction and Analysis of Spectral Absorption Data taken with the WET Labs ac-s[J].Ocean Optics,2004,17:25-29.
[4]Lerebourg CJ-Y,DAPilgrim,GDLudbrook,et al.Development of apoint sourceinte gratingcavi tyabsortion meter[J].JOpt 2002,4:56-65.
[5]Bricaud A,AMorel,LPrieur.Absorption by dissolved organic matter of thesea(yellowsubstance)in the UVand visibledomains[J].Limnol Oceanogr,1981,26:43-53.
[6]Roesler CS,MJPerry,K L Carder.Modelingin situ phytoplankton absorption fromtotal absorption spectrain productiveinland marinewaters[J].Limnol Oceanogr,1989,34:1510-1523.
[7]Lee ZP,K L Carder,CDMobley,et al.Hyperspectral remotesensing for shallow waters2.Derivingbottomdepths and water propertiesby optimisition[J].Applied Optics.1999,38(18):3831-3843.
[8]Aguirre-Gomez R.Detection of Total Suspended Sediments in the North Sea Using AVHRRand Ship Data[J].International Jornal of Remote Sensing,2000,21(8):1583-1598.
[9]Hoepffner N,SSathyendranath.Effect of pigment composition on absorption properties of phytoplankton[J].Mar Ecol Prog Ser,1997,73:11-23.
[10]Stramski D,A Bricaud,A Morel.Modeling the inherent optical properties of the ocean based on the detailed composition of planktonic community[J].Applied Optics,2001,40:2929-2945.
[11]Carder K L,SK Hawes,K A Baker,et al.Refiectance model for quantifying chlorophyll a in the presence of productivity degradation products[J].J Geophys Res,1991,96:20599-20611.
[12]Carder K L,RGSteward,GRHarvey,et al.Marinehumic and fulvic acids:Their effects on remote sensing of ocean chlorophyll[J].Limnol Oceanogr,1989,34:68-81.

