大鼠非手术人工授精方法的探析
李井春,郭会彦,齐永生,李雁冰,舟桥弘晃
(1.黑龙江八一农垦大学动物科技学院,大庆 163319;2.黑龙江省大庆市银浪牧场;3.日本冈山大学大学院自然科学研究科)
大鼠非手术人工授精法是指通过使用阴道窥视镜及微型输精器将精液注入到大鼠子宫内的过程。实验动物人工授精技术研究的深入开展,不仅克服了传统手术的方法进行人工授精时的不利影响,也为大鼠乃至其他小型实验动物的繁育提供了有力的手段[1]。目前,该项技术在国外已日趋成熟,并得到广泛应用,但在国内还没有关于这种方法的报道。
随着胚胎工程技术的发展,如核移植、精子载体转基因动物生产时,最终要利用胚胎移植、人工授精的技术手段,实现动物的繁殖。采用何种人工授精、胚胎移植的方法至关重要,目前,对于大鼠进行人工授精、胚胎移植常采用手术的方法,但手术的方法存在一定的弊端,如在手术的,如果不当,易发生感染,轻则影响实验的结果,严重导致实验动物的死亡;手术法给实验动物带来痛苦;还有手术法操作复杂,价格较高,而且要求操作者具有一定的外科手术的技术知识;此外,手术方法的人工授精的受胎率并不理想。
大鼠非手术人工授精法针对手术法的不足,首先从动物福利学的角度上,不用手术,所以实验动物没有痛苦;从操作技术角度上,操作简单、易行没有复杂的技术要求,更不需要具有外科手术技术知识;从大鼠生理特点上,输精从子宫颈口插入更接近于自然交配方式,没有创口,就谈不到感染,有利于提高大鼠受胎率,提高实验动物的繁殖效率。
1 大鼠非手术人工授精的方法及技术程序
完整的非手术大鼠人工授精技术包括假孕鼠的制备、精液的准备、精子获能、非手术输精法,胚胎着床点及受胎率的检查等技术。
1.1 假孕母鼠的制备
选用雌性Wister 系大鼠(8~18 周龄),通过阴道分泌物涂片法鉴定大鼠发情状态,在午后6 点左右将处于发情前期的大鼠挑选出来,在20:30~21:00时利用玻璃震动棒诱导假孕,随后用于人工授精。
1.2 大鼠精液的准备
精子的获取和培养。取3月龄以上有繁育能力的雄鼠,颈椎脱臼处死,腹部75%酒精消毒,打开腹腔,取附睾尾。用眼科剪小心将附睾尾周围的脂肪剥离,在灭菌滤纸上去除血迹和脂肪,将剪下的附睾放入预先在培养箱中与平衡的培养液(mKRB 液)中,再用眼科剪在附睾尾上剪6~8 个小口,可见有乳白色精子团涌出,在培养箱中培养3~5 分钟,用穿刺针挑出附睾组织块,使精液充分混合,取10 微升精液,检查精子密度,调整精子浓度,使精子浓度达1.0×107个·mL-1,在培养条件为5%的CO2、95%空气、饱和湿度和37 ℃培养箱中培养1~2 h,使精子获能,待用。
1.3 非手术人工输精方法
1.3.1 非手术人工授精法,包括两步操作:一步利用显微放大观察装置,观察子宫颈口位置,第二步利用微型输精装置插入子宫颈伸入子宫角,输精。所述的显微放大观察装置为检耳镜。通过这种装置观察子宫颈的准确的位置,有利于输精、受精卵器的枪头准确插入子宫颈口。所述的微型输精的装置,包括22 G平口注射针和1 mL 注射器(装置示意图见图1)。
1.3.2 输精方法:使用时,根据大鼠阴道的特点,选择长2~3 cm、内径为3~5 mm 的检耳镜探头,将雌性大鼠吸入式麻醉后,将检耳手术镜探头插入阴道直到观察到子宫颈口的位置,根据子宫颈的特点,分为左右两个子宫角。如果向右侧子宫角输精时,输精的具体操作见图2 和图3,将输精器的尖部顺着子宫颈口插入子宫角中部时,推进输精器内的精液注入子宫角内(输精量每侧子宫角一般为0.1 mL),这样就简单、快速的完成人工授精操作过程。输精后待大鼠苏醒后放到鼠笼中饲养。
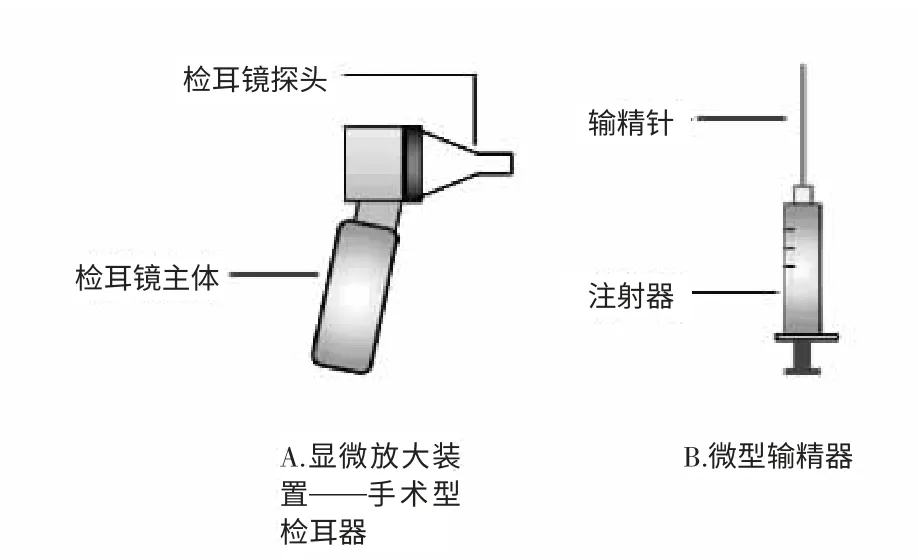
图1 非手术法人工授精利用的装置Fig.1 The device of artificial insemination with non-surgery method
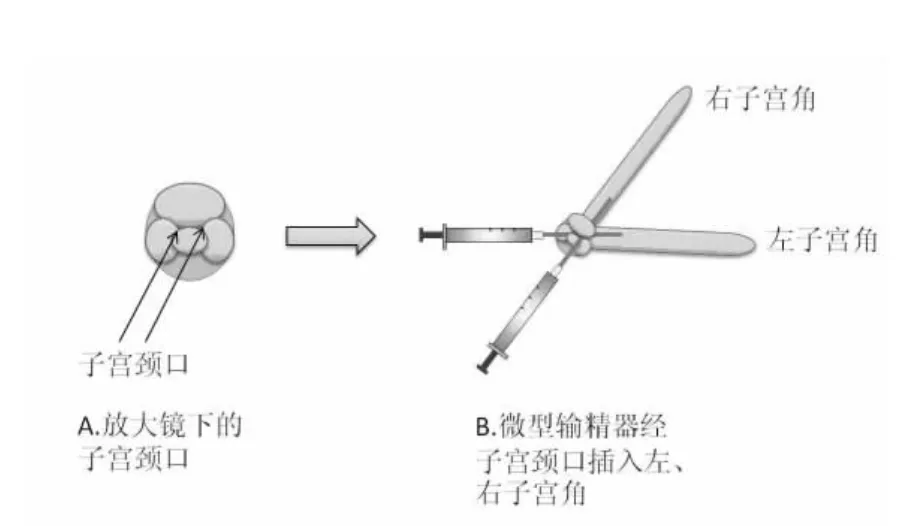
图2 非手术法人工授精过程示意图Fig.2 The sketch map of artificial insemination with non-surgery method

图3 非手术法人工授精的过程图Fig.3 The process map of artificial insemination with non- surgery method
1.4 母鼠胎儿着床点及妊娠率的检查
大鼠的人工授精后如果受孕,大约22 d 后可以剖宫产确认着床痕及胎儿数,计算大鼠人工授精的受胎率和产仔率,此实验方法得到的大鼠的妊娠率为80%左右(24 只妊娠/30 只大鼠)。
2 总结与前景展望
大鼠是仅次于小鼠的重要实验动物,在过去一个世纪中,它一直是首选的啮齿类实验动物,被广泛地用于生物医学研究[2]。大鼠人工授精技术的发展,为各种实验模型动物的生产、胚胎移植、克隆及转基因技术的发展提供基础的技术支持。大鼠非手术法人工授精对于某些突变品系大鼠的繁殖与品种改良有着特别重要的意义,并为受精、着床和胚胎发育等基础理论研究提供了重要的技术手段[4-5]。
此外,有报道称在使用冷冻精液非手术法人工授精时,在输精前2~3 分钟在腹部两侧分别注入1/400IU 的催产素(OXT),然后再进行人工输精,取得较高的分娩率和产仔率[3](注射OXT 的分娩率为58.3%,没有注射OXT 的分娩率为7.7%)。
虽然大鼠非手术人工授精技术尚不够完善,还存在受孕率偏低、单侧子宫角受孕率低等一系列问题[6-7]。随着研究的不断深入,这些问题终究会得到更好的解决,以期为人类实验医学的发展做出更大的贡献。
[1]钱松明,牧佐渭,戴丽军.实验小鼠的人工授精术[J].上海畜牧兽医通讯:实验动物科学专辑,1981,1(1):22-24.
[2]Yasunari Seita,Shuhei Sugio,Junya Ito,et al.Generation of live rats produced by in vitro fertilization using cryopreserved spermatozoa [J].Biology of reproduction,2009,80:503-510.
[3]Nakatsukasa E,Inomata T,Ikeda T,et al.Generation of live rat offspring by intrauterine insemination with epididymal spermatozoa cryopreserved at -196 ℃[J].Reproduction,2001,122:463-467.
[4]张燕林,颜阿林,吴晓云,等.仓鼠用作人工授精动物模型的探索[J].生殖与避孕,1993 ,13(6):467-468.
[5]宋世钧,郑继奎,郑海洪,等.实验用小鼠的人工授精技术研究[J].黑龙江动物繁殖,2000,8(3):4-5.
[6]白琴华.小鼠人工授精的初步研究[J].动物学杂志,1986(4):33-34.
[7]齐艳萍,刘胜军,孙先宇.影响种鹅繁殖性状的主要因素及应对措施[J].黑龙江八一农垦大学学报,2012,24(4):18-20.

