硫化氢对肝硬化大鼠门静脉压力及肝细胞增殖的影响
陈卫刚,郑 勇,张 宁,阎继攀,刘 浩,李 睿,齐翠花,宋丽秀
(1石河子大学医学院第一附属医院,新疆石河子832008;2石河子大学医学院)
内源性硫化氢(H2S)是具有扩张血管、抑制平滑肌细胞增殖和诱导细胞凋亡作用的气体信号分子[1~3]。研究发现,H2S在肝硬化发生过程中起保护性调节作用,但具体机制尚不明确。增殖细胞核抗原(PCNA)是一种仅在增殖细胞中合成和表达的36 kD多肽,PCNA阳性表达说明该细胞处于增殖状态[4]。2009年 1月 ~2011年 12月,我们观察了H2S对肝硬化大鼠门静脉压力及肝细胞增殖的影响,探讨H2S在肝硬化发生过程中的保护性作用机制。
1 材料与方法
1.1 材料 48只雌性SD大鼠均购自新疆维吾尔自治区医学实验动物研究中心。主要试剂及仪器:细胞胱硫醚γ裂解酶(CSE)小鼠抗大鼠多克隆一抗、PCNA兔抗大鼠多克隆一抗均购自abcam公司,二抗检测试剂盒购自北京中杉金桥有限公司;RNA提取试剂TRIzol购自美国Invertrogen公司;M-MLV逆转录酶、Tap酶购自美国mentas公司;PCR引物及内参照GAPDH引物、real time荧光试剂盒由日本takers公司合成。丙基甘氨酸(PPG)购于Sigma公司,其余试剂为国产分析纯。
1.2 实验方法
1.2.1 肝硬化模型制备 将48只大鼠随机分为正常对照组、正常H2S增加组、正常H2S减少组、肝硬化对照组、肝硬化H2S增加组、肝硬化H2S减少组,每组各8只。各肝硬化组采用四氯化碳(CCL4)复合因素法制备肝硬化模型:皮下注射40%CCL4(以棉子油稀释)0.3 mL/100 g体质量(首次剂量0.5 mL/100 g),每隔4天1次;高脂高胆固醇饲料及高脂饲料喂养,饮用水为15%乙醇。各正常组只给予相同剂量的棉子油,采用标准饲养法饲以复合饲料,饮用自来水。结果各肝硬化组均制模成功(肝组织体积缩小,重量减轻,质地变硬,颜色变浅,边缘变钝,表面出现大小不等的结节。正常肝小叶结构破坏,纤维结缔组织增生,假小叶形成)。
1.2.2 内源性H2S干预 造模成功后,肝硬化H2S增加组及正常H2S增加组给予H2S供体硫氢化钠(NaHS)56 μmol/(kg·d)腹腔注射以促进 H2S生成;肝硬化H2S减少组及正常H2S减少组给予同等剂量H2S代谢酶抑制剂PPG 30 mg/(kg·d)腹腔注射以抑制H2S生成;另两组给予0.9%氯化钠注射液l mL腹腔注射。各组均注射7 d。
1.2.3 观察项目 ①门静脉压力:干预7 d后,各组均予乙醚麻醉,固定大鼠后开腹,静脉留置针置于门静脉主干,连接测压装置,测定门静脉压力。②肝组织病理学变化:测定门静脉压力后处死大鼠,观察肝脏大体形态;取一块肝组织置于10%甲醛溶液中固定,石蜡包埋,4 μm厚连续切片,光镜下观察肝组织病理变化。③肝组织CSE及PCNA蛋白表达:采用免疫组化SP法,按SABC试剂盒说明书操作,PBS替代一抗作阴性对照。每张切片于高倍镜下随机选择5个视野,以细胞呈棕黄色为阳性,每个视野记数200个细胞,共计1 000个细胞,计数CSE阳性细胞数。切片的观察和计数均由病理科医生完成。CSE定位于细胞质,PCNA定位于细胞核,阳性细胞可见细胞质或细胞核染为棕褐色或棕黄色。于染色分布均匀区域随机取5个高倍镜视野(400×),计数500个细胞中的阳性细胞数,以平均每100个细胞中的阳性细胞数为标记指数(PI),PI=[阳性细胞/500个细胞]×100%。④CSE及PCNA mRNA表达:采用PCR法检测。取新鲜肝组织一块置于液氮中速冻后转移至-80℃冰箱保存,TRIzol法提取总RNA并以为模板进行逆转录。反应条件为42℃、1 h,92℃、2 min,总反应体系20 μL,所得 cDNA 于 -20 ℃保存。Icycler iQ实时定量PCR仪进行PCR反应,反应条件:95℃预变性10 s;94℃、30 s,60℃ 、30 s,72℃、30 s,其中 CSE 共 40个循环,PCNA 共45个循环,之后分别于83.5℃及91.5℃收集荧光。扩增反应结束后从55℃缓慢加热到95℃(每10 s升高0.5℃),建立PCR产物的融解曲线。根据绘制的梯度稀释DNA标准曲线,由仪器生成各标本目的基因和参照基因的原始循环数。由于目的基因和参照基因扩增效率均接近100%且相互间效率偏差较小,故采用Livak法计算mRNA表达量(CT值)。1.3 统计学方法 采用SPSS17.0统计软件,数据以¯x±s表示,计量资料组间比较采用单因素方差分析,计数资料组间比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 门静脉压力 正常对照组、正常H2S减少组、正常H2S增加组、肝硬化对照组、肝硬化H2S减少组、肝硬化H2S增加组、门静脉压力分别为(9.78±1.12)、(9.16 ± 1.17)、(8.79 ± 1.18)、(14.13 ±0.56)、(15.99 ±1.21)、(13.76 ±1.28)mmHg。肝硬化的三组均高于正常对照组(P均<0.01);肝硬化H2S减少组明显高于肝硬化对照组(P<0.01);肝硬化H2S增加组明显低于肝硬化对照组(P<0.01)。
2.2 CSE及PCNA蛋白表达 见表1。
2.3 CSE及PCNA mRNA表达 见表2。
3 讨论
研究发现,H2S在多系统疾病中均发挥保护性作用,且该作用与其对细胞增殖的调节有关[5,6]。本课题组前期研究表明,H2S不仅具有显著的扩血管效应,还对肝硬化有保护作用,CSE-H2S体系下调是门脉高压症血管结构重建的重要原因之一[7,8]。本研究肝硬化大鼠门静脉压力明显高于正常大鼠,H2S供体增加体内H2S含量后门静脉压力降低;而给予H2S抑制剂后门静脉压力进一步升高,提示H2S可降低门静脉压力,而H2S缺乏则可加重门静脉高压。进一步证实H2S在肝硬化的发生发展过程中具有保护性作用[7~9]。CSE是体内的主要代谢酶之一,主要在肝脏和血管以及非血管平滑肌中表达,通过代谢含硫的氨基酸如半胱氨酸、甲硫氨酸和同型半胱氨酸等生成H2S,我们的前期研究表明,肝硬化大鼠CSE表达明显高于CBS,且肝硬化时H2S/CSE体系下调,而廖家智等[10]则认为肝硬化门脉高压时H2S/CSE体系上调。本研究显示,肝硬化大鼠CSE表达明显降低,表明肝硬化时H2S/CSE体系下调。肝硬化大鼠NaHS干预后CSE表达升高,上调H2S/CSE体系,给予H2S代谢酶抑制剂PPG干预后其表达明显降低,此与课题组前期研究结果一致。再一次证实了肝硬化时大鼠肝组织内H2S/CSE体系下调,而H2S供体可上调H2S/CSE体系,H2S代谢酶抑制剂可下调H2S/CSE体系。
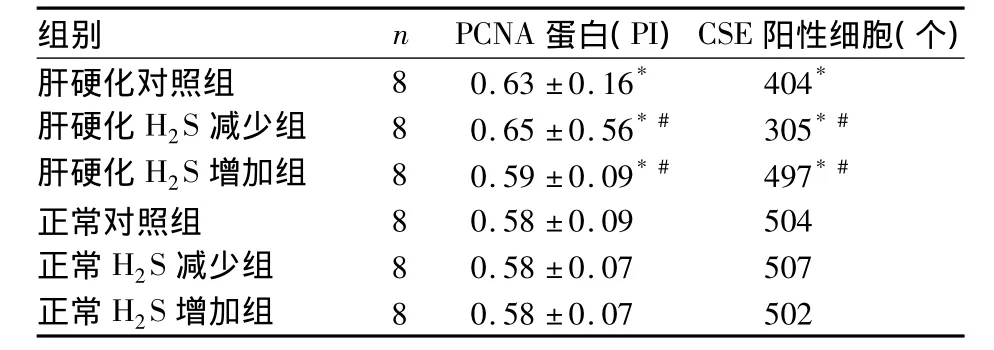
表1 各组PCNA、CSE蛋白表达(¯x±s)
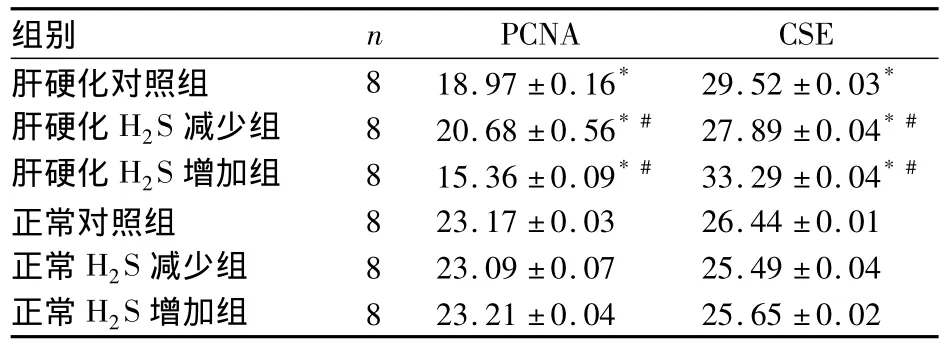
表2 各组 PCNA、CSE mRNA(CT 值,¯x ±s)
各种损伤因素持续作用于肝脏可引起肝星状细胞激活,进而引起细胞外基质生成与降解的失衡,以Ⅰ型和Ⅲ型胶原的生成增多为主要表现。研究表明,外源性H2S可抑制肺动脉平滑肌细胞增生,减少肺动脉组织中Ⅰ型和Ⅲ型胶原蛋白合成,缓解缺氧状态下肺血管结构重建。PCNA是一项评估细胞增殖的指标。本研究发现,肝硬化大鼠给予H2S供体增加体内H2S含量后,肝组织内PCNA表达降低,提示H2S具有抑制肝细胞增殖作用,可致肝星状细胞和肝细胞合成胶原能力降低,进而可引起胶原合成降低、延缓肝硬化的进展;给予H2S代谢酶抑制剂后,肝硬化大鼠肝组织内PCNA表达升高,提示H2S缺乏可促进肝细胞增殖,无论是肝细胞还是肝星状细胞增殖均可引起胶原合成增多,进而加重胶原代谢的紊乱状态,促进肝硬化进展。
肝窦是调节肝脏微循环及门静脉血流量的重要结构,其收缩和扩张影响着肝脏血流量的大小和门静脉压变化[11]。肝硬化发生时,大量胶原蛋白堆积于肝窦,引起窦性门静脉循环受阻,进而引起门静脉压力升高。本研究发现,肝硬化大鼠H2S增加体内H2S含量后门静脉压力降低,而降低H2S后可进一步加重门脉高压,提示H2S可通过调节肝细胞增殖进而影响胶原蛋白生成,调节肝硬化时门静脉的压力,在肝硬化的发生发展过程中对肝脏起保护性作用。
综上所述,气体信号分子H2S在肝硬化发生发展过程中具有保护性作用,其机制与其对肝组织内细胞增殖的调节有关。关于H2S是通过抑制肝细胞还是肝星状细胞发挥作用,或对两种细胞的增殖均有作用,有待进一步研究证实。
[1]Du J,Hui Y,Cheung Y,et al.The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells[J].Heart Vessels,2004,19(2):75-80.
[2]Geng B,Yang J,Qi Y,et al.H2S generated by heart in rats and its effect on cardiac function[J].Biochem Biophys Res Commun,2004,313(2):362-368.
[3]潘际刚,刘新宇,周华.硫化氢对人胚肺成纤维细胞缺氧后增殖活力及细胞凋亡的影响[J].中国药理学通报,2010,26(3):302-304.
[4]赵亮,戴朝六,彭松林,等.双重免疫组化染色检测DLK1与PCNA在肝细胞癌组织中的表达及临床意义[J].山东医药,2012,52(20):54-56.
[5]张宏,李卫国,吴兵,等.体外循环CABG患者血浆硫化氢水平变化及意义[J].山东医药,2012,52(2):74-75.
[6]颜金花,樊海宁,格日力,等.硫化氢在低氧性肺动脉高压发病中的作用[J].生理科学进展,2008,39(4):359-361.
[7]张宁,郑勇,陈卫刚,等.内源性硫化氢在不同时期大鼠肝硬化中的作用[J].世界华人消化杂志,2009,17(3):307-311.
[8]张宁,郑勇,李睿,等.不同时期肝硬化大鼠门静脉血与下腔静脉血中内源性硫化氢的比较[J].石河子大学学报(自然科学版),2009,27(1):51-54.
[9]刘维国,郑勇,李文娟,等.硫化氢对大鼠实验性肝硬化门静脉压力的影响[J].山东医药,2010,50(24):39-40.
[10]廖家智,田德安.门静脉高压大鼠内源性硫化氢体系的变化[J].中华肝脏病杂志,2007,l5(l2):951-952.
[11]张春清,主余华,王京,等.银杏叶提取物对肝硬化大鼠门静脉压及肝窦病理变化的影响[J].中华肝脏病杂志,2007,15(4):245-248.

