解磷、固氮、产吲哚乙酸微生物菌株的筛选及其对植物的促生效果
王奎萍, 郑 颖, 褚光耀, 牛冬冬
(1.南京农业大学植物保护学院,江苏 南京 210095;2.扬州市职业大学园林园艺学院,江苏 扬州 225009)
氮素、磷素是植物生长发育必不可少的元素,农作物的需要量巨大[1]。自然界中氮素的含量虽然极为丰富,但植物一般不能直接利用[2],而磷在土壤中分为无机磷和有机磷,无机磷主要以磷酸三钙的形式存在,溶解性差,难于被植物吸收[3]。吲哚乙酸是一种植物体内普遍存在的内源生长素,属吲哚类化合物,可以显著促进植物的生长发育。
研究发现,土壤中存在着一些微生物,能够将植物难以吸收利用的磷转化为可吸收利用的状态[4],这些微生物称为解磷菌。解磷细菌(PSB)分为2种:解无机磷细菌和解有机磷细菌。解无机磷细菌的主要作用是分解无机磷化物,如磷酸钙、磷灰石等,其作用机理是借助细菌生命活动过程中所产生的酸溶解无机磷;解有机磷细菌的主要作用是分解有机磷化物,如核酸、磷脂等,其作用机理主要是借助于细菌生命活动中所产生的酶分解有机磷。将解磷细菌作为肥料施入土壤,通过其生长代谢可以在作物根际形成一个磷供应较充分的环境,改善作物磷的供应[5],增加作物磷吸收量,提高作物产量[6];另外可以增进土壤肥力、增强植物抗病和抗旱能力[7]。固氮细菌可以将空气中的N2还原为可以被植物吸收利用的NH4,由于共生固氮菌宿主专一,使用范围较窄,而自生固氮菌不受这些因素的限制,生产和使用都很方便。吲哚乙酸(IAA)在植物体内参与了细胞伸长生长、形成层细胞分裂、维管组织分化、叶片和花的脱落等许多生理生化过程的调节与控制,对植物的顶端优势、向性、同化物的运输等也有调节作用。IAA的生理作用主要依赖于其在植物细胞内的合成、代谢,并通过不同的信号传导途径激发各种生理效应[8]。
目前,国内外对解磷、固氮菌和产吲哚乙酸菌的研究涉及诸多方面,但主要集中在菌株的筛选,以及菌株代谢产物的提取、分离、纯化和菌株功能的测定方法上,而解磷、固氮和产吲哚乙酸对植物株高及产量的影响,以及两者之间关系上的报道很少,而且不够系统和充分。本试验选择分离自4种不同生境的菌株,通过大量平板活性测定试验和对不同植物的温室促生试验,寻找解磷、固氮及产吲哚乙酸活性与菌株来源地、温室促生效果三者之间的相互关系,为以后开发固氮、解磷、产吲哚乙酸微生物肥料提供菌株筛选上的理论依据。
1 材料和方法
1.1 菌株、作物品种及培养基
供试菌株:南京农业大学植物保护学院生物源农药研发及农作物疾病绿色防控实验室保存的分别分离自水稻田、辣椒田、番茄田不同生境及庐山土壤的1 539株细菌菌株。供试作物品种:86优8号(水稻)、苏椒五号(辣椒)、上海番茄908(番茄)。
LB培养基(1L):胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,补足水至 1 L,用 1 mol/L NaOH 调节pH值至7.0~7.2;固体培养基:在以上成分基础上加入12 g琼脂粉。分装后1×105Pa灭菌20 min,备用。
蒙金娜无机磷培养基(NPA):葡萄糖 10.0 g、(NH4)2SO40.50 g、NaCl 0.30 g、KCl 0.30 g、MgSO4·7H2O 0.30 g、FeSO4· 7H2O 0.03 g、MnSO4·4H2O 0.03 g、Ca3(PO4)25.00 g、琼脂 18 g,用水定容至1 L,pH 7.0~7.2;蒙金娜有机磷培养基(OPA):葡萄糖 10.0 g、(NH4)2SO40.50 g、NaCl 0.30 g、KCl 0.30g、MgSO4· 7H2O 0.30g、FeSO4·7H2O 0.03 g、MnSO4·4H2O 0.03 g、卵磷脂0.2 g、CaCO31.0 g、酵母粉 0.50 g、琼脂 18 g,用水定容至1 L,pH 7.0 ~7.2[9]。
固氮培养基(NFB):苹果酸5.0 g,MgSO4·7H2O 0.20 g、NaCl 0.10 g、CaCl20.02 g,溴百里香酚蓝溶液 2 ml(0.5%,溶于0.2 mol/L KOH)、维生素溶液1 ml(维生素H 0.1 mg/ml,吡哆醇-HCl 0.2 mg/ml)、微量元素溶液 2 ml(CuSO40.4 g/L、ZnSO4·7H2O 0.12 g/L、H3BO41.4 g/L、Na2MoO4·2H2O 1.0 g/L、MgSO4·H2O 1.5 g/L)、1.64%Fe-EDTA 4 ml、KOH 4.5 g、K2HPO40.5 g、琼脂 15 ~18 g,pH 6.8;无氮培养基(JNFB):苹果酸 5.0 g、MgSO4·7H2O 0.2 g、NaCl 0.1 g、CaCl20.02 g、溴百里香酚蓝溶液2 ml(0.5%,溶于0.2 mol/L KOH)、维生素溶液1 ml(维生素H 0.1 mg/ml、吡哆醇-HCl 0.2 mg/ml)、微量元素溶液2 ml(CuSO40.4 g/L、ZnSO4·7H2O 0.12 g/L、H3BO41.4 g/L、Na2MoO4·2H2O 1.0 g/L、MgSO4·H2O 1.5 g/L)、1.64%Fe-EDTA 4 ml、KOH 4.5 g,K2HPO40.6 g、KH2PO41.8 g,琼脂20 g,pH 5.8[10]。
1.2 解磷固氮及产吲哚乙酸活性的测定
1.2.1 解磷能力测定 将细菌采用点板方法分别接于蒙金娜无机磷培养基(NPA)和蒙金娜有机磷培养基(OPA)上,30℃恒温培养3 d,观察并测定透明圈的大小,以检测磷元素的利用情况。
1.2.2 固氮能力测定 将细菌采用点板方法分别接于固氮培养基(NFB)和无氮培养基(JNFB)上,30℃恒温培养3 d,观察并测定蓝色晕圈的大小,以检测氮元素的利用情况。
1.2.3 产吲哚乙酸活性测定 将细菌以1∶100的比率在1%胰蛋白胨水溶液(pH 7.2~7.6)中扩繁,30℃,180 r/min培养24 h。加入显色液,与对照参比测定红色深度,以检测菌株产吲哚乙酸的活性[11-12]。
1.3 水稻、辣椒、番茄的温室促生试验
水稻、辣椒、番茄种子催芽48 h(25℃)后,分别移入营养土盆钵中,水稻每盆钵移入20棵苗,辣椒和番茄每个盆钵移入10棵苗,每个处理播种2盆。试验时,先将活化的菌株接入含100 ml LB培养液的摇瓶中,30℃,200 r/min培养24 h。将菌液稀释至浓度为1×108CFU/ml,每盆浇入菌液20 ml。40 d后统计植株的地上部分长度、质量和地下部分长度、质量。
1.4 定殖力的测定
1.4.1 Rif50突变体的制备 选取温室试验效果较好的菌株,对其定殖能力进行测定。先活化细菌,挑取单菌落于5 ml LB培养液中摇动培养过夜。吸取100 μl菌液涂布于含有50 mg/ml利福平(Rif)的 LB平板上,30℃培养 1~2 d。挑取 LB平板上的单菌落,纯化,用80%甘油保存。分别提取野生型菌株和突变体菌株的DNA,进行BOXPCR分析,验证突变体菌株与野生型菌株是否为同一菌株。
1.4.2 温室试验 种子消毒:先用70%乙醇浸种1 min;然后用5.25%NaClO浸种10~15 min;最后用无菌水清洗3~4遍。活化突变菌株,于LB+Rif50的培养液中摇动培养过夜。8 000 r/min离心10 min,收集菌体。用无菌水悬浮菌体制备菌悬液,浓度为1×108CFU/ml。把经过消毒的辣椒种子在菌悬液中浸泡30 min,后点播于装有营养土的盆中。根据辣椒生长期,定量检测辣椒的带菌量。于播种后7 d、14 d、21 d、30 d 对菌株的定殖能力进行测定。具体方法为:称取1 g根,将其剪碎后置于研钵中,加入2 ml 0.85%的生理盐水轻轻研磨;静止30 min后吸取0.1 ml研磨液,加入0.9 ml无菌生理盐水,混合均匀并进行梯度稀释;取适当稀释梯度的稀释溶液各100 μl均匀涂布于含有Rif50的LB平板上,30℃培养1~2 d;根据平板上的菌落数,确定细菌在植物根围的定殖情况。并将回收到的菌株与野生型菌株进行BOX-PCR分析。
1.5 大田试验
选取在温室试验中表现良好的菌株在江苏省泗洪县进行大田试验。试验采用随机区组设计,每个处理设2个重复,不同处理间设1个隔离行。采取灌根处理,在辣椒移栽时,每株辣椒浇浓度为1×108CFU/ml的菌液10 ml。45 d后进行田间调查,随即选取200株测定辣椒的株高、质量。
1.6 数据分析
采用Excel 2003和SPSS for Window 13.0软件进行统计分析。
2 结果与分析
2.1 解磷、固氮及产吲哚乙酸菌株的筛选
通过对1 539株分离自番茄田、辣椒田、水稻田和庐山土等4个不同环境的菌株进行解磷能力、固氮能力和产吲哚乙酸活性测定,筛选到了276株细菌菌株。其中,单独具有解磷、固氮及产吲哚乙酸活性的菌株分别有10株、22株及24株;具有解磷和固氮、解磷和产吲哚乙酸以及固氮和产吲哚乙酸活性的菌株分别有17株、36株及46株;同时具有解磷、固氮和产吲哚乙酸3种活性的菌株有121株。根据菌株来源进行分类,来自番茄田的菌株为70株,辣椒田60株,水稻田86株,庐山土60株。
2.2 温室试验结果
对通过平板活性试验筛选出的276株细菌进行水稻、番茄和辣椒上的温室促生试验。通过温室试验,筛选出了具有温室促生效果的菌株134株,其中解磷菌株9株,固氮菌株14株,产吲哚酸菌株14株,解磷+固氮菌株15株,解磷+产吲哚酸菌株20株,固氮+产吲哚酸菌株20株,解磷+固氮+产吲哚酸菌株42株。
2.3 解磷、固氮、产吲哚乙酸与水稻、辣椒、番茄促生效果间相关性分析
如图1~7所示,具有解磷、固氮、产吲哚乙酸活性的菌株,其平板活性与其对植物的促生作用呈正相关,即平板活性越强的菌株,对植物的促生效果越明显,植物生物量的增加越显著。

图1 菌株解磷活性与番茄生物量增加的关系Fig.1 The relationship between phosphorus solubilization of strains and tomato biomass gain
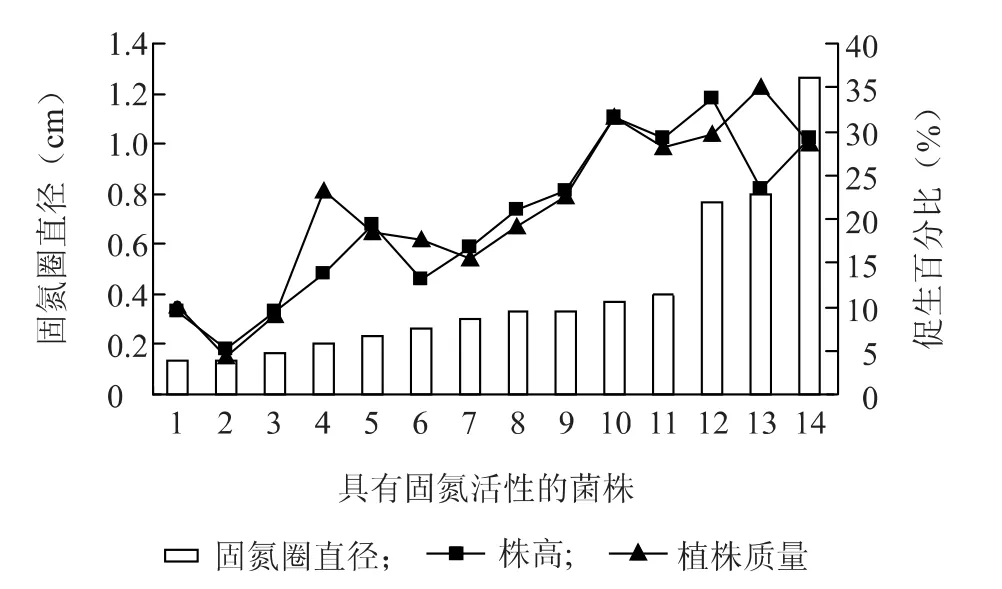
图2 菌株固氮活性与番茄生物量增加的关系Fig.2 The relationship between nitrogen fixation of strains and tomato biomass gain
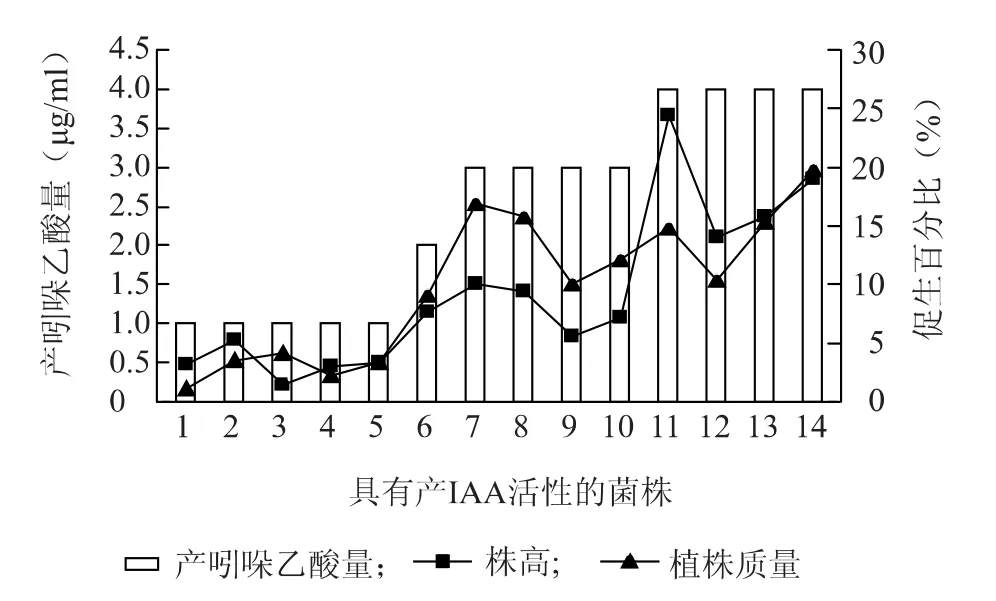
图3 菌株产吲哚乙酸活性与番茄生物量增加的关系Fig.3 The relationship between IAA production of strains and tomato biomass gain
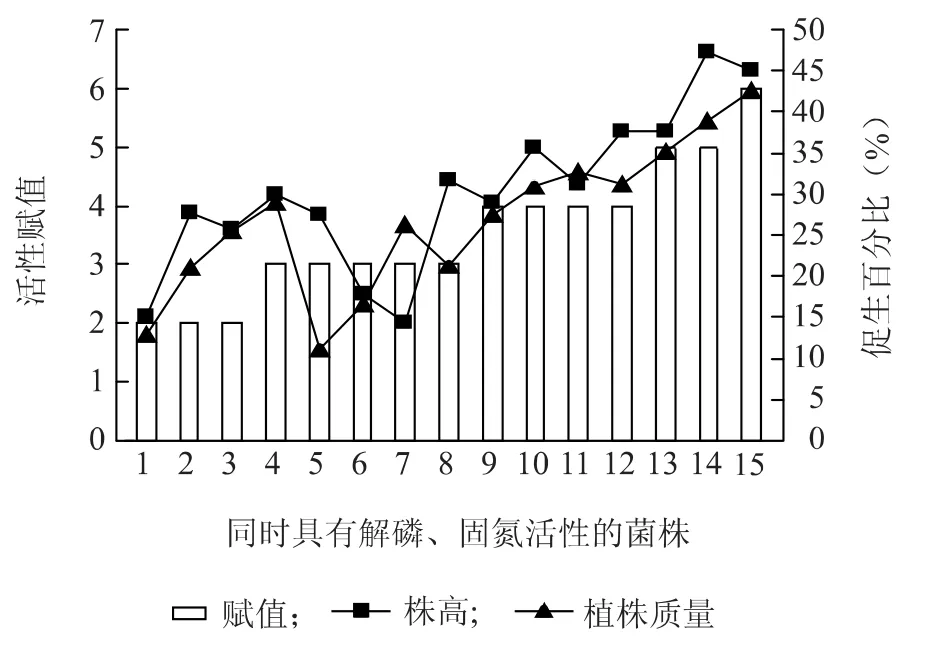
图4 菌株解磷+固氮活性与番茄生物量增加的关系Fig.4 The relationship between phosphorus solubilization +nitrogen fixation of strains and tomato biomass gain

图5 菌株解磷+产吲哚乙酸活性与水稻生物量增加的关系Fig.5 The relationship between phosphorus solubilization+ IAA production of strains and rice biomass gain
根据菌株具有的活性不同对菌株分类后再进行分析,发现同时具有解磷、固氮及产吲哚乙酸活性的菌株对番茄、辣椒和水稻的平均生物量分别增加48.83%、42.80%和17.45%,显著高于只具有1种或2种平板活性菌株的促生效果。在具有2种活性的菌株中,具有解磷+固氮活性的菌株效果最好,对番茄、辣椒和水稻的平均生物量分别增加26.83%、33.83%和8.92%。在只具有1种活性的菌株中,具有解磷和固氮活性的菌株促生能力相当,而具产吲哚乙酸活性的菌株促生效果显著低于前两者,对番茄、辣椒和水稻的平均生物量分别只增加9.90%、8.60%和2.44%(表1)。
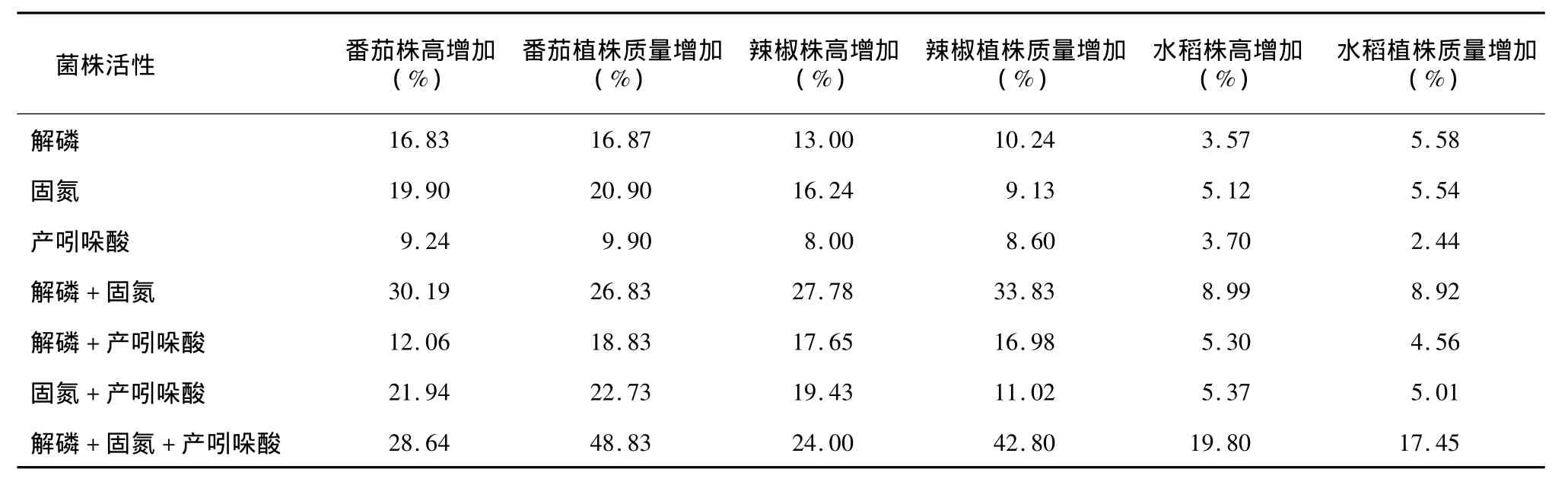
表1 解磷、固氮、产吲哚乙酸菌株对番茄、辣椒、水稻的促生效果Table 1 The promotive effect of the stains with phosphorus solubilization,nitrogen fixation,and IAA production on tomato,pepper and rice
对于同时具有解磷、固氮及产吲哚乙酸3种活性的菌株,对其活性进行赋值,并对赋值与植株生物量增加值进行相关性分析。结果显示,赋值与番茄株高和植株质量增加值的相关系数分别为0.886(P=0)和 0.619(P=0),辣椒分别为0.872(P=0)和0.616(P=0.006),水稻分别为0.726(P=0)和0.539(P=0.028),说明菌株的解磷、固氮及产吲哚乙酸活性与植物生物量的增加存在较强的正相关。
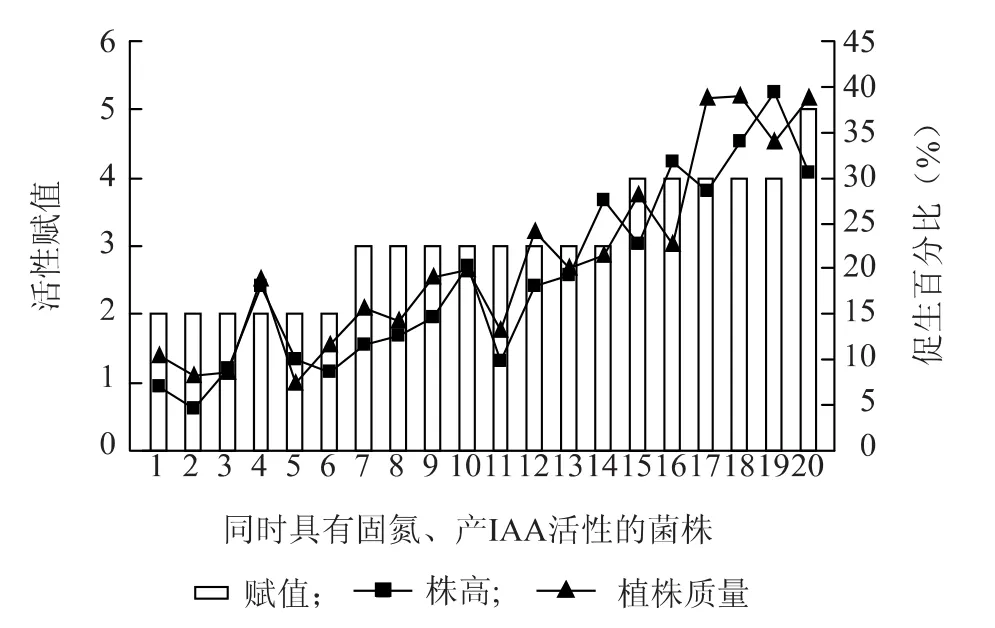
图6 菌株固氮+产吲哚乙酸活性与番茄生物量增加的关系Fig.6 The relationship between nitrogen fixation+IAA production of strains and tomato biomass gain

图7 菌株解磷+固氮+产吲哚乙酸活性与番茄生物量增加的关系Fig.7 The relationship between phosphorus solubilization+nitrogen fixation+IAA production of strains and tomato biomass gain
2.4 不同来源的菌株对水稻、辣椒、番茄促生效果
把具有活性的菌株根据来源地不同进行分类后分析,结果(表2)显示,来自番茄田的菌株对番茄、辣椒和水稻均有较好的促生效果,其次是来自水稻田的菌株。从促生作用与菌株来源相关性看,来自番茄田的菌株对番茄的促生效果最好,番茄株高和植株质量分别增加24.09%和36.92%。来自水稻田的菌株对水稻的促生效果仅次于来自番茄田的菌株,但差异并不显著。而来自辣椒田的菌株对辣椒的促生效果不如来自番茄田、水稻田、庐山土的菌株。

表2 不同菌株来源对作物的促生效果Table 2 The relationship between strains source and plant growth promotion
2.5 优势菌株的定殖力
对在温室试验中表现效果较好的18株菌进行定殖力测定。结果(表3)显示,菌株R112.11在定殖21 d后,仍能在植物根部检测到较高浓度的定殖量,定殖量为2.53×103CFU/g。菌株 12LY027在定殖21 d达到最高值(1.98×103CFU/g)。菌株12LY101在定殖 14 d达到最高值,为1.89×103CFU/g。而菌株12LR73、2SES4、7ZE16并没有表现出定殖能力。刘庆丰等[13]报道枯草芽胞杆菌XF-1对大白菜根肿病具有良好防治效果,其定殖能力较强,接种大白菜60 d后,根围和根表定殖密度仍能稳定在103CFU/g。黎起秦等[14]的研究结果表明枯草芽孢杆菌B47在番茄植株根和茎中定殖量达到104CFU/g的时候,对番茄青枯病的防治效果能够达到79.79%。
2.6 优势菌株对大田辣椒的促生效果
在江苏省泗洪县现代农业示范园进行了18株优势菌株对辣椒促生效果的大田试验。结果(表3)表明,菌株 12LY101、12LY027、R112.11 处理的辣椒苗期生物量显著高于对照,分别增长了57%、37%和31%,株高分别增加了13%、11%和22%。其他菌株对苗期辣椒也有一定的促生效果,但与对照的差异并不显著。

表3 优势菌株的温室定殖力及对大田辣椒的促生效果Table 3 Colonization of dominant strains in greenhouse and their promotions on pepper
3 讨论
目前,国内外对植物根际促生菌的报道较多[15-18]。本试验主要从解磷能力、固氮能力和产IAA能力这3个特性初步说明其促生机理以及它们之间的相关性。
目前研究报道的解磷、固氮微生物主要有细菌、真菌等[19-22]。在试验中我们发现,单独具有产吲哚乙酸活性的菌株其促生能力比具有解磷或固氮活性的菌株低,可能有2个原因:①植物在苗期的生长,需要大量的氮、磷,因此解磷、固氮作用就比产吲哚乙酸更重要;②吲哚乙酸作为一种植物生长激素,它对植物的作用需要一定的浓度,浓度太低则促生作用不明显,浓度太高则抑制植物生长[23]。而本试验中只是对吲哚乙酸进行了定性分析,没有做定量测定,不知道其浓度是否适当。已有研究结果表明固氮菌也具有一定的溶磷能力[24],植物根际促生菌同时具有溶磷和固氮能力,可显著改善水稻幼苗生长期的氮素和磷素营养[25],从而达到促进水稻幼苗生长的效果。
综合分析各菌株对番茄、辣椒和水稻的促生效果,发现菌株对水稻的促生效果显著低于其他2种作物,这可能与水稻的生长习性有关。番茄和辣椒都是茄科作物,生长习性相似,促生效果也相当。而水稻作为水田生长的植物,其根围是厌氧环境,而我们使用的菌株大都为需氧细菌,不适宜在厌氧环境下生长。另外,水稻生长所需的营养元素及比例也与番茄、辣椒有所不同。
生防菌株能否在寄主植物根围以及其他生境稳定定殖是其发挥生防能力的关键因素[26-28]。从对植物定殖能力的试验结果来看,菌株 R112.11、12LY027和12LY101均表现出较好的植物根围定殖力,而在大田试验中,这些菌株表现出很好的促生效果。这说明菌株的定殖能力也应该是影响其对植物作用的一个因素[14]。Bull等[29]证明生防菌株 2-79的定殖量与寄主植物病斑数成反比,定殖量越大病斑数量越小,当根部定殖量达到1×107~1×108CFU/cm时,几乎不产生任何病斑。平板试验中表现优良的菌株若没有较好的定殖力,在大田试验中也无法发挥其潜力。因此,我们在进行菌株筛选时,除了考虑主要活性,还要对菌株的其他性状进行综合分析。本试验通过对不同土壤环境的细菌菌株进行解磷、固氮、产吲哚乙酸活性的分析,评价其在植物促生过中的作用,初步揭示了这些菌株的促生机理,可为以后研制生物肥料提供参考。
[1]冯月红,姚 拓,龙瑞军.土壤解磷菌研究进展[J].草原与草坪,2003,100(1):3-5.
[2]孟 瑶,徐凤花,孟庆有,等.中国微生物肥料研究及应用进展[J].土壤肥料科学,2008,124(6):276-283.
[3]姜成林,徐丽华.微生物资源学[M].北京:科学出版社,1997:151.
[4]覃丽金,王真辉,陈秋波.根际解磷微生物研究进展[J].华南热带农业大学学报,2006,12(2):44-49.
[5]陈廷伟.微生物对不溶性无机磷化合物的分解能力及其接种效果[J].微生物,1995,2(5):210-215.
[6]蔡 磊,李文鹏,张克勤.高效解磷菌株的分离、筛选及其对小麦苗期生长的促进作用研究[J].土壤通报,2002,33(1):44-46.
[7]梁利宝,谢英荷,胡建华.土著微生物对解磷微生物解磷效果影响的研究[J].山西农业大学学报,2006,26(2):155-158.
[8]苑博华,廖祥儒,郑晓洁,等.吲哚乙酸在植物细胞中的代谢及其作用[J].生物学通报,2005(4):21-23.
[9]林启美,赵小蓉,孙焱鑫,等.四种不同生态系统的土壤解磷细菌数量及种群分布[J].土壤与环境,2000,9(1):34-37.
[10]KIRCHHOF G,REIS V M,BALDANI J I,et al.Occurrence,physiological and molecular analysis of endophytic diazotrophic bacteria in gramineous energy plants[J].Plant and Soil,1997,194:45-55.
[11]李酋开.土壤农业化学常规分析方法[M].北京:科学出版社,1984:272-278.
[12]周德庆.微生物学教程[M].2版.北京:高等教育出版社,2002.
[13]刘庆丰,熊国如,毛自朝,等.枯草芽胞杆菌XF-1的根围定殖能力分析[J].植物保护学报,2012,39(5):425-430.
[14]黎起秦,罗 宽,林 纬,等.内生菌B47的定殖能力及其对番茄青枯病的防治作用[J].植物保护学报,2006,33(4):363-3691.
[15]王春娟,郭亚辉,王 超,等.根围促生细菌(PGPR)蜡质芽胞杆菌AR156对番茄的诱导耐旱性研究[J].农业生物技术学报,2012,20(10):1097-1105.
[16]梁建根,施跃峰,竺利红.植物根围促生细菌作用机制的研究[J].现代农业科技,2008,17:133-135.
[17]NIU D D,LIU H X,JIANG C H,et al.The plant growth-promoting rhizobacterium bacillus cereus AR156 induces systemic resistance in arabidopsis thaliana by simultaneously activating salicylateand jasmonate/ethylene-dependent signaling pathways[J].Molecular Plant Microbe Interactions,2011,24:533-542.
[18]LUCY M,REED E,GLICK B R.Applications of free living plant growth-promoting rhizobacteria[J].Antonie van Leeuwenhoek,2004,86:1-25.
[19]席琳乔,冯瑞章.植物根际解磷菌的研究进展[J].塔里木大学学报,2006,18(4):57-61.
[20]覃丽金,王真辉,陈秋波.根际解磷微生物研究进展[J].华南热带农业大学学报,2006,12(2):44-49.
[21]马春浩.解磷微生物及其应用研究综述[J].安徽农业通报,2007,13(4):34-36.
[22]丘元盛,周淑萍,莫小真.粪产碱菌A215和阴沟杆菌E226的固氮特性[J].微生物学报,1981,21(4):473-476.
[23]吴 瑛,席琳乔.燕麦根际固氮菌分泌IAA的动态变化研究[J].安徽农业科学,2007,35(15):4424-4425.
[24]尹瑞龄.自生固氮菌的溶磷作用[J].土壤,1990,22(5):251-253.
[25]王伟妮,李小坤,鲁剑巍,等.氮磷钾配合施用对水稻养分吸收、积累与分配的影响[J].华中农业大学学报,2010,29(6):710-714.
[26]陈 亮,周晓见,董昆明,等.1株烟草青枯病生防细菌的分离与鉴定[J].江苏农业科学,2012,40(1):104-107.
[27]王 剑,王 楠,高观朋,等.黄瓜黑星病拮抗菌抑菌谱及产芽孢培养工艺研究[J].江苏农业科学,2011,39(2):181-184.
[28]毛雪琴,魏彩燕,柴荣耀,等.生防菌株MT-06对草莓炭疽病的防效及定殖力测定[J].江苏农业科学,2011,39(2):193-194,281.
[29]BULL C T,WELLER D M,THOMASHOW L S.Relationship between root colonization and suppression of Gaeumannomyces graminis var.tritici by pseudomonas fluorescens strain 2-79[J].Phytopathol,1991,81:954-959.
——固氮微生物

