Sonogashira偶联反应的过渡金属催化剂研究进展
阚文涛,胡 睿,钟正坤
(中国工程物理研究院核物理与化学研究所,四川 绵阳621900)
Sonogashira 交叉偶联反应( sonogashira cross-coupling reaction)最早由Heck[1]和Cassar[2]在1975年分别报道。同年,Sonogashira 等[3]在此基础上作了进一步详细研究,最终发现向反应体系中加入亚铜盐可以有效提高反应产率而命名。该反应被广泛地应用于天然产物、生物活性分子、非线性光学材料、分子电极以及聚合材料的合成[4],如式(1)所示,其实质是一个末端炔烃与芳(烯)基卤化物之间的sp-sp2 碳交叉偶联反应,是形成新的C—C 键的最有效方法之一。

式中,R1为芳基、杂芳基、乙烯基;R2为芳基,杂芳基、烯基、烷基、SiR3;X 为I、Br、Cl、OTf。
鉴于传统的Sonogashira 偶联反应存在两个明显的不足,人们为此不断对其进行工艺上的改进。这两个不足点是:①以铜/钯双金属体系作为催化剂不仅反应条件较为苛刻(如要求严格除氧除水等)、产率偏低,贵金属钯的使用还造成制备成本高昂,使工业化受到限制;②从反应的环境友好性方面看,传统的Sonogashira 反应体系中多采用全有机体系(这些体系中使用的溶剂甚至包括有毒有害的胺、苯以及甲苯等),这将直接对环境以及人员的健康造成危害,与绿色化学理念明显违背。因此,该领域的研究者们一方面从过渡金属催化剂在若干偶联反应中发挥的作用出发,不断探索能用于Sonogashira交叉偶联反应且比传统的钯催化体系价廉易得的过渡金属催化剂;另一方面,为了使整个反应趋于绿色化,也在含钯催化剂上进行着不懈的改良工作,目的在于用含水体系(甚至全水体系)替代原有的全有机溶剂体系,从而实现反应的温和化。本文将对近年来人们致力于这两方面催化剂(或催化体系)的研究进展予以综述。
1 钯催化Sonogashira 反应的绿色化
以水作为钯催化的Sonogashira 反应的溶剂具有积极的作用,因在水相中该反应的反应条件温和,具有良好的安全性,并且以此种形式进行的反应活性较高,产物易于分离,且反应后催化剂可以循环多次使用[5]。水及有机溶剂的混合溶剂也被较多地应用到上述方面,目前,水溶性催化剂的研制与投入使用已经使完全意义上的Sonogashira 水相反应成为现实。同时向水中加入相转移催化剂或表面活性剂可以使反应在均相条件下进行,有利于提高反应的产率[6]。
1.1 聚合物负载的Pb 催化剂
均相催化剂因其可溶于反应体系而具有良好的催化活性,但当结束反应后难以与反应产物彻底分离,随着研究者们对反应条件、经济效益以及反应绿色化方面的要求不断提高,聚合物负载的钯催化剂展现出较多优势,诸如反应条件温和、易于操作、使用绿色的溶剂和碱、产物容易分离、循环使用催化剂可以减少贵重金属的损失等。
Wang 等[7]在水溶液中以P(DVB-IL)-Pd 为催化剂,催化芳香碘与端基炔的Sonogashira 反应,所得产物的产率较高。该催化剂不仅解决了均相钯催化剂的恢复以及重新利用的问题,避免了使用有毒性的磷烷配体,同时也填补了以含离子液体聚合物支撑的钯催化剂催化羰基化反应的缺失。He 等[8]在聚合物负载的大环希夫钯配合物上研究端基炔与卤代烃的非均相Sonogashira 偶联反应,研究发现,于反应溶剂水中加入哌啶后反应顺利进行,该催化剂可以在无铜条件下催化完成反应,获得较高产率,并且重复利用5 次后无催化活性的丧失。在水相中良好的催化表现以及该催化剂易制取、易分离等特性使其成为良好的多相催化体系,并且可以成为其它多相体系钯催化剂的替代品。Suzuka 等[9]以两性树脂(PS-PEG)负载的钯与磷烃的配合物作为催化剂催化芳卤与端基炔的Sonogashira 偶联反应,反应产率较高,并且该催化剂可以通过简单的过滤回收,在经过4 次过滤后其催化活性没有减少。Ye 等[10]以[Pd(OPf)2]对阿尔伯特试剂A-21(离子交换树脂)进行处理,得到了钯质量分数为1.94%的试剂,聚合物负载的氟化钯催化剂在无铜、无配体及氧气气氛下催化Sonogashira 反应,该催化剂易于从产物中分离,并且在使用多次后不会有活性的明显损失,见式(2)。Bakherad 等[11]以水溶性的树脂与钯的复合物为催化剂,在无铜、充气条件下,在水溶剂中催化芳化碘与端基炔的Sonogashira 偶联反应。对于有些难溶于常用的有机溶剂的物质之间的反应,比如肽与炔基配体之间的反应,反应物在所选溶剂中的溶解性较差会对反应产生不利影响,开发在水中具有良好溶解性的催化剂可以使反应在水溶剂中顺利进行。

1.2 新型含Pb 配合物催化剂
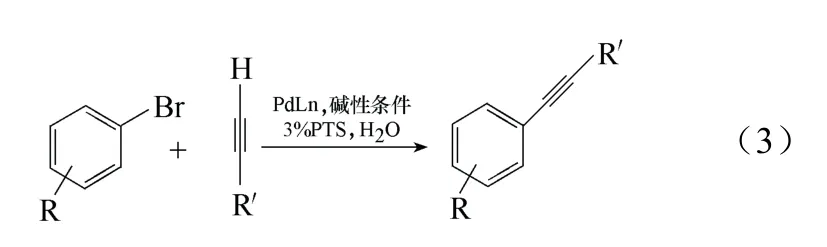
为了使反应体系变得更温和,人们开发了一些新的含钯配合物作为Sonogashira 偶联反应催化剂。如Bakherad 等[11]在有机胺与水的混合溶液中以PbCl2(pph3)2为催化剂,在室温下便完成了端基炔烃与碘代芳烃的Sonogashira 偶联反应,见式(3)。当在体系中使用PTS(高分子阳离子聚合物)时,也可以在室温下完成溴代物的偶联反应[12]。Lee 等[13]以能够快速合成的、水溶性的催化剂,Pd(II)与吡啶基的含氮配体所形成的配合物在比较低的催化载量下,当温度升高至50~70 ℃时,不同的芳氯与芳溴可以高效率地与苯乙炔发生Sonogashira 反应,在有些情况下甚至可以在室温下反应,该催化剂不仅在温和条件下有效,在充气、部分水溶液以及无磷的介质中也有效。
1.3 Pb/C 催化剂
Pd/C 作为Sonogashira 反应中的新型催化剂,最初是以PPh3作为共催化剂出现的。当时,Bakherad等[14]在采用碳酸钾为碱、纯水为溶剂的条件下,采用Pd/C 和PPh3同时作为催化剂,考察了芳基碘代物与炔的Sonogashira 偶联反应,结果显示,95 ℃下收率可达94%。随后,有研究者为了在水溶液中实现碘代苯与苯乙炔之间的Sonogashira 偶联反应,见式(4)。重点考察了在添加有不同表面活性剂的体系中Pd/C 的催化性能[15]。研究发现,在只含阳离子表面活性剂的体系中反应能够顺利进行,当体系中含阴离子表面活性剂时,则不能发生反应,究其原因,可能是不同类别的表面活性剂在提高反应的速率以及反应的选择性方面发挥作用的缘故。并且,其所采用的合成工艺中并未使用其它配体,也未用到常见的共催化剂亚铜盐,甚至未对体系的空气等气氛严格排除,可见很大程度上在制备条件方面比传统制备方法温和、绿色化。作者选用活性炭作为金属钯的载体,原因在于单组分的钯催化剂难以分离,经常会残留在产物中,采用多组分的钯催化剂则可以克服这一缺点。因此作者认为,以Pd/C催化剂在水相中催化Sonogashira 反应更符合当今社会对制备工业绿色化的需求,极具工业化应用前景。

1.4 PbCl2 作为催化剂
钯盐也常常应用在Sonogashira 偶联反应中,其中应用较多的是PbCl2。Liang 等[16]使用吡咯为碱,水为溶剂,以PdCl2催化了炔与芳香族碘代物的Sonogashira 偶联反应,见式(5)。Cai 等[17]以含有PdCl2及NaOH 的水包油微乳液作为催化剂,在无铜,无配体的条件下催化芳卤与苯乙炔的Sonogashira 偶联反应,反应在5 min 之内可得到较高产率,反应速率随着微乳液体系中水相含量的增加而有所提高,并且分散的钯微球能够在无其它反应物的情况下在内部形成。鉴于在微乳液催化的碳碳键的连接反应非常稀缺,微乳液可以成为更加廉价的,而且更能解决经济性与环保方面问题的普遍适用性方案。该课题组的研究同时发现,季铵盐在体系中对该反应的催化效果比阳离子或阴离子的催化剂更加有效,非离子表面活性剂的EO 值,表面活性剂的浓度,醇的链长度,温度均对反应有影响,对含有纳米级钯的催化剂的研究将成为很有前景的领域[18]。Guan 等[19]在水溶液中以PdCl2/PPh3为催化剂,在哌啶与无铜条件下于水溶液中催化端基溴与芳基炔的反应,反应温度在120 ℃时产率较高。

1.5 Pd(PPh3)4 催化剂
Pd(PPh3)4催化剂其实并不能算作最近几年发展起来的新型催化剂。但一些研究者将其使用条件略加修改,就获得了一些喜人的结果。其中,最典型的改进是Carlos 等[20]选用40%的四丁基氢氧胺的水溶液作为体系用碱,结果发现,在短短10 min 内,在Pd(PPh3)4与CuI(5%∶10%的摩尔百分含量比)的催化体系下,通过发生Sonogashira 交叉偶联反应就将(E)-1-碘代乙烯基-1-四丁基锡与末端炔烃链接了起来。此外,他们在40%的四丁基氢氧胺的水溶液条件下,还考察了不同溶剂体系在相同反应时间内对产率的影响,结果显示,以2∶3 的体积比配制的四氢呋喃与甲醇的溶剂缓慢滴加催化剂(5 min),最高可获得84%的收率。本文作者认为,采用四丁基氢氧胺比其它碱更快捷地完成合成的原因可能是其碱性相对更强,更容易形成相转移催化剂的缘故。此外,Bhattacharya 等[21]也对Pd(PPh3)4催化剂在Sonogashira 偶联反应中的使用条件进行了改良,见式(6)。在无添加剂、无相转移催化剂的条件下,以摩尔分数为0.5% 的Pd(PPh3)4为催化剂,在纯水中于70 ℃下仅30 min 就完成了芳基卤的炔基化反应,且该反应产率高达92%;实验还发现,降低反应温度和添加有机溶剂(如按9∶1 添加二甲基甲酰胺)都将对产率起衰减作用,如在室温下反应,需要耗时2.5 h 才能获取约92%的产率。由此可见,诸如Pd(PPh3)4这类发展历史较悠久的催化剂,只要运用合适,仍然可以在绿色化学这一现代主潮流中发挥良好作用。

2 其它过渡金属催化的Sonogashira交叉偶联反应
传统的Sonogashira 偶联反应存在反应条件苛刻、产率偏低以及使用的含钯催化剂价格昂贵等诸多不足,促使人们去探索新的可以替代传统钯催化体系的价廉易得的催化剂。并且,多种多样的过渡金属催化剂在Kumada、Suzuki、Stille 以及Negishi偶联反应中发挥着举足轻重的作用,因此在此基础上,一些应用在Sonogashira 交叉偶联反应方面的非钯类的过渡金属催化剂得以发展。
2.1 铁催化的Sonogashira 偶联反应
Volla 等[22]于2008年以铜铁共催化实现Sonogashira 交叉偶联反应,见式(7)。研究发现,更好实现Sonogashira 交叉偶联反应的条件是以0.1当量的Fe(acac)3及碘化亚铜作为催化剂,并在140℃下以N-甲基吡咯烷酮为溶剂,反应中铜铁两种金属催化剂缺一不可,反应的底物兼容性良好,反应中炔烃可以是芳基炔烃或烷基炔烃,卤代物中的给电子基团或吸电子基团均不会影响反应的产率,但只有碘代物可作为卤源,溴代物和氯代物均无法参加反应。在同年Mao 等[23]使用铜铁共催化Sonogashira 交叉偶联反应,以二甲基亚砜作溶剂,磷酸钾作碱,研究发现溴代物可以参与到反应中来,并且可以得到可观的产率。Huang 等[24]在使用铜铁催化剂的同时添加了TMEDA 作为配体,反应中使用Fe2O3的当量为0.1,Cu(acac)2的当量为0.1,配体TMEDA 的当量为0.2,以二甲基甲酰胺为溶剂,反应底物的兼容性良好,芳基碘代物及一些杂环碘代物可以作为碘代物,炔烃可以扩展到烷基炔烃。而Carril 等[25]于2008年在研究中发现,只使用铁作为催化剂就可以完成Sonogashira 交叉偶联反应,同时发现催化剂与配体的匹配非常重要,换用其它配体时发现反应无法正常进行。

2.2 镍催化的Sonogashira 偶联反应
Wang 等[26]报道了以零价镍为催化剂,以氢氧化钾为碱,异丙醇为溶剂,在其中加入配体三苯基磷,当量为0.05 的碘化亚铜在温和的温度下发生的Sonogashira 偶联反应,见式(8)。研究发现该反应的底物具有良好的兼容性,溴代物也可以发生反应,并且溶剂在反应中的作用较大,同时该反应对催化剂提出了较高的要求,只有直径为100 nm 的镍粒子才可作为最佳的催化剂。2009年,Vechorkin 等[27]使用二价镍催化炔烃与不活泼的含β-H 烷基卤代物之间的偶联,反应以碘化亚铜作为催化剂,研究发现卤代底物中溴代及氯代物均可以兼容,当卤代底物为溴代物时需加入碘化钠作为添加剂,而当氯代物参加反应时需加入四丁基碘化铵作为添加剂。

2.3 铑催化的Sonogashira 偶联反应
近年来,文献陆续报道了有关纳米金属催化剂[4,28],这种催化剂也在Sonogashira 偶联反应中被尝试使用。Kanuru 等[29]将铑纳米粒子负载在固体载体上,作为催化剂来催化苯乙炔与碘苯之间的偶联反应,以四丁基醋酸胺作为碱,成功地实现了在载体表面进行的偶联反应,见式(9)。研究发现,当体系中没有碱加入时,铑粒径的大小对反应没有明显影响,但当体系中存在碱时,粒径较大的铑纳米粒子具有较高的活性。研究同时发现,当将铑纳米粒子固定在碱载体上时,对反应几乎没有影响,只有在体系中外加入碱的情况下才会对反应产生较大影响。

2.4 银催化的Sonogashira 偶联反应
Li 等[30]以碘化银作为催化剂,二甲基甲酰胺作为溶剂,碳酸钾作为碱完成偶联反应,在100 ℃得到偶联产物,见式(10)。在对溶剂的筛选中发现,二甲基乙酰胺、乙醇以及异丙醇由于对银催化剂的溶解性较好,而具有良好的效果。在研究中还对各银盐的催化活性进行了研究,结果显示碘化银的催化活性最佳。

3 结 语
纵观本文所述过渡金属以及新型钯催化剂在Sonogashira 偶联反应中的应用实例,其应用相对而言还比较有限,因此,还需要进一步发展和扩大更多形态的催化剂及其使用条件,让更多的有机分子可以通过Sonogashira 偶联反应温和、简洁高效且经济地合成。
与均相的钯催化剂相比,各种异相催化剂具有低成本、稳定、方便、易分离等优点,尤其是低成本活性炭作载体的Pd/C 催化剂,不仅在Sonogashira反应中表现出出色的催化活性,而且反应条件温和,降低了后处理难度,无疑将成为Sonogashira 反应更广泛地应用于工业生产的生力军,具有很好的经济前景。
诸多研究者的工作证明,水的存在往往会促使Sonogashira 偶联反应朝向好的方向发展,只要选择合适的催化体系、合适的碱体系等反应条件,就可以将传统Sonogashira 反应中所使用到的有毒有害物质替换为更绿色、低廉的合成环境。
[1] Diek H A ,Heck F R. Palladium catalyzed synthesis of aryl-heterocyclic and vinylic acetylene derivatives[J]. Journal of Organometallic Chemistry,1975,93(2):259-263.
[2] Cassar L. Synthesis of aryl- and vinyl-substituted acetylene derivatives by the use of nickel and palladium complexes[J]. Journal of Organometallic Chemistry,1975,93(2):253-257.
[3] Sonogashira K,Tohda Y,Hagihara N. A convenient synthesis of acetylenes : Catalytic substitutions of acetylenic hydrogen with bromoalkenes ,iodoarenes and bromopyridines[J]. Tetrahedron Letters,1975,16:4467-4470.
[4] Yin L X,Liebscher J.Carbon carbon coupling reactions catalyzed by heterogeneous palladium catalysts[J].Chemical Reviews,2007,107:133-173.
[5] Genet J P,Savignac M J. Recent development of palladium(0)catalyzed reactions in aqueous medium[J].Journal of Organometallic Chemistry,1999,576(1-2):305.
[6] Habib F,Nasser I,Mohammad G. Recyclable palladium-catalyzed Sonogashira-Hagihara coupling of aryl halides using 2-aminophenyl diphenylphosphinite ligand in neat water under copper-free condition[J].Journal of Molecular Catalysis A:Chemical,2010,321(1-2):110-116.
[7] Wang Y,Liu J H,Xia C G. Cross-linked polymer supported palladium catalyzed carbonylative Sonogashira coupling reaction in water[J].Tetrahedron Letters,2011,52(14):1587-1591.
[8] He Y ,Cai C. Heterogeneous copper-free Sonogashira coupling reaction catalyzed by a reusable palladium Schiff base complex in water[J].Journal of Organic Chemistry,2011,696(13):2689-2692.
[9] Suzuka T,Okada Y,Ooshiro K,et al.Copper-free Sonogashira coupling in water with an amphiphilic resin-supported palladium complex[J].Tetrahedron,2010 ,66(5):1064-1069.
[10] Ye Z W ,Yi W B .Polymer-supported palladium perfluorooctanesulfonate [Pd(OPf)2]:A recyclable and ligand-free palladium catalyst for copper-free Sonogashira coupling reaction in water under aerobic conditions[J]. Journal of Fluorine Chemistry,2008,129(11):1124-1128.
[11] Bakherad M,Keivanloo A,Bahramian B,et al. Copper-free Sonogashira coupling reactions catalyzed by a water-soluble Pb-salen complex under aerobic conditions[J].Tetrahedron Letters,2009,50(46):1557-1559.
[12] Bruce H L,David W C,Rich B. Sonogashira couplings of aryl bromides :Room temperature,water only,no copper[J].Organic Letters,2008,10(17):3793-3796.
[13] Lee D H,Lee Y H,Jack M H. et.al. Phosphine-free Sonogashira coupling : Reaction of aryl halides catalysed by palladium( Ⅱ)complexes of azetidine-derived polyamines under mild conditions[J].Tetrahedron,2009,65(8):1630-1634.
[14] Bakherad M,Keivanloo A,Kalantar Z,et al.Pd/C-catalyst heterocyclization during copper-free Sonogashira coupling:Synthesis of 2-benzylimidazo[1,2-a]pyrimidines in water[J]. Tetrahedron Letters,2011,52(2):228-230.
[15] Shinde M M,Bhagwot S S. Surfactant assisted Pd/C catalyzed Sonogashira reaction in aqueous media[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects ,2011,380(1-3):201-206.
[16] Liang B,Dai M,Chen J,et al. Copper-free Sonogashira coupling reaction with PdCl2in water under aerobic conditions[J]. Journal of Organic Chemistry,2005,70(1):391-393.
[17] Jiang J Z,Cai C. Copper- and ligand-free Sonogashira reaction catalyzed by palladium in microemulsion[J]. Journal of Colloid and Interface Science,2007,307(1):300-303.
[18] Jiang J Z,Wei Y A,Cai C. Copper- and ligand-free Sonogashira reaction catalyzed by palladium in microemulsion : Effects of surfactant and alcohol[J]. Journal of Colloid and Interface Science,2007,312(2):439-443.
[19] Guan J T,Weng T Q,Yu G A,et al. Copper-free PdCl2/PPh3-catalyzed Sonogashira coupling reaction of aryl bromides with terminal alkynes in water[J].Tetrahedron Letters ,2007,48(40):7129-7133.
[20] Carlos E D ,Amanda S S ,Cristiane Y K,et al. Synthesis of(Z)-tributylstannyl enynes : Systematic studies of Sonogashira cross-coupling reactions between (E)-1-iodovinyl-1-tributylstannanes and terminal acetylenes using amines or tetrabutylammonium hydroxide(TBAOH)as activator[J].Tetrahedron Letters ,2011,52(32):4177-4181.
[21] Bhattacharya S ,Sengupta S. Palladium catalyzed alkynylation of aryl halides (Sonogashira reaction) in water[J]. Tetrahedron Letters,2004,45(47):8733-8736.
[22] Volla C M R,Vogel P.Iron/copper-catalyzed C—C cross-coupling of aryl iodides with terminal alkynes[J].Tetrahedron Letters,2008,49(41):5961-5964.
[23] Mao J,Xie G,Wu M,et al. Ligand-free iron/copper cocatalyzed alkynylation coupling reactions[J]Advanced Synthesis and Catalysis,2008,350(16):2477-2482.
[24] Huang H,Jiang H,Chen K,et al.Efficient iron/copper cocatalyzedalkynylation of aryl iodides with terminal alkynes[J]. Journal of Organic Chemistry,2008,73(22):9061-9064.
[25] Carril M,Correa A,Bolm C.Iron-catalyzed Sonogashira reactions[J].Angewandte Chemie,2008,47(26):4862-4865.
[26] Wang L,Li P,Zhang Y.The Sonogashira coupling reaction catalyzed by ultrafine nickel(0) powder[J]. Chemical Communications,2004,(5):514-515
[27] Vechorkin O,Barmaz D,Proust V,et al.Ni-catalyzed Sonogashira coupling of nonactivated alkyl halides:Orthogonal functionalization of alkyl iodides,bromides,and chlorides[J]. Journal of the American Chemical Society,2009,131(34):12078-12079.
[28] Chinchilla R,Najera C. The Sonogashira reaction:A booming methodology in synthetic organic chemistry[J]. Chemical Reviews,2007,107(3):874-922.
[29] Kanuru V K,Humphrey S M,Kyffin J M,et al. Evidence for heterogeneous Sonogashira coupling of phenylacetylene and iodobenzene catalyzed by well defined rhodium nanoparticles[J].Daltontrans,2009,37:7602-7605.
[30] Li P H,Wang L.A novel silver iodide catalyzed Sonogashira coupling reaction[J]. Synlett,2006,14:2261-2265.

