酵母油脂及用于生物柴油制备研究进展
张国玲,杜 伟,刘德华
(清华大学化学工程系应用化学研究所,北京100084)
随着自然资源和化石能源的消耗以及日益严重的环境问题,清洁可再生能源生物柴油,作为化石资源的可替代品,越来越受到各方的关注。生物柴油是有机脂肪酸酯类物质,通常由植物油或者动物脂肪等油脂类物质与短链醇经过酯交换反应得到[1]。生物柴油具有很多引人注目的优势,如原料来源广泛、可再生,燃烧充分,对环境友好等,这些优势使得生物柴油具有很强的竞争力[1]。
目前我国生物柴油企业主要利用酸化油、地沟油、潲水油等作为生产生物柴油的原料,但这些低品质油脂的有效收集和运输存在较大问题,而且价格波动也较大,这已成为限制我国生物柴油产业发展的最重要的制约因素之一。因此开发非食用油脂,如微生物油脂等,用于生物柴油的制备是近年来的研究热点[2]。微生物油脂(单细胞油脂),是指由微生物在一定条件下产生并储存在菌体内的甘油脂[3]。微生物生产油脂具有繁殖速度快,生产周期短,以及不受场地、气候变化影响等优点[3]。来自美国国家可再生能源实验室的报告指出,微生物油脂发酵可能是生物柴油产业和生物经济的重要研究方向[4]。研究表明,酵母、薇藻、细菌、霉菌等微生物在适当条件下,可在菌体内产生积累大量油脂,其中,油脂酵母因其高产油能力而受到广泛关注[5]。
酵母油脂的主要成分是甘油三酯,油脂的组成与植物油相似,研究表明酵母油脂可被用于生物柴油的制备[6]。为促进酵母油脂在生物柴油制备中的应用,目前大多研究主要集中于优化酵母油脂培养条件以及对酵母油脂合成关键基因进行解析,以提高酵母油脂含量,降低培养成本。研究表明,酵母油脂的积累受到发酵条件的影响,如培养基中的碳氮比、温度、pH 值、氧气含量、微量元素等,优化发酵过程以及寻求廉价碳源,对酵母油脂作为制备生物柴油的原料具有重要意义;同时,利用基因工程以及代谢工程对酵母菌株进行改造以提高酵母产油能力,具有极大的发展潜力[7]。另外,研究表明,由甘油二酯(DAG)生成甘油三酯(TAG)是TAG合成过程中的限速步骤[6],对该过程中的关键基因进行解析是促进酵母油脂合成的关键。本文主要综述了酵母油脂的组成及油脂合成影响关键因素以及酵母油脂用于生物柴油制备的研究进展,并对酵母油脂用于生物柴油制备的有关前景进行了展望。
1 酵母油脂组成
隐球酵母属(Cryptococcus)、红酵母属(Rhodotorula)、油脂酵母属(Lipomyces)、丝孢酵母属(Trichosporon)、耶氏酵母属(Yarrowia)等在一定条件下均可积累油脂[8]。在限氮培养基中,Rhodosporidium sp.可以积累高达细胞干重70%以上的油脂[9],Crptococcus sp.可以积累超过细胞干重60%的油脂[10]。根据文献报道,酵母发酵产油脂可分两个阶段:菌体增殖期和油脂积累期[11]。在细胞增殖期,酵母需要消耗培养基中丰富的碳源和氮源,以保持菌体旺盛的代谢和增殖过程。当培养基中碳源充足而氮源缺乏时(高碳氮比),菌体细胞分裂速度迅速下降,细胞中的代谢活动以合成油脂为主,这个时期称为油脂积累期。在油脂积累期,酵母基本上不再进行细胞增殖,而是将过量的碳水化合物转化为脂类。
酵母油脂的脂肪酸组成以C16、C18系脂肪酸为主[12],如棕榈酸(16∶0),油酸(18∶1),亚油酸(18∶2)等,与大豆油(棕榈酸6%~8%,油酸25%~36%,亚油酸52%~65%,亚麻油酸2%~3%,硬脂酸3%~5%,花生酸0.1%~0.4%)、棕榈油(棕榈酸约67%,油酸约17%,亚油酸约4%,硬脂酸约5%)等植物油的主要组成相似,可被用作生物柴油的原料油。
2 酵母油脂合成影响关键因素
研究表明,酵母油脂的合成主要受培养参数以及油脂合成过程中的关键酶及基因限制。培养基中的碳氮比、温度、pH 值、氧气含量、微量元素等都会影响到酵母油脂的合成,其中,碳氮比是影响酵母油脂合成的重要因素,有研究报道,当碳氮比从25 提高至70,酵母油脂含量可由18%增加至46%[13]。高碳氮比有利于油脂合成,为寻找合适的廉价碳源降低酵母油脂合成的成本,研究酵母对不同碳源的利用十分必要。同时,从代谢途径探究影响油脂合成的关键基因,可以为改造菌体、提高酵母的产油能力提供基础依据。
2.1 酵母油脂合成中的关键酶和基因
酵母油脂的合成代谢中,ATP∶柠檬酸裂解酶(ACL)和苹果酸酶(ME)被认为是两个关键酶[14]。当氮源缺乏时,油脂积累被过程被激活,AMP 脱氨酶活性增加,使得AMP 转化为IMP 和NH4+,随着AMP 浓度的下降,细胞的代谢及相关过程发生了改变[15]。AMP 浓度降低,使得细胞线粒体中的异柠檬酸脱氢酶(ICDH)活性降低或失活,这是因为在油脂酵母中,ICDH 是完全依赖AMP 的,ICDH 活性改变后,异柠檬酸通过苹果酸/柠檬酸转移酶,由线粒体内运出至细胞溶质中,然后在ACL 的催化下,裂解为乙酰辅酶A 和草酰乙酸[14]。ACL 活性与酵母中油脂积累有密切的联系,ACL 是油脂积累的前提,但是具有ACL 的酵母并不一定是油脂酵母[16]。
在脂肪酸合成中过程中,不仅需要有ACL 催化反应所提供的乙酰辅酶A,还需要足够的NADPH。ME 催化苹果酸氧化脱羧,生成丙酮酸以及NADPH,这一过程产生的NADPH 只占总NADPH 的15%,但脂肪酸合成几乎只能利用这一部分NADPH,当ME 的活性被抑制时,油脂积累也随之下降,油脂积累的多少与ME 紧密相关[17]。研究细胞内ACL 和ME 的代谢调控,将有助于对油脂酵母进行改良,通过基因调控手段来提高油脂积累水平。

图1 酵母S.cerevisiae 中由G-3-P 和DHAP 合成TAG 的代谢途径
酵母所产油脂中,TAG 约占80%以上[17]。TAG由DAG 在甘油二酯酰基转移酶(DAGAT)的催化下,通过酰化反应生成,该步骤是TAG 合成过程的限速步[6]。为进一步解析DAG 到TAG 过程中的关键基因,目前主要研究集中于基因背景清楚的啤酒酵母 Saccharomyces cerevisiae TAG 合成途径(图1)。
在S.cerevisiae 中,DAG 可在磷脂-甘油二酯酰基转移酶(PDAT)的催化下,以磷脂为酰基供体,生成TAG,PDAT 由LRO1 基因编码。DAG 也可在由DGA1基因编码的酰基辅酶A-甘油二酯酰基转移酶(DGAT)的催化下,以酰基辅酶A 为酰基供体,生成TAG[18];这一过程中,由ARE1 和ARE2 基因编码的酰基辅酶A-甾醇甘油二酯酰基转移酶(ASAT)也表现出微弱的活性[19-20]。研究发现,在酵母细胞S.cerevisiae 的TAG 合成过程中,过量表达LRO1 基因可以使TAG 含量增加[21-22]。对处于生长稳定期的S.cerevisiae 细胞的研究发现,在缺少DGA1、ARE1 和ARE2 基因,而只表达LRO1 基因时,TAG 的合成水平为野生菌株的38%;然而,在敲除LRO1 基因的菌株中,TAG 的含量虽有所减少,但减少量不明显[18]。进一步研究发现,敲除处于对数生长期的S.cerevisiae 的LRO1 基因后,TAG 含量与野生株相比显著下降[22]。这表明LRO1 基因与TAG 合成有关,并且主要影响处于对数生长期的细胞中的TAG 合成。
然而,对处于稳定期的S.cereviseae 细胞研究发现,在缺少LRO1、ARE1 和ARE2 基因,只表达DGA1 基因时,TAG 的合成水平为野生菌株的87%,因此研究者认为在处于稳定期的S.cereviseae 细胞中,DGA1 基因是影响TAG 合成的主要基因。进一步对敲除DGA1 基因的菌株的研究结果也表明,TAG 含量以及脂肪酸总量与野生株相比显著下降,因此在S.cereviseae 酵母的稳定期,DGA1 基因对TAG 合成发挥主要作用[18]。然而,也有研究表明,不同酵母细胞中DGA1 基因对TAG 合成的影响也有差异[23]。在Schizosaccharomyces pombe 细胞中发现,敲除DGA1 基因后,TAG 的含量与野生株相比并没有差别,这主要是由于在它的TAG 合成过程中,如果缺少一种TAG 合酶,另一种酶会作出相应的补偿[23]。
另外,研究发现,不同碳源对DGA1 基因表达也有较大影响。在Y.lipolytica 酵母中,敲除DGA1基因后,以葡萄糖为碳源的菌体内TAG 含量为野生株的90%,而以油酸为碳源的菌体内TAG 含量与野生株相比略有增加。进一步敲除LRO1 和DGA1基因后,以葡萄糖为碳源的菌体内TAG 含量降至野生株的30%,而以油酸为碳源的菌体内TAG 含量则为野生株的85%[23]。将处于对数生长期和稳定期的Y.lipolytica 细胞进行比较,发现Lro1p 活性下降了25%,而Dga1p 活性增加了20%[23],这说明处于对数生长期的细胞内TAG 积累主要受LRO1 基因调控,而处于稳定期的细胞内TAG 积累主要受DGA1基因调控,与S.cerevisiae 中的情况一致。
还有研究表明,LRO1、DGA1、ARE1 和AREI2基因不仅与酵母中的TAG 合成过程有关,还对TAG的脂肪酸组成有影响。对于S.cerevisiae 中的LRO1、DGA1,ARE1 和ARE2 基因,只表达DGA1 基因时,脂肪酸组成与野生菌中的情况十分相似,而在只表达LRO1、ARE1 或ARE2 基因时,菌体中的脂肪酸组成则发生明显改变,菌体中积累大量异油酸,棕榈油酸含量也有所增加,而棕榈酸含量减少[18]。另外,当缺少DGA1 基因编码的酶时,酵母细胞中脂肪酸组成也会发生改变,这可能是受到菌株中TAG合成减少的影响[18]。综上所述,LRO1、DGA1、ARE1和ARE2 基因同油脂合成有非常强的关联关系。这些关键基因在不同酵母合成油脂过程中的作用是否具有普适性还有待于进一步考察。
2.2 利用不同碳源合成酵母油脂
除了从代谢途径上解析关键酶和基因,还有大量研究集中于优化培养条件以提高酵母油脂的合成。其中,碳源是影响酵母油脂培养成本的重要因素,探讨利用廉价碳源进行酵母油脂培养是近年来的研究热点。一些廉价碳源如甘油、能源作物以及木质纤维素水解液等可作为酵母油脂的培养碳源(如表1)。
甘油是生物柴油生产、油脂皂化、酒精饮品制造等行业的主要副产物,对甘油的回收利用受到研究者们越来越多的关注。作为可再生资源之一,甘油可作为碳源用于酵母培养。对C.curvatus 的研究发现,利用粗甘油作为碳源,进行两阶段高密度培养,在生长阶段胞的脂肪酸组成主要为C18∶2(亚麻油酸),是膜脂的主要成分;而在油脂积累阶段,细胞脂肪酸的主要组成为C18∶0(硬脂酸)和C18∶1(油酸),是积累TAG 的主要成分。在优化的条件下,细胞干重可达69 g/L,油脂含量为48%[24]。研究者还将脱油后的酵母细胞加入培养基中作为碳源循环使用,使得整个过程更为经济[24,31]。酵母Y.lipolytica 也可利用甘油作为碳源,并且生长状况良好。在含有甘油的限氮培养基中生长时,油脂积累量随甘油浓度增加而增加,最大油脂含量为31%,与稳定期相比,生长初期的酵母油脂中饱和脂肪酸含量较高[25]。
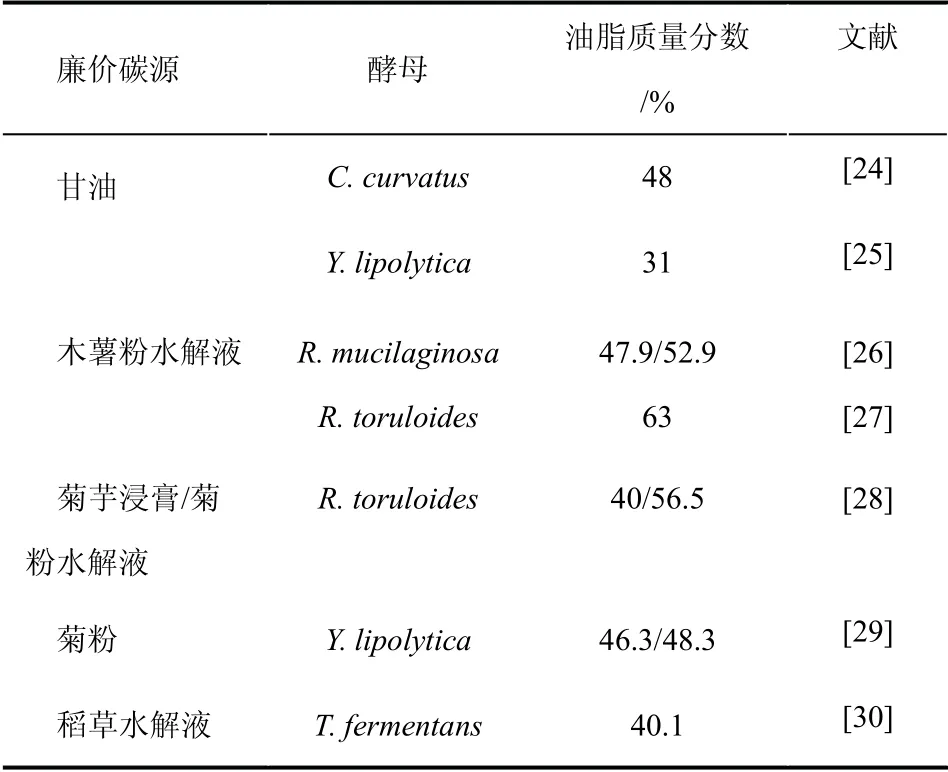
表1 廉价碳源用于酵母油脂合成
一些能源作物如木薯、菊芋等也可作为酵母油脂合成的碳源来源。木薯广泛种植于热带及亚热带地区,对于疾病和干旱有较强的抵御能力,能够在贫瘠的土地上生长,木薯粉含有约20%的直链淀粉和约80%的支链淀粉,可以水解为葡萄糖和低聚麦芽糖,被认为是用于制备生物柴油的重要原料来源。Li 等[26]利用木薯粉水解液培养酵母 R.mucilaginosa,在批次发酵和间歇补料发酵下油脂含量分别达到47.9%和52.9%。Wang 等[27]利用含木薯粉水解液的培养基培养R.toruloides 以制备油脂。在含木薯粉水解液8%的培养基中,油脂含量可达到63%。菊粉是天然果聚糖的混合物,作为植物根、茎中的贮藏多糖之一,含量十分丰富。近来菊粉作为可再生原料收到了人们的关注,然而,野生油脂酵母不能分泌菊粉酶,因而不能直接利用菊粉,需要利用菊粉酶将菊粉水解为还原糖。Zhao 等[28]分别利用菊芋浸膏和菊粉水解液培养R.toruloides,细胞油脂含量可达到40%和56.5%。Zhao 等[29]在Y.lipolytica 中表达菊糖酶基因INU1,使得菊粉可以被酵母直接利用,在摇瓶发酵实验中,Y.lipolytica 利用菊粉作为碳源积累油脂达46.3%;在2-L 发酵实验中,Y.lipolytica 分别利用菊粉和菊芋块茎浸膏,积累油脂达48.3%和50.6%。
木质纤维素原料是自然界中最为丰富的有机物,可用作酵母发酵的碳源。以玉米秸秆为例,其主要成分为纤维素(37.5%),半纤维素(22.4)和木质素(17.6%)[32],充分水解得到的混合糖中葡萄糖和木糖的质量比约为2∶1[33]。然而许多酵母并不能直接利用五碳糖进行发酵,某些酵母,尽管具有代谢五碳糖的能力,但是利用率较低。并且用混合糖作为碳源时,酵母往往优先利用更易于被代谢的葡萄糖,木糖代谢处于抑制状态,只有当葡萄糖消耗到一定浓度以下,才启动对木糖的代谢[34]。另外,木质纤维素水解液中含有抑制物,如醛类、酮类、酚类和有机酸类[35]。这些抑制物会对酵母的生长和发酵产生不利影响,降低酵母对营养物质的利用率,抑制目的产物的生成[36]。因此研究酵母对木糖或混合糖的利用以及对木质纤维素水解液中抑制因子的耐受性,对酵母发酵具有重要意义。
孔祥莉等[37]研究了酵母L.starkeyi 对木糖和混合糖的利用能力,发现该菌株利用木糖进行发酵时的产油能力与葡萄糖相当,并且可以同时转化混合糖。以木糖作为碳源时,96 h 后菌体的油脂含量达到52.6%;以混合糖作为碳源时,120 h 后菌体的油脂含量达到52.6%[37]。杨登峰等[38]筛选获得可用木质纤维素作为原料生产乙醇的酵母菌株Pichia caribbica。以木糖作为碳源时,木糖利用率为94.7%;以混合糖作为碳源时,木糖和葡萄糖利用率分别为94.2%和95.6%。Agbogbo 等[39]考察了用于乙醇生产的酵母P.stipitis 对混合糖的利用,随着混合糖中木糖比例提高,细胞生长速度变缓,产物乙醇的得率略有上升。还有研究者提出可以通过构建重组菌来有效代谢五碳糖和六碳糖,将戊糖途径引入代谢己糖良好的油脂酵母中,将产油脂关键酶引入能够代谢混合糖的酵母菌种中[36],或是通过原生质体融合获得新菌株[40],使得木质纤维素被高效利用。编码木糖还原酶的XYL1 基因和编码木糖醇脱氢酶的XYL2 基因是真菌木糖转化途径中的关键基因[41],徐勇等[41]将XYL1 和XYL2 基因在S.cerevisiae 中表达,使之具有木糖还原酶和木糖醇脱氢酶的活性。重组菌株可以木糖作为唯一碳源,乙醇得率达到理论值的37%。编码木糖异构酶的XYLA基因是细菌木糖代谢途径中的关键基因[42]。Walfridsson 等[43]首 次 将Thermus thermophilus 的XYLA 基因在S.cerevisiae 中表达,但由于木糖异构酶的最适反应温度与发酵温度不同以及重组酶的表达活性较低等原因,木糖异构酶的的活性仅为最适条件下的4%。涂振东等[40]利用原生质体融合和诱变育种的方法,得到了5 株P. guillermondii 和Candida shehatea 的突变菌株,其乙醇产量分别提高了37.7%、30.9%、15.7%、84.9%、47.1%。
研究开发对木质纤维素水解液中抑制物耐受的酵母菌种,或是对木质纤维素水解液进行预处理,降低抑制物对菌株的不利影响,也是提高酵母对木质纤维素利用效率的重要方面[44]。Limtong 等[45]研究了C.shehatae,P.stipitis 和Pachysolen tannophilus对醋酸的耐受性,当培养基中添加0.5%的醋酸,pH值为4.1 时,只有P.tannophilus 仍表现出活性;当培养基中醋酸的添加量为1%,pH 值为3.7 时,所有菌株的生长都受到抑制。Zhao 等[46]研究了S.cerevisiae、P.stipitis 和Pachysolen tannophilus 对糠醛和糠醇的耐受性,糠醛和糠醇均会对三株酵母菌株产生抑制作用,并且糠醛的毒性更大,可利用木糖进行发酵的酵母 P. stipitis 和 Pachysolen tannophilus 对糠醛更为敏感。Huang 等[30]首次利用硫酸处理过的稻秆水解液培养T.fermentans,在未经脱毒处理的水解液中,酵母油脂含量非常低;经过预处理除去水解液中的抑制物,在培养8 天后生物量可达28.6 g/L,油脂含量40.1%。因此,研究酵母对混合糖的高效利用,通过菌种改造和对木质纤维素水解液的预处理,提高菌株对抑制因子耐受力,是未来工业生物技术值得关注的领域之一,也是木质纤维素资源得以高效利用的前提。
综上,探讨利用包括木质纤维素在内的廉价碳源进行酵母油脂合成对降低油脂培养成本极为关键。进一步研究可集中于筛选优良菌株、对菌种进行改造以进一步提高其发酵性能以及优化反应器设计等以促进廉价碳源在酵母油脂合成中的应用。
3 酵母油脂制备生物柴油研究进展
根据所用催化剂的不同,制备生物柴油的方法主要集中于均相碱催化、酸催化和生物酶催化。同其它动植物油脂一样,酵母油脂经过酯交换反应即可转化成生物柴油,但目前对酵母油脂用于生物柴油制备的研究报道仍十分有限,各催化条件下不同酵母油脂制备生物柴油的得率如表2 所示。
均相碱催化方法是生物柴油制备过程中广泛使用的生产工艺,具有反应速率快,产物得率高等优点[52],但在反应中需要严格控制油脂中游离脂肪酸和水分的含量,减少副反应的发生。有学者探讨了利用均相碱催化工艺转化酵母油脂制备生物柴油的可能。Wang 等[27]利用碱催化法转化酵母R.toruloides 的油脂时发现,超过85%的油脂可被转化为生物柴油,并且生物柴油燃烧状况良好。Wu 等[47]利用T.capitatum 积累的油脂进行碱催化反应,在醇油摩尔比为6∶1 时,甲酯得率达到了92%,并且生物柴油的冷滤点为-15 ℃,这为研究制备高质量的生物柴油提供了有效依据。Thiru 等[24]将酵母C.curvatus 中提取的油脂进行预处理,然后使用30%的甲醇钠进行转酯化反应,2 h 后生物柴油得率达到90%。在酵母油脂的提取和储存过程中,由于受诸多因素影响,往往会导致酵母油脂里含有一定量的游离脂肪酸。有研究者利用游离脂肪酸含量较高的酵母L.starkeyi 的油脂进行两步法转化,首先使用甲醇进行预酯化,然后通过碱法催化进行酯化反应制备生物柴油[53]。还有研究者使用两步法转化酵母T.fermentans 的油脂,醇油摩尔比为6∶1,反应1 h后得率达到了92%[48]。在均相碱催化下,酵母油脂制备生物柴油的得率在短时间内即可达到较高水平。
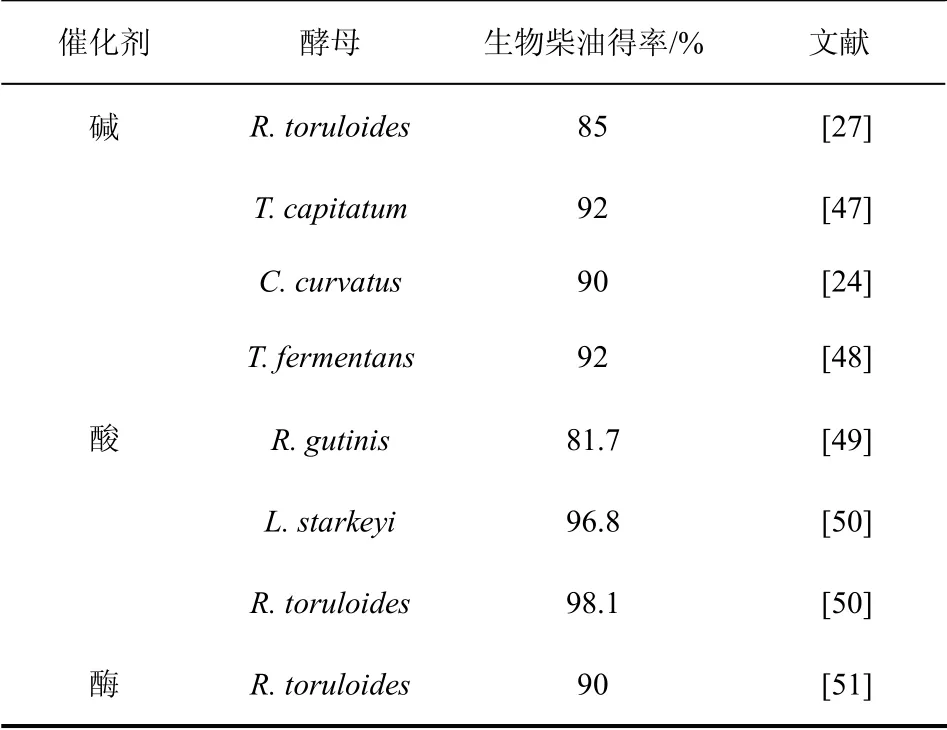
表2 酵母油脂制备生物柴油
也有学者尝试利用酸催化的工艺将富含游离脂肪酸的酵母油脂转化成生物柴油,避免了碱法催化含酸油脂时的预酯化步骤,但酸法催化油脂制备生物柴油的反应时间相比碱催化方法有所延长。Dai等[49]利用硫酸催化从酵母R.gutinis 中提取的油脂,在醇油摩尔比为30∶1,反应5 h 后,生物柴油得率可达81.7%,并且与植物油制备得到的生物柴油组成相似。另外,为降低由酵母油脂制备生物柴油过程的成本,有研究者除去了从酵母中提取油脂的步骤。Liu 等[50]用硫酸催化酵母L. starkeyi 和R.toruloides,直接进行甲醇解反应制备生物柴油,20 h 后得率分别达到96.8%和98.1%。
近年来,环境友好的酶法工艺转化可再生油脂制备生物柴油引起了人们的关注[54]。酶法制备生物柴油的反应条件温和,整个反应过程中无有害物产生,不会对环境造成影响,产物与甘油通过静置即可分离。里伟等[51]尝试了生物酶催化R.toruloides酵母油脂制备生物柴油,反应分别在无溶剂体系和叔丁醇介质体系中进行,生物柴油得率可达90%。但利用酶法工艺也存在一些不足,如酶的成本较高,容易失活,重复使用的次数有限,这些问题都亟需研究者探寻合理的应对措施与解决方法。
综上,在不同催化方法下,酵母油脂均可被利用进行转酯化反应,这为制备生物柴油提供了更加广泛的原料来源,对进一步研究生物柴油的生产应用有着重要意义,具有很大的发展前景。
4 酵母油脂用于生物柴油制备的前景展望
目前,全世界95%以上的生物柴油来自于食用植物油,主要是棕榈油、大豆油、菜籽油以及向日葵油等[55]。随着生物柴油产业的不断增长,油脂原料的可持续性供应将成为生物柴油规模化发展的主要的瓶颈。
微生物油脂具有制备周期短,不需要占用耕地的优势,因此,作为一种非粮油料,大力发展包括酵母油脂在内的微生物油脂对生物柴油产业发展具有重要意义。然而,在酵母油脂合成过程中,还急需解决如下问题:通常葡萄糖及淀粉质原料是包括酵母在内的产油微生物生长所需的最适碳源,但葡萄糖与淀粉质原料成本较高,不适于进行大规模的油脂生产,而且根据我国的现有国情,利用这些粮糖质原料,易造成“与人争粮,与粮争地”的局面[33],由此产生多种社会及经济问题。因此,研究者不断探寻适合生物燃料油脂发酵技术需要的其它大宗原材料,如木质纤维素水解液、能源作物、工农业废弃物中的有机质等。在未来的工作中,应从工程学角度,对原料前处理、发酵过程、后提取过程进行工艺优化以促进微生物油脂在生物柴油制备中的应用。另一方面,通过研究产油脂微生物的生长代谢规律及产油机理,改造菌株对不同原料底物的利用能力,还可通过生物技术获得能够分泌油脂及脂肪酸代谢衍生物的菌株,简化对微生物油脂的分离提取工艺,降低能耗及成本,提高产物得率,对实现能源油脂的连续生产具有重要意义。
总之,尽管包括酵母油脂在内的微生物油脂目前还存在如上所述的系列工作亟待开展,随着生物科学技术的发展以及对酵母油脂研究的不断深入和完善,酵母油脂作为生物柴油的潜在原料,具有很好的开发前景。
[1] 孙婷,杜伟,刘德华,等. 固定化全细胞催化可再生油脂合成生物柴油的稳定性[J]. 生物工程学报,2009,25(9):1379-1385.
[2] 王强,封颖. 我国生物柴油产业发展的制约因素研究[J]. 中国科技成果,2009,2:40-42.
[3] 马艳玲. 微生物油脂及其生产工艺的研究进展[J]. 生物加工过程,2006,4(4):7-11.
[4] Tyson K S,Bozell J,Wallace R,et al.Biomass oil analysis:Researchneeds and recommendations[R].NREL/TP-510-34796,2004.
[5] Meng X,Yang J M,Xu X,et al. Biodiesel production from oleaginous microorganisms[J].Renewable Energy,2009,34:1-5.
[6] Sorger D,Daum G.Triacylglycerol biosynthesis in yeast[J].Applied Microbiology and Biotechnology,2003,61:289-299.
[7] Li Q,Du W,Liu D H. Perspectives of microbial oils for biodiesel production[J].Applied Microbiology and Biotechnology,2008,80:749-756.
[8] Ratledge C. Single cell oils——Have they a biotechnological future?[J].Trends in Biotechnology,1993,11(7):278-284.
[9] 李永红,刘波,赵宗保,等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J]. 生物工程学报,2006,22(4):650-656.
[10] Ratledge C. Microbial fats and oils : An assessment of their commercial potential[J].Progress in Industrial Microbiology,1982,16:119-206.
[11] 赵宗保. 加快微生物油脂研究为生物柴油产业提供廉价原料[J].中国生物工程杂志,2005,25(2):8-11.
[12] 冯冲. 高纯度生物柴油原料的微生物转化技术研究[D]. 郑州:河南农业大学,2007.
[13] Hassan M,Blanc P J,Granger L M,et al.Influence of nitrogen and iron limitations on lipid production by Cryptococcus curvatus grown in batch and fed-batch culture[J].Process Biochemistry,1996,31(4):355-361.
[14] Ratledge C. Regulation of lipid accumulation in oleaginous micro-organisms[J]. Biochemical Society Transactions,2002,30:1047-1050.
[15] Wynn J P,Hamid AA,Li Y,et al.Biochemical events leading to the diversion of carbon into storage lipids in the oleaginous fungi Mucor circinelloides and Mortierella alpina[J].Microbiology,2001,147:2857-2864.
[16] Ratledge C,Wynn J P. The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J]. Advances in Applied Microbiology,2002,51:1-51.
[17] Ratledge C. Microorganisms for lipids[J]. Acta Biotechnologica,1991,11(5):429-438.
[18] Sandager L,Gustavsson M H,Stahl U,et al.Storage lipid synthesis is non-essential in yeast[J]. The Journal of Biological Chemistry,2002,277(8):6478-6482.
[19] Chang C C,Huh H Y,Cadigan K M,et al.Molecular cloning and functional expression of human acyl-coenzyme A : Cholesterol acyltransferase cDNA in mutant Chinese hamster ovary cells[J]. The Journal of Biological Chemistry,1993,268(28):20747-20755.
[20] Meiner V L,Cases S,Myers H M,et al.Disruption of the acyl-CoA:cholesterol acyltransferase gene in mice : Evidence suggesting multiple cholesterol esterification enzymes in mammals[J].Proc.Natl.Acad.Sci.,1996,93:14041-14046.
[21] Dahlqvist A,Ståhl U,Lenman M,et al.Phospholipid:diacylglycerol acyltransferase:an enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeast and plants[J]. Proc. Natl. Acad.Sci.,2000,97(12):6487-6492.
[22] Oelkers P,Tinkelenberg A,Erdeniz N,et al.A lecithin cholesterol acyltransferase-like gene mediates diacylglycerol esterification in Yeast[J]. The Journal of Biological Chemistry,2000,275(21):15609-15612.
[23] Athenstaedt K. YALI0E32769g (DGA1) and YALI0E16797g (LRO1)encode major triacylglycerol synthases of the oleaginous yeast Yarrowia lipolytica[J]. Biochimica et Biophysica Acta,2011,1811(10):587-596.
[24] Thiru M,Sankh S,Rangaswamy V.Process for biosdiesel production from Cryptococcus curvatus[J].Bioresource Technology,2011,102:10436-10440.
[25] Andre A,Chatzifragkou A,Diamantopoulou P,et al.Biotechnological conversions of bio-diesel-derived crude glycerol by Yarrowia lipolytica strains[J]. Engineering in Life Sciences,2009,9(6):468-478.
[26] Li M,Liu G L,Chi Z,et al. Single cell oil production from hydrolysate of cassava starch by marine-derived yeast Rhodotorula mucilaginosa TJY15a[J].Biomass and Bioenergy,2010,34:101-107.
[27] Wang Q,Guo F J,Rong Y J,et al.Lipid production from hydrolysate of cassava starch by Rhodosporidium toruloides 21167 for biodiesel making[J].Renewable Energy,2012,46:164-168.
[28] Zhao X,Wu S,Hu C,et al. Lipid production from Jerusalem artichoke by Rhodosporidium toruloides Y4[J]. Journal of Industrial Microbiology and Biotechnology,2010,37:581-585.
[29] Zhao C H,Cui W,Liu X Y,et al.Expression of inulinase gene in the oleaginous yeast Yarrowia lipolytica and single cell oil production from inulin-containing materials[J]. Metabolic Engineering,2010,12:510-517.
[30] Huang C,Zong M H,Wu H,et al.Microbial oil production from rice straw hydrolysate by Trichosporon fermentans[J]. Bioresource Technology,2009,100:4535-4538.
[31] Meesters P A E P,Huijberts G N M,Eggink G. High-cell-density cultivation of the lipid accumulating yeast Cryptococcus curvatus using glycerol as a carbon source[J]. Applied Microbiology and Biotechnology,1996,45:575-579.
[32] Mosier N,Wyman C,Dale B,et al. Features of promising technologies for pretreatment of lignocellulosic biomass[J].Bioresource Technology,2005,96(6):673-686.
[33] Zhao X,Kong X,Hua Y,et al. Medium optimization for lipid production through co-fermentation of glucose and xylose by the oleaginous yeast Lipomyces starkeyi[J]. European Journal of Lipid Science and Technology,2008,110:405-412.
[34] 赵宗保,胡翠敏. 能源微生物油脂技术进展[J]. 生物工程学报,2011,27(3):427-435.
[35] Liu Z L. Molecular mechanisms of yeast tolerance and in situ detoxification of lignocellulose hydrolysates[J].Applied Microbiology and Biotechnology,2011,90:809-825.
[36] 刘娜,石淑兰. 木质纤维素转化为燃料乙醇的研究进展[J]. 现代化工,2005,25(3):19-24.
[37] 孔祥莉,刘波,赵宗保,等. 斯达氏油脂酵母利用混合糖发酵产油脂[J]. 生物加工过程,2007:5(2):36-41.
[38] 杨登峰,潘丽霞,关妮,等. 利用木糖-葡萄糖为原料产乙醇酵母的筛选、鉴定及发酵试验[J]. 中国生物工程杂志,2009:29(10):69-73.
[39] Agbogbo F K,Coward-Kelly G,Torry-Smith M,et al.Fermentation of glucose/xylose mixtures using Pichia stipitis[J]. Process Biochemistry,2006,41:2333-2336.
[40] 涂振东,叶凯,韩丽丽,等. 高效代谢木糖产乙醇酵母菌株的选育[J]. 新疆农业科学,2008,45(5):945-959.
[41] 徐勇,陈英,勇强,等. 重组酿酒酵母的木糖发酵性能研究[J]. 林产化学与工业,2008:28(1):23-28.
[42] 何明雄,祝其丽,潘科,等. 利用木质纤维素类生物质发酵生产乙醇重组菌株研究进展[J]. 应用与环境生物学报,2009:15(4):579-584.
[43] Walfridsson M,Bao X,Anderlund M,et al.Ethanolic fermentation of xylose with Saccharomyces cerevisiae harboring the Thermus thermophilus xylA gene,which expresses an active xylose(glucose)isomerase[J]. Applied and Environmental Microbiology,1996,62(12):4648-4651.
[44] 杨雪雪,蒋伶活. 酵母对木质纤维素酸解物中抑制物的应答及菌株开发[J]. 生命科学,2012,24(6):531-534.
[45] Limtong S,Sumpradit T,Kitpreechavanich V,et a1.Effect of acetic acid on growth and ethanol fermentation of xylose fermenting yeast and Saccharomyces cerevisiae[J]. The Kasetsart Journal:Natural Sciences,2000,34(1):64-73.
[46] Zhao J,Wang M,Yang Z,et a1.Measurement of inhibitory effects of furfural and furfural alcohol using coupled redox mediators[J].Enzyme and Microbial Technology,2005,37(2):246-253.
[47] Wu H,Li Y,Chen L,et al.Production of microbial oil with high oleic acid content by Trichosporon capitatum[J].Applied Energy,2011,88:138-142.
[48] Zhu L Y,Zong M H,Wu H. Efficient lipid production with Trichosporon fermentans and its use for biodiesel preparation[J].Bioresource Technology,2008,99:7881-7885.
[49] Dai C C,Tao J,Xie F,et al.Biodiesel generation from oleaginous yeast Rhodotorula glutinis with xylose assimilating capacity[J].African Journal of Biotechnology,2007,6(18):2130-2134.
[50] Liu B,Zhao Z B. Biodiesel production by direct methanolysis of oleaginous microbial biomass[J]. Journal of Chemical Technology and Biotechnology,2007,32:775-780.
[51] 里伟,杜伟,李永红,等. 生物酶法转化酵母油脂合成生物柴油[J].过程工程学报,2007,7(1):137-140.
[52] 梁斌. 生物柴油的生产技术[J]. 化工进展,2005,24(6):577-585.
[53] Angerbauer C,Siebenhofer M,Mittelbach M,et al.Conversion of sewage sludge into lipids by Lipomyces starkeyi for biodiesel production[J].Bioresource Technology,2008,99:3051-3056.
[54] Ranganathan S V,Narasimhan S L,Muthukumar K.An overview of enzymatic production of biodiesel[J].Bioresource Technology,2008,99:3975-3981.
[55] Gui M M,Lee K T,Bhatia S.Feasibility of edible oil vs.non-edible oil vs. waste edible oil as biodiesel feedstock[J]. Energy,2008,33(11):1646-1653

