CaSO4氧载体与CO反应中Boudouard反应的热力学分析及其抑制研究
郑 敏,沈来宏
(1 昆明理工大学冶金节能减排教育部工程研究中心,云南 昆明 650093;2 东南大学能源与环境学院,江苏 南京 210096)
化学链燃烧具有内分离CO2和提高燃烧系统效率的特点,是一种很有前景的温室气体控制方法[1]。化学链燃烧基本原理:氧载体在燃料反应器中与碳氢燃料进行还原反应,氧载体释放氧,而燃料被氧化成CO2和H2O(汽),冷凝除去H2O 得到纯净的CO2;随后,还原态氧载体进入空气反应器中,与空气接触进行氧化再生。目前,金属氧化物是主流的氧载体。金属氧载体具有高反应活性的优点,但存在一些固有缺陷:一是价格高,且存在重金属二次污染问题;二是煤中硫分和灰渣与金属氧载体反应,生成低熔点固相硫化物,导致金属氧载体永久失活[2-4]。近来,由于价格便宜,铁矿石氧载体,如赤铁矿、钛铁矿、钙钛矿引起了广泛的关注[5-7],但是铁基氧化物载氧率较低,铁矿石氧载体工业化运用有待深入研究。硫酸钙是一种新型的非金属氧载体,具有价格低廉、自然界中储量丰富、来源广、传递单位质量氧原子所需氧载体质量少等优点,将硫酸钙应用于化学链燃烧具有非常广泛的前景。
以硫酸钙为氧载体的化学链燃烧是通过CaSO4-CaS 化学循环交替反应来实现燃料的间接燃烧,从而得到纯净的CO2,而该技术目前处于初步探索阶段。CO 是一种重要的可燃气,也是煤或生物质气化的主要气体成分。CO 还原CaSO4氧载体的反应是竞争反应见式(1)、式(2)[8-9]。

上述竞争反应进行过程中,还可能会发生Boudouard 反应,也就是一氧化碳在高温下歧化为二氧化碳和单质碳的反应。Boudouard 反应的进行,一方面使得实际参与CaSO4还原反应的CO 浓度偏小。另一方面,Boudouard 反应所生成的单质碳沉积在氧载体上,造成氧载体反应活性降低;并且,沉积碳随后同氧载体一起进入空气反应器中,碳被空气中的氧气氧化成CO2。空气反应器中所生成的这部分CO2不仅量少,而且浓度低,不利于捕获,从而造成化学链燃烧CO2捕集率下降。见式(3)。

Boudouard 反应是一个可逆反应。CO 反应物浓度越高,该反应就越容易进行。当反应温度低于400 ℃时,Boudouard 反应速率很低[10]。提高反应温度,化学反应速率增大。然而,由于Boudouard反应是放热反应,提高反应温度,反应所能进行的程度下降,高温下Boudouard 反应较容易达到平衡 状态。
在化学链燃烧燃料反应器实施的适宜温度范围(850~1050 ℃),在CaSO4与CO 反应过程中,Boudouard 反应所能进行的程度随着气体反应物中CO 浓度和CO2浓度的变化发生改变。然而,一方面,气体反应物中CO 及CO2浓度取决于具体实施的技术路线,比如:以煤为燃料时,由于煤-氧载体之间固-固接触效率低,煤与氧载体之间直接还原反应速率慢。通常需要加入气化介质H2O 或CO2使煤先气化,然后煤气再与氧载体发生反应,因此,气化介质的种类及数量对煤气中CO 和CO2浓度有很大的影响。另一方面,在反应过程中CO 及CO2浓度是一个随反应时间变化的量。现阶段对CaSO4与CO 反应的相关研究报道[8-9,11-15]主要是集中在实验研究方面,测试中气体反应物CO 浓度低于20%,CO2浓度为0,实验分析中未考虑Boudouard 反应对CaSO4-CO 竞争反应的影响。其中,张璐等[15]通过XRD 测试分析发现950 ℃、20%CO 气氛下,3次循环反应后,CaSO4还原反应固体产物中没有出现碳沉积现象。因此,有必要从热力学角度,在较宽CO 浓度和CO2浓度范围,对Boudouard 反应可行性展开研究,为化学链燃烧实验研究提供理论 依据。
本研究将围绕化学链燃烧的应用,以N2作为平衡气,在较宽CO 浓度范围(0.5%~99.0%)、在不同反应温度(500~1200 ℃)、不同CO2(0~70%)和SO2浓度(0~10%)下,利用化学平衡常数,对 CaSO4与CO 反应过程中Boudouard 反应可行性展开热力学研究,旨在获得抑制Boudouard 反应的 方法。
1 平衡常数相关计算方法
根据标准Gibbs 自由能变换,反应平衡常数Kp与温度T 的关系为式(4)。


图1 相关反应平衡常数
对于平衡常数表达式形式相类似的反应,平衡常数的大小反映了反应所能进行的程度。通常平衡常数越大,反应进行得越彻底,达到平衡时产物浓度越大。由于Boudouard 反应的平衡常数表达式形式和CaSO4-CO 竞争反应[图1 中(1)和(2)]的不同,并不能直接进行比较,需要进行换算。换算方法如下:通过计算CO 在各反应中的平衡转化率,判断各个反应所能进行程度的高低。具体过程如下:假设氧载体相对CO 过量,气体反应物Qmole,其中气体反应物中CO 浓度[CO],CO2浓度[CO2],SO2浓度[SO2]。根据化学反应方程式,考虑各物质起始时与平衡时物质的量的关系,从而得到各反应的CO 平衡转化率X[CO]eq。相关计算公式见表1。
2 Boudouard 反应和CaSO4-CO 竞争反应的CO 平衡转化率分析
2.1 反应温度对单个反应CO 平衡转化率的影响
根据化学反应平衡原理,反应气中CO2浓度高,不利于Boudouard 反应(3)的正向进行。因此,当反应气中CO2浓度为0 时,Boudouard 反应最容易进行。故对CO2浓度为0 的极端情况进行研究。此外,反应气中CO 浓度越高,Boudouard 反应越容易进行;且根据表1,气体反应物中SO2浓度对Boudouard 反应进行程度没有影响。因此,主要对高CO 浓度和CO2浓度为0 的极端情况进行研究。图2 给出了气体反应物中CO 浓度99.0%、CO2和SO2浓度为0 时,不同反应温度下Boudouard 反应、CaSO4-CO 竞争反应[图1 中(1)和(2)]的CO 平衡转化率。由图2 可见,当反应温度低于400 ℃,Boudouard 反应非常容易进行;随着反应温度的提高,CO 平衡转化率单调下降,特别是在650~800 ℃温度范围,CO 平衡转化率从72.0%降到19.0%,降幅较大。当反应温度从850 ℃提高到1050 ℃,CO 平衡转化率仅为7.1%~0.5%;进一步增加反应温度,CO 平衡转化率降幅变缓。

表1 相关反应单独进行时的CO 平衡转化率
对于CaSO4还原反应[图1 中(1)和(2)],当反应温度为1101 ℃时,主、副反应的CO 平衡转化率曲线相交于一点;进一步提高反应温度,则副反应的CO 平衡转化率略大于主反应,如图2 所示。即当反应温度低于1101 ℃,CaS 生成反应(CaSO4还原主反应)的CO 平衡转化率较高,达99.9%~98.0%;而当反应温度超过1101 ℃,CaO生成反应(CaSO4还原副反应)的CO 平衡转化率则较高,达到了97.9%~99.3%。因此,即使当气体反应物中无CO2,且CO 浓度99.0%,相比较于CaSO4-CO 竞争反应,在化学链燃烧燃料反应器适宜温度范围(850~1050 ℃),CO 歧化为CO2和单质C 的Boudouard 反应进行程度是非常有限的;这说明CO 容易通过CaSO4竞争还原反应被消耗掉,而参与Boudouard 反应的CO 量少。但是,需要避免局部温度过低引起的CO 歧化反应。

图2 不同反应温度下相关反应的CO 平衡转化率 (气体反应物中CO 浓度99.0%,CO2 和SO2 浓度0)
2.2 气体反应物中SO2 浓度对单个反应CO 平衡转化率的影响
图3给出了950℃、气体反应物中CO浓度20%、CO2浓度70%、SO2浓度在0~10%变化时,单个反应CO 平衡转化率的变化规律。可见,随着SO2浓度的提高,CaO 生成反应的CO 平衡转化率单调减少,而CaO 生成反应和Boudouard 反应的CO 平衡转化率不变,故在计算分析中,取SO2浓度为0,从而在更大CO 和CO2浓度范围展开研究。
2.3 气体反应物中CO 浓度对单个反应CO 平衡转化率的影响
图4 给出了950 ℃、气体反应物中CO2和SO2浓度为0、CO 浓度在0.5%~99%范围变化时,单个反应CO 平衡转化率的变化规律。由图4 可见,对于CaSO4还原反应[图1 中(1)和(2)],当气体反应物中CO 浓度为4.2%,CaSO4还原主、副反应的CO 平衡转化率曲线相交于一点;进一步提高CO 浓度,则主反应CO 平衡转化率大于副反应。即当气体反应物中CO 浓度低于4.2%时,CaO 生成反应(CaSO4还原副反应)的CO 平衡转化率则较 高,达到了99.8%~98.3%;而当CO 浓度超过4.2%时,CaS 生成反应(CaSO4还原主反应)的CO 平衡转化率较高,且基本保持不变(98.8%)。

图3 不同SO2 浓度下相关反应的CO 平衡转化率 (950 ℃,气体反应物中CO 浓度20%,CO2 浓度70%)
由图4 可见,当CO 浓度从0.5%增加到99.0%,Boudouard 反应CO 平衡转化率略有提高,但是仍然较小,仅从8.97×10-5增加到1.73%。这也进一步说明当气体反应物中无CO2时,即使气体反应物中CO 浓度较高,CO 容易通过CaSO4竞争还原反应被消耗掉,而参与Boudouard 反应的CO 量少。
此外,图5 给出了950 ℃、气体反应物中CO2浓度20%、SO2浓度10%、CO 浓度在0.5%~70%范围变化时,单个反应CO 平衡转化率的变化规律。对比图4 和图5,可见反应气中CO2的存在限制了Boudouard 反应的进行。
因此,本节理论计算表明,在950 ℃、20%CO浓度、反应气中无CO2时,Boudouard 反应CO 平衡转化率为0.36%,即CO-C 的转化率为0.36%。然而,由于CaSO4还原反应较容易进行,生成的CO2将抑制Boudouard 反应的进行;并且,根据本文2.4 节分析结果,在950 ℃、CO 浓度20%下,当反应气氛中CO2浓度超过0.036%,Boudouard 反应不能进行,固体产物中无积碳生成。对比张璐 等[15]的实验研究结果,可以看出理论计算与实验结果吻合好。
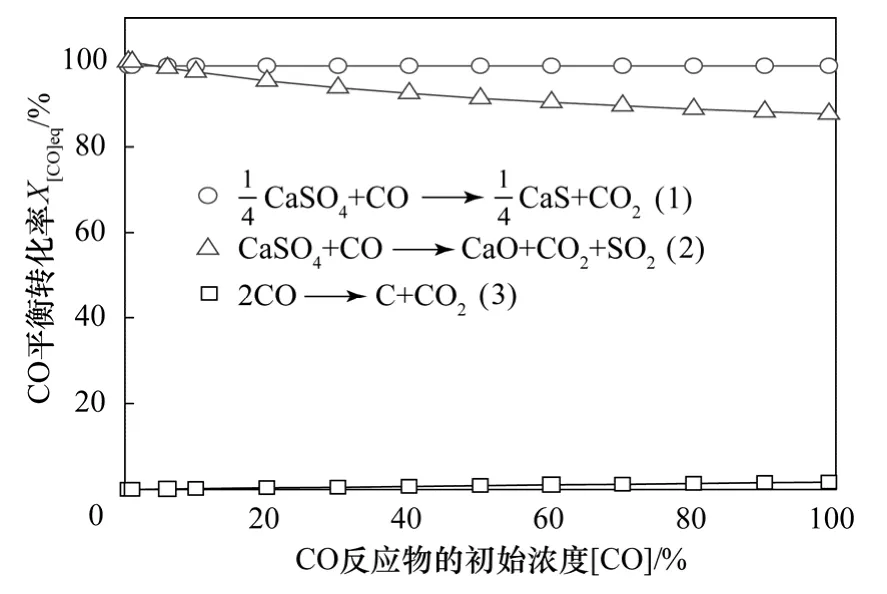
图4 不同CO 浓度下相关反应的CO 平衡转化率 (950 ℃,气体反应物中CO2 和SO2 浓度0)

图5 不同CO 浓度下相关反应的CO 平衡转化率 (950 ℃,气体反应物中CO2 浓度20%,SO2 浓度10%)
2.4 气体反应物CO2浓度对单个反应CO 平衡转化率的影响
图6 给出了950 ℃、气体反应物中CO 浓度20%、SO2浓度0、CO2浓度在0~70%范围变化时,单个反应CO 平衡转化率的变化规律。由图6 可见,随气体反应物中CO2浓度的提高,CaS 和CaO 生成反应的CO 平衡转化率呈线性减少,其中CaO 生成反应的下降趋势更明显;这说明提高气体反应物中CO2浓度,有利于抑制CaO 的生成和SO2的释放。而对于Boudouard 反应,由图6 可见,当气体反应物中CO2浓度为0.036%,CO 平衡转化率为0。因此,即使反应物中没有CO2,在反应过程中,由于CO 容易通过CaSO4还原反应转化成CO2,当反应气氛中 CO2浓度超过 0.036%,能完全限制Boudouard 反应的进行。
在化学链燃烧燃料反应器适宜温度范围(850~1050 ℃),在CO 还原CaSO4的反应初始和反应末期,由于反应气氛中没有CO2或者有极少量CO2,CO 可能会发生Boudouard 反应,歧化分解为CO2和C。但是,一方面受化学反应热力学的限制,这个反应进行的程度低;另一方面,通过在反应气体中加入少量的CO2,Boudouard 反应的进行将会被完全抑制。

图6 不同CO2 浓度下相关反应的CO 平衡转化率 (950 ℃,气体反应物中CO 浓度10%,SO2 浓度0)

图7 不同反应温度、不同CO 浓度Boudouard 反应的CO2临界浓度
向气体反应物中加入一定量的CO2,Boudouard反应的CO 平衡转化率变为0,那么该CO2浓度称为临界浓度。该CO2临界浓度仅取决于Boudouard 反应的平衡常数、反应温度和气体反应物CO 浓度。不同反应温度、不同CO 浓度下Boudouard 反应的CO2临界浓度点如图7 所示。由图7 可见,在反应温度850~1050 ℃,气体反应物中CO 浓度0.5%~95.0%范围,当反应气氛中CO2浓度超过3.7%,Boudouard 反应不能进行。
3 结 论
围绕化学链燃烧的应用,在较宽CO 浓度范围(0.5%~99.0%)、不同反应温度(500~1200 ℃)、不同CO2浓度(0~70%)和SO2浓度(0~10%)下,利用化学平衡常数,对 CaSO4与CO 反应过程中Boudouard 反应的可行性展开热力学研究,获得了抑制Boudouard 反应的方法。由于CaSO4竞争还原反应和Boudouard 反应平衡常数的表达形式不同,通过计算各个反应的CO 平衡转化率以来判断各个反应进行程度的高低。主要结论如下所述。
(1)提高CO 初始浓度,Boudouard 反应的进行程度提高。反应物中SO2浓度对Boudouard 反 应的进行程度没有影响。提高反应温度和反应气 中CO2浓度,则有利于抑制Boudouard 反应的 进行。
(2)在化学链燃烧燃料反应器适宜反应温度850~1050 ℃、反应气中CO 浓度0.5%~99.0%条件下,当反应气中无CO2,CaSO4还原反应和Boudouard 反应达到平衡时,CO 平衡转化率分别为99.9%~99.3%和7.1%~0.5%。CO 容易通过CaSO4竞争还原反应被消耗掉,而参与Boudouard 反应的CO 量少。并且,当气体反应物中CO2浓度超过3.7%,即使CO 浓度达到95.0%,Boudouard 反应不能发生,无积炭生成。
符 号 说 明
[CO]—— 气体反应物中CO 浓度,%
[CO2]—— 气体反应物中CO2浓度,%
Kp—— 平衡常数
Q—— 气体反应物,mol
R—— 理想气体常数,kJ/(mol·K)
[SO2]—— 气体反应物中SO2浓度,%
T —— 反应温度,℃
X[CO]eq—— CO 平衡转化率,%
[1] 金红光. 热力循环及总能系统学科发展战略[J]. 中国科学院院刊,2006(4):313-319.
[2] Tian H,Simonyi T,Poston J,et al. Effect of hydrogen sulfide on chemical looping combustion of coal-derived synthesis gas over bentonite-supported metal-oxide oxygen carriers[J]. Industrial & Engineering Chemistry Research,2009,48(18):8418-8430.
[3] Zhao H,Liu L,Wang B,et al. Sol-gel-derived NiO/NiAl2O4oxygen carriers for chemical-looping combustion by coal char[J]. Energy & Fuels,2008,22(2):898-905.
[4] Shen L,Wu J,Gao Z,et al. Characterization of chemical looping combustion of coal in a 1kWth reactor with a nickel-based oxygen carrier[J]. Combustion and Flame,2010,157(5):934-942.
[5] 李新爱,何方,赵坤,等. 钙钛矿型氧化物LaFeO3的制备及甲烷化学链燃烧性能[J]. 天然气化工:C1 化学与化工,2012(6):1-2.
[6] 王钰佳,梁皓,张喜文,等. 化学链燃烧中LaNixFe(1-x)O3载氧体的性能研究[J]. 中国稀土学报,2013(1):96-101.
[7] 张帅,肖睿,杨一超,等. 基于废铁渣载氧体煤加压化学链燃烧试验研究[J]. 工程热物理学报,2011(6):1073-1076.
[8] 肖海平,周俊虎,曹欣玉,等. CaSO4在CO 气氛下的平行竞争反应实验与模型研究[J]. 燃料化学学报,2005,33(2):150-154.
[9] 郑敏,沈来宏,肖军. 化学链燃烧钙基载氧体CaSO4与CO 在不同温度下的反应行为[J]. 化工学报,2008(11):2812-2818.
[10] Gururajan V S,Agarwal P K,Agnew J B. Mathematical model of fluidized bed coal gasification [J]. Chemical Engineering Research & Design,1992(70):211-238.
[11] 郑瑛,王保文,宋侃,等. 化学链燃烧技术中新型氧载体CaSO4的特性研究[J]. 工程热物理学报,2006,27(3):531-533.
[12] Shen L,Zheng M,Xiao J,et al. A mechanistic investigation of a calcium-based oxygen carrier for chemical looping combustion[J]. Combustion and Flame,2008,154(3):489-506.
[13] 沈来宏,肖军,肖睿,等. 基于CaSO4载氧体的煤化学链燃烧分离CO2研究[J]. 中国电机工程学报,2007(2):69-74.
[14] Zheng M,Shen L,Xiao J. Reduction of CaSO4oxygen carrier with coal in chemical-looping combustion:Effects of temperature and gasification intermediate[J]. International Journal of Greenhouse Gas Control,2010,4(5):716-728.
[15] 张璐,朱义成. 氧载体CaSO4与CO 的化学链循环试验研究[J]. 热能动力工程,2010(5):534-538.
[16] 叶大伦,胡建华. 实用无机物热力学数据手册[M]. 北京:冶金工业出版社,2002.

