高分子量裂褶菌多糖发酵培养基的优化组合
张虽栓,王 霞
(河南质量工程职业学院食品与化工系,河南平顶山467000)
高分子量裂褶菌多糖发酵培养基的优化组合
张虽栓,王 霞
(河南质量工程职业学院食品与化工系,河南平顶山467000)
目的:优选高分子量裂褶菌多糖的培养基的最佳组合.方法:对提高高分子量裂褶菌多糖的质量分数的培养基组合进行了单因素和正交试验研究,以确定最佳实验条件.结果:KH2P04浓度为0.3%、3-吲哚丁酸的浓度为0.04%;发酵培养条件的选择是:接种量为13%(V/V).结论:高分子量裂褶菌在优化的培养基和发酵培养条件下得到高分子量裂褶菌多糖的质量分数达1.768%.
裂褶多糖;分离纯化;培养;正交试验
裂褶菌(SchizophyllumcommuneFr.简称SPG)是一种珍贵的药食兼用真菌,裂褶菌胞外多糖是菌体经深层发酵产生的中性胞外多糖,由单一的β-(1-3)-D-葡聚糖组成的螺旋结构和良好的水溶性,在调节免疫功能、抗肿瘤、抗辐射等方面有显著的疗效[1],经硫酸酸化后具有抗HIV活性,能抑制HIV-1产生的细胞裂变[2].其分子量从十几万到上百万不等.然而,SPG的结构和分子量不同严重影响其生物学活性及应用.文献报道,裂褶胞外多糖的相对分子质量多在80-100kDa[3-6]之间,而分子量在100kDa以上的裂褶菌多糖具有较强的抗肿瘤活性,在医药领域的应用最为广泛,需求量最大[7].我们在微生物发酵技术研究的基础上,利用正交试验的方法优化培养基的组合,改进培养工艺,提高裂褶菌多糖的质量分数,为裂褶菌菌的产业化栽培和进一步的开发应用提供支持.
1 材料与方法
1.1 材料与试剂
裂褶菌种:昆明科技开发有限公司提供.
1.2 设备与仪器
恒温摇床:中国科学院武汉科学仪器厂;
HZQ-F280全温度振荡培养箱:太仓市华美生化仪器厂;
真空干燥箱2K-82A型:上海市实验仪器总厂;
pH计320-S型:METTLERTOLED;
UV-2102PC紫外——可见分光光度计:德国Bruker公司;
1.3 实验方法
1.3.1 培养条件
裂褶菌种采用PDA固体培养基,培养基是由马铃薯180g/L,KH2PO42.8g/L,葡萄糖18g/L,Mg-SO4.7H2O1.4g/L,蛋白胨4.9g/L,pH=5.8,琼脂20 g/L组成.配好的PDA培养基装在试管中,于140℃时灭菌20Min,冷却,将菌种接种到试管斜面培养基上,静置、活化4d,活化后的菌种接入装有50ml培养基的锥形瓶中,28℃下培养1.5d,得液体菌种;接着接种到固体培养基27℃下,培养,7d,菌丝长满后备用[8,9].
1.3.2 裂褶菌多糖百分含量测定方法
裂褶菌多糖百分含量的测定方法:采用常用的苯酚-硫酸比色法测定[10].
2 结果与讨论
2.1 培养基的优化
不同培养基的选择对高分子量裂褶菌多糖质量分数有直接的影响,设定了碳源、氮源、KH2PO4、3-吲哚乙酸(IBA)四个因素对高分子量裂褶菌多糖培养基的选择进行了试验.
2.1.1 最佳碳源作为培养基对高分子量裂褶菌多糖质量分数的影响
实验选取了1.葡萄糖(10%)、2.蔗糖(10%)、3.麦芽糖(10%)、4.葡萄糖(10%)+羧甲基纤维素(1%)、5.玉米淀粉、6.果糖(10%)作为待选碳源[11-12].发酵完成后,测定多糖含量;结果如图1表明,葡萄糖(10%)+羧甲基纤维素(1%)是该菌种发酵生产的最佳碳源,多糖产量可达1.8%.
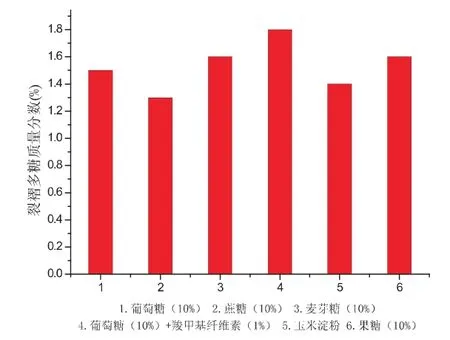
图1 不同碳源对裂褶菌多糖质量分数的影响
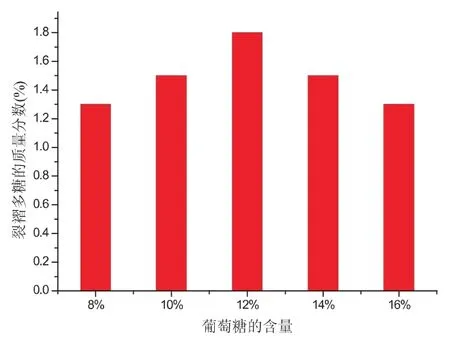
图2 葡萄糖含量对裂褶菌多糖质量分数的影响
最佳碳源浓度的大小对菌体的生长速度、代谢、产物的合成以及氧气的流通量多少都会造成影响.若碳源用量过少,菌体生长和产物合成都会停止,反之,则会出现抑制生长的现象.如图2所示,在葡萄糖浓度偏低或偏高时都会对菌体生长及多糖的合成形成抑制,使合成速率减慢,导致质量分数降低.因此,碳源浓度的大小对微生物发酵生长具有相当重要的作用.经单因素分析,该实验选用12%的葡萄糖做为最佳碳源.

图2 葡萄糖含量对裂褶菌多糖质量分数的影响
2.1.3 KH2PO4的浓度对高分子量裂褶菌多糖多糖含量的影响
从图3可知,KH2P04的浓度对裂褶菌多糖产量的影响表现出最适浓度效应.随着KH2P04浓度的增加,裂褶菌多糖的质量分数也在不断的提高,当KH2P04浓度达一定值后继续升高时,裂褶菌多糖的质量分数则降低,因此,KH2P04最适添加量为0.3%.
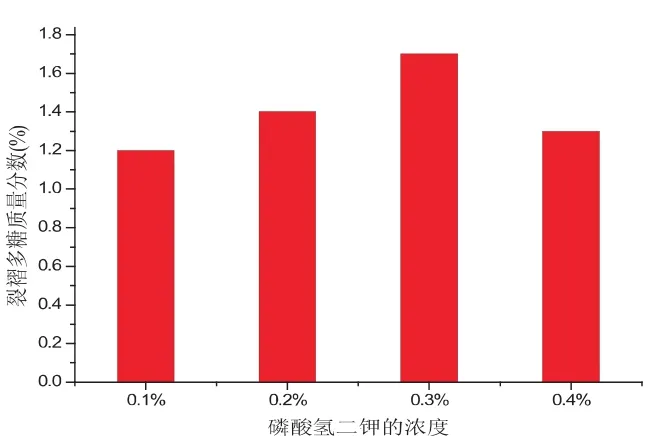
图3 KH2P04的含量对裂褶菌多糖产量的影响
2.1.4 3-吲哚乙酸的浓度对高分子量裂褶菌多糖多糖含量的影响
3-吲哚丁酸是一种植物细胞生长促进剂,它能够刺激植物细胞快速生长,分别以3-吲哚丁酸添加量为0.02%、0.05%、0.1%和0.15%在培养基进行培养,结果见图4.
由图4可知,开始,随IBA含量的不断提高,裂褶菌多糖的产量也随之增加,但当IBA浓度过高时又降低了裂褶菌多糖的产量,故IBA含量对裂褶菌多糖促进作用的最佳浓度分别为0.04%.
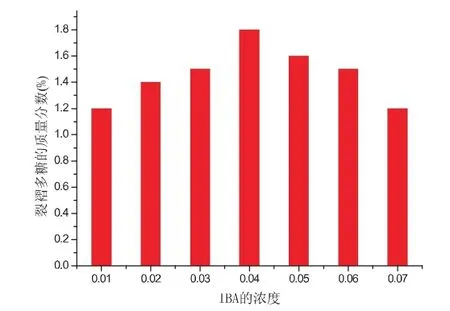
图4 IBA的含量对裂褶菌多糖质量分数的影响
2.1.5 发酵培养条件的正交试验优化
表1培养基优化的正交试验因素及水平表
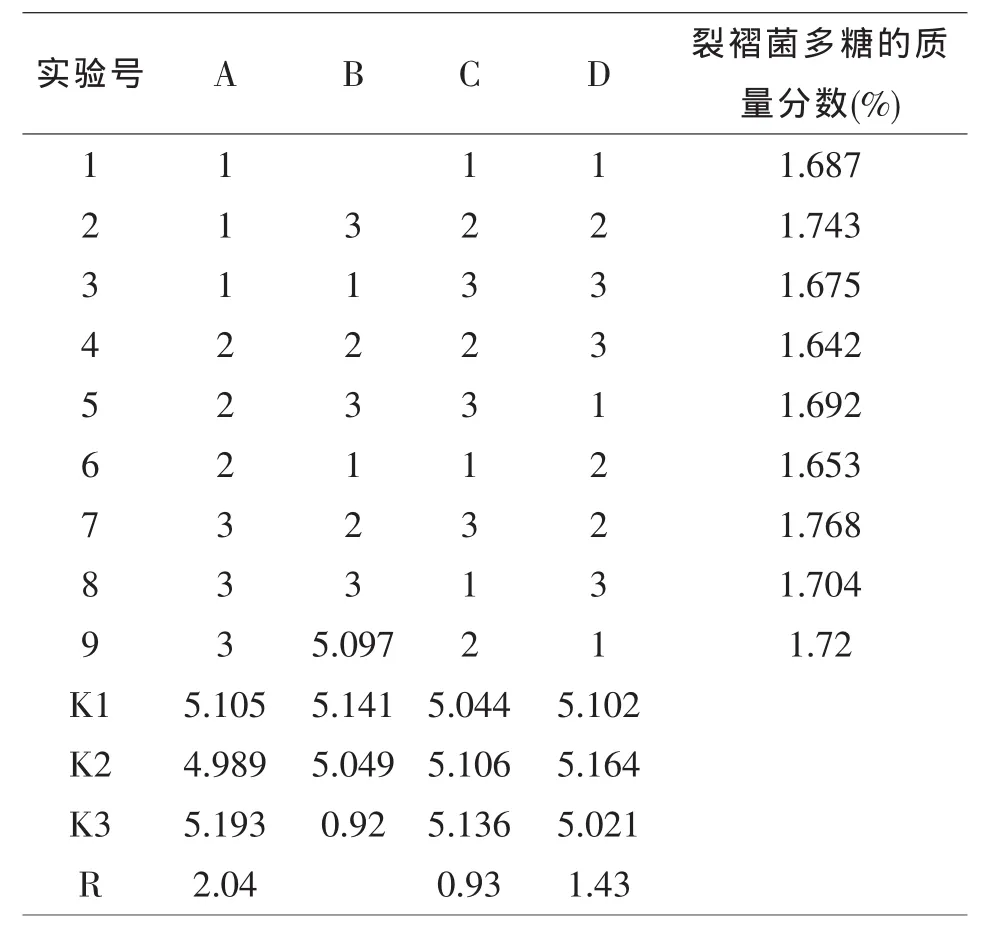
表1 正交设计试验结果
由表1正交试验数据可以看出,实验得到裂褶菌多糖的质量分数最高达到1.768%,最佳水平组合是A3B2C3D2,根据表中极差R的分析,各个因素对裂褶菌多糖质量分数的影响顺序是A>D>C>B,因此,最佳组合为A3B2C3D2.即加人葡萄糖的含量达12%,酵母粉含量达0.8%,KH2P04的含量达0.3%,3-吲哚丁酸的含量为0.04%.
3 裂褶菌多糖的纯化与分子量的测定
3.1 裂褶菌多糖的纯化
经过发酵培养的菌丝体→粉碎→热水浸泡→乙醇多次沉淀→洗涤→热水溶解→过滤,浓缩→粗多糖→活性炭褪色→Sevag法脱蛋白→裂褶菌多搪纯品.
3.2 裂褶菌多糖分子量的测定
裂褶多糖分子量的测定:采用高效凝胶色谱法,利用标准多糖溶液绘制标准洗脱曲线,再根据裂褶菌多糖的洗脱曲线与标准洗脱曲线做比较,查表可知,所得多糖的分子量约为510kDa.
4 结论
(1)经单因素实验确定了裂褶菌生长最适宜的培养基成分为:以0.8%酵母粉和0.2%NH4NO3为混合氮源,3-吲哚丁酸的浓度为0.04%,KH2P04浓度为0.3%,以12%的葡萄糖为最佳碳源时,裂褶多糖的提取率最高.
(2)用高效凝胶色谱分析确定样品单糖组分为具有良好水溶性的β-(1-3)-D葡聚糖,分子量约为510kDa.研究可知:裂褶菌多糖在调节免疫功能、抗肿瘤和抗辐射活性均与多糖的结构和相对分子质量的大小有关,较大分子量的裂褶多糖才具有更加显著地抗肿瘤和辐射活性,本实验为后期研究高分子量裂褶多糖的培养和在药用领域的开发奠定了理论基础.
〔1〕邵伟.从野生担子菌筛选抗肿瘤多糖的试验研究[J].天津师范大学学报(自然科学版),1996,16(4):44-49.
〔2〕Haslin C,Lahaye M,Pellegrini M,et al.Invitro anti-HIV activity of sulfated cell-wall polysaccharides from gametic,carposporic and tetrasporic stages of the M iditerranean red alga Asparagopsis armata.Planta Med,2001,67:301~305.
〔3〕Udo Rau.Production of schizophyllan,in:M ethods in Biotechnology Carbohydrate Biotechnology Protocols(Bucke,C.Ed)[M].Totowa,NJ,USA:Humana Press,Inc,1999.43-57.
〔4〕钟昕,周素梅,王强.裂褶菌多糖固体发酵制备及辐照改性.[D].北京:中国农业科学院,2010.
〔5〕FururH.Biological characterstics and clinical effect of Sizofilan(SPG)[J].J MED Actual,1987,23:335-46.
〔6〕冀颐之,杜连祥.深层培养裂褶菌胞外多糖的提取及结构研究[J].微生物学通报,2003(5):15-20.
〔7〕Katrina Tikkanen,Jukka Hayrinen,Sinikka Pelkonen,Jukka Finne.Immunoblot analysis of bacterial polysaccharides:application to the type-specific polysaccharides of Streptococcus suis and Streptococcus agalactige.Journal of Immunological Methos.1995,187:233-244.
〔8〕常景玲,李慧,潘静.裂褶菌胞外多糖发酵工艺的优化[J].食用菌,2006(增刊):78-80.
〔9〕赵琪,袁理春,李荣春.裂褶菌研究进展[J].食用茵学报,2004(11):59-63.
〔10〕Dubois M,Gilles K A,Ham ilton J K,et a1.Colorimetric method for determ ination of Sugars and related substances[J].Analytical Chem istry,1956(28):350-356.
〔11〕高丽君,王汉忠,崔建华等.苯酚一硫酸法测定自首乌中多糖含量[J].山东农业大学学报,2004,35(2):295-297.
〔12〕周林,郭祀远,蔡妙颜,等.粘度法测定水溶液中裂褶多糖分子量[J].功能高分子学报,2005(12):692-695.
〔13〕Takede M,Nomoto S,Koizum J.Structural analysis of the extracellularpolysaccharide produced by Sphaerotilus natans.Biosci Biotechnol Biochem,2002,66(7):1546~1551.
〔14〕刘翠平,方积年.质谱技术在糖类的分离和结构分析中的应用[J].分析化学,2001,29(6):716~720.
〔15〕叶诚.高分子量裂褶多糖的制备与结构鉴定[M].华中科技大学,2007.26-28.
〔16〕周林,郭祀远,蔡妙颜,等.粘度法测定水溶液中裂褶多糖分子量[J].功能高分子学报,2005(12):692-695.
〔17〕Takede M,Nomoto S,Koizum J.Structural analysis of the extracellularpolysaccharide produced by Sphaerotilus natans.Biosci Biotechnol Biochem,2002,66(7):1546-1551.
〔18〕刘翠平,方积年.质谱技术在糖类的分离和结构分析中的应用[J].分析化学,2001,29(6):716-720.
〔19〕叶诚.高分子量裂褶多糖的制备与结构鉴定[M].华中科技大学,2007.
S646
A
1673-260X(2013)12-0060-03

