高产谷胱甘肽酿酒酵母的选育及发酵工艺的研究
刘 哲,詹良静,张新宜,王欣荣
(中国医药集团总公司四川抗菌素工业研究所,四川成都 610052)
谷胱甘肽(Glutathione,GSH)是由L-谷氨酸、L-半胱氨酸和甘氨酸经肽键缩合而成的一种同时具有γ-谷氨酰基和巯基生物活性的三肽化合物,具有氧化型和还原型两种形态,可应用于医药及食品领域的是其还原态[1]。还原型谷胱甘肽具有重要的生理功能,例如抗氧化功能、对外来物质的解毒功能和提高免疫力的功能,临床上多作为保肝类药物使用[2]。谷胱甘肽的生产方法主要有化学合成法、生物法和提取法3种[3]。由于化学合成法得到的GSH消旋体(左旋体和右旋体的混合物)需要进行光学拆分,分离十分困难且容易造成环境污染,因此化学合成法获得的GSH产品纯度不高。提取法主要是通过萃取和沉淀的方法从含有GSH的动植物组织中分离提取,但是由于GSH在组织中含量极低、原料不易获得、制取的GSH纯度和收率不高等原因,导致该法的实际应用价值不大[3]。生物法包括微生物发酵法和酶法,目前国外工业化生产GSH的主要方法是微生物发酵法,所应用的菌种是酿酒酵母和产朊假丝酵母等能够大量积累GSH的菌株[4-5]。发酵法生产GSH的关键问题在于如何在提高细胞密度的同时加大细胞内GSH含量,二者有机结合将有利于生产效率的提高[6]。菌种选育是一种切实可行的提高胞内GSH含量的方法,普通野生型酵母细胞内GSH的含量并不高,只有采用物理的或化学的方法使出发菌株发生变异,才能使GSH在胞内大量积累,进而实现GSH的高产[7]。在选育到优良菌株的同时,还需要在发酵过程中设法提高细胞密度,以提高GSH的总产量。补料分批发酵是获得酵母高细胞密度培养的最有效方法。在发酵过程中补入3种前体氨基酸将有利于提高胞内GSH含量,进而提高GSH产量[8-9]。本实验以酿酒酵母作为出发菌株,通过紫外诱变结合乙硫氨酸和氯化锌的底物选择筛选高产GSH酿酒酵母菌株,并利用10 L发酵罐研究了酿酒酵母高密度发酵工艺和前体氨基酸补加工艺。
1 材料与方法
1.1 材料
1.1.1 菌种 出发菌株:酿酒酵母(Saccharomyces cerevisiae)SC-001,由本研究组保藏。
1.1.2 培养基 ①平板及斜面培养基(g/L):葡萄糖20,酵母提取物10,蛋白胨20,琼脂20,pH自然;②种子培养基(g/L):葡萄糖20,酵母提取物10,蛋白胨20,pH自然;③发酵培养(g/L):甘蔗糖蜜120,(NH4)2HPO49,复合氨基酸5,甘氨酸2,半胱氨酸5,KH2PO40.4,MgSO4·7H2O 0.3,ZnCl20.5,pH自然;④乙硫氨酸氯化锌选择平板培养基:普通平板培养基+乙硫氨酸+氯化锌。
1.1.3 试剂与仪器 乙硫氨酸购自Sigma公司,其余试剂均为国产分析纯。2010-LC型高效液相色谱仪(岛津)、10 L微生物发酵罐(上海高机生物工程有限公司)。
1.2 方法
1.2.1 培养方法 从活化的菌种斜面上挑取1环菌体接种至种子培养基中,培养温度30℃,摇床转速280 r/min,培养至对数生长期进行紫外诱变。
1.2.2 诱变方法 取10 mL培养至对数期的酿酒酵母菌株,4 000 r/min离心10 min收集菌体,用无菌生理盐水洗2次,加入无菌生理盐水制成菌悬液,梯度稀释至菌体浓度在107cfu/mL左右,取5 mL菌悬液放置在直径为9 cm的培养皿中,在30 W紫外灯下距离30 cm照射一定时间,梯度稀释并取0.1 mL涂布于平板培养基上(整个过程在红外灯下操作)。30℃培养48 h后通过活菌数计算致死率。
1.2.3 筛选方法 紫外诱变的菌悬液经梯度稀释后取0.1 mL涂布到含有乙硫氨酸和氯化锌的抗性筛选平板上,避光条件下30℃培养48 h,挑取生长快、菌落大的菌株至斜面培养基,30℃培养48 h后接种至发酵培养进行摇瓶发酵培养,经72 h发酵后测定谷胱甘肽含量。
1.2.4 10L发酵罐发酵方法 将培养24 h的种子以10%接种量接入发酵罐,发酵罐装液量为6 L,培养温度30℃,搅拌速度300 r/min,通气量为6 L/min。①一次性补料发酵:当发酵进行到18 h时一次性补入800 mL 50%的葡萄糖;②补料分批发酵:当发酵进行到18 h时自动控制发酵液的pH值为5.5,根据发酵液pH的变化流加500 g/L的葡萄糖和10%的氨水,当pH降低时加入氨水使pH升高,当pH超过5.5时则补入葡萄糖;③补料分批发酵结合前体氨基酸的补加:在补料分批发酵的基础上,当菌丝量达到较高程度时一次性补入适量的半胱氨酸、甘氨酸和谷氨酸。实时监控发酵过程中的pH并通过取样检测发酵过程中的生物量、还原糖浓度、细胞内GSH含量与GSH产量。
1.2.5 分析方法 ①胞内GSH的提取发酵液经4 000 r/min离心10 min后弃上清,加入10 mL去离子水,震荡混匀后100℃水浴15 min,离心(12 000 r/min)4 min后取上清液用于HPLC分析;②HPLC条件:色谱柱 C18柱(4.6 mm×150 mm),流动相57 mmol/L磷酸二氢钾溶液(含庚烷磺酸钠0.2%,用磷酸调节pH为3)-甲醇(30∶1),流速0.5 mL/min,检测波210 nm,柱温35℃,进样量10 μL;③细胞干重的测定:发酵液经4 000 r/min离心10 min后弃上清,用蒸馏水洗涤2遍,洗涤后的细胞在90℃烘干至恒重后称重。
2 结果与分析
2.1 紫外线诱变
2.1.1 紫外线诱变致死率及不同浓度乙硫氨酸和氯化锌对菌株的致死率 按1.2.2方法对菌体进行紫外线诱变处理,统计不同照射时间下菌体的致死率,同时取未经照射的出发菌株为对照组。结果见图1。
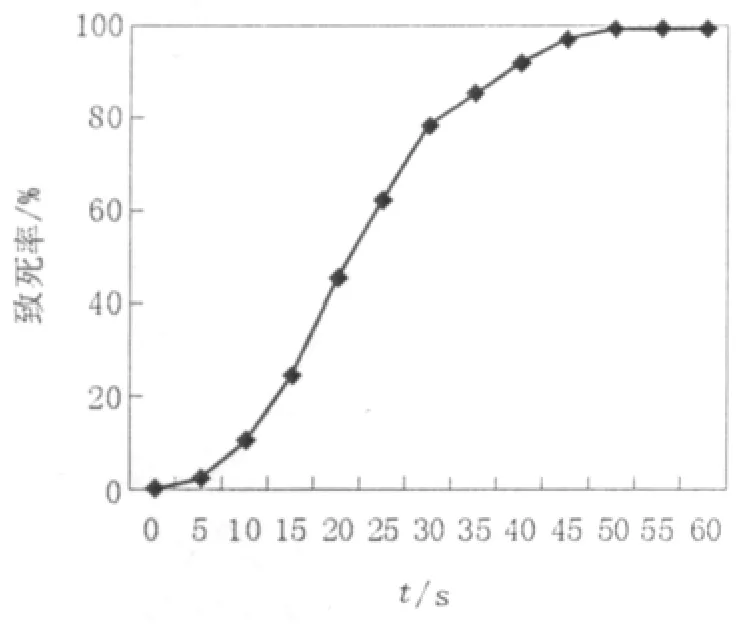
图1 紫外线诱变的致死率曲线Fig.1 The mortality rate curve of UV radiation
如图1所示,紫外线的照射时间与菌株的致死率存在明显的剂量效应关系,随着照射时间的延长,致死率逐渐提高。但如果照射时间太长,一些高活性菌株也可能致死,故一般选用致死率70%~80%左右的剂量。由图1可以看出紫外照射时间为30 s时致死率达到78%,因此选择30 s为适宜的紫外照射时间。乙硫氨酸是GSH的结构类似物,由于菌体内GSH可反馈抑制谷氨酰半胱氨酸合成酶的活性,故可使用乙硫氨酸作为底物筛选反馈抑制突变株;Zn2+是酵母细胞内多种酶的辅酶或辅基,低浓度时可促进酵母的生长,高浓度时可抑制多种酶的活性,从而引起酵母细胞的死亡[7,10]。不同浓度的乙硫氨酸和氯化锌对菌株的致死率如表1所示。
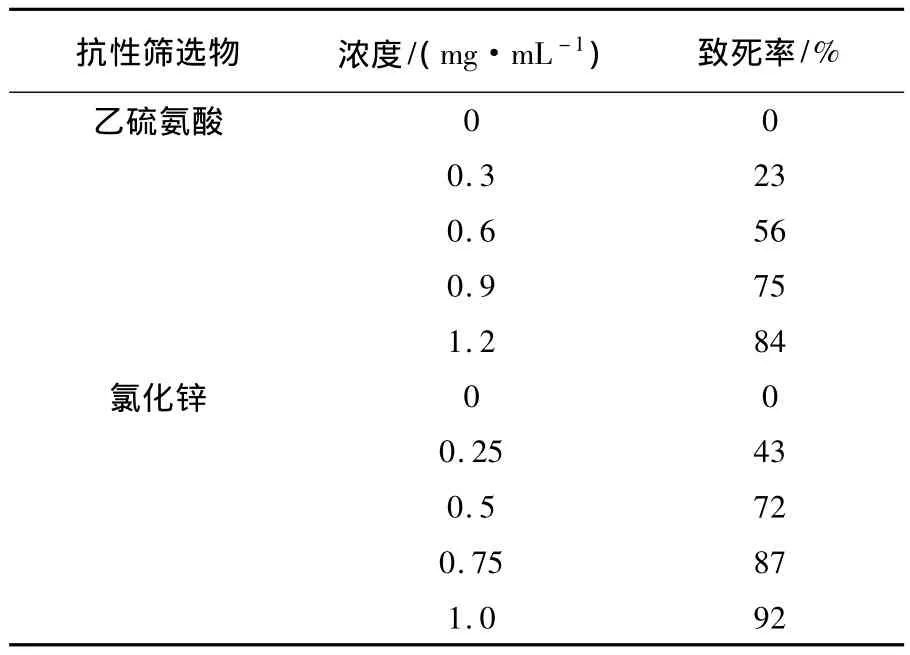
表1 不同浓度的乙硫氨酸和氯化锌对菌株的致死率Table1 The mortality rate of different concentrations of ethionine and zinc chloride to the strain
如表1所示,当乙硫氨酸浓度为0.9 mg/mL时,菌株致死率为75%;当ZnCl2浓度为0.5 mg/mL时,菌株致死率为72%。进一步实验确认当0.9 mg/mL乙硫氨酸与0.5 mg/mL的ZnCl2联合使用时菌株的致死率为86.5%,致死率太高不利于高产GSH酵母菌株的筛选,故使用0.7 mg/mL的乙硫氨酸与0.4 mg/mL的ZnCl2,进一步实验确认此浓度下菌株的致死率为73%,适用于下一步筛选。
2.1.2 紫外诱变结果 按1.2.3方法对诱变得到的酵母菌株进行筛选,出发菌株作为对照。初筛得到145株酵母,经发酵有63个菌株的GSH产量高于出发菌株,正变率达43.4%。选取GSH产量提高12%以上的11株酵母进行复筛,复筛结果见表2。
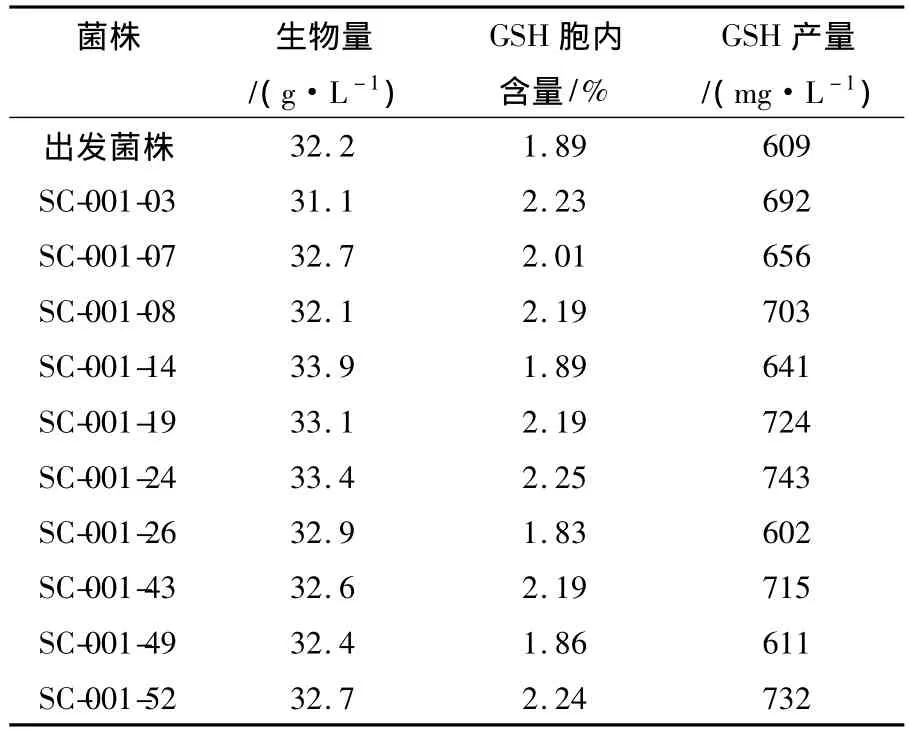
表2 紫外诱变高产GSH突变株复筛Table2 The rescreening of the mutant strain with higher GSH production
由表2可知,菌株SC-001-24的GSH产量比出发菌株提高22%,胞内GSH含量比出发菌株提高了19%。将SC-001-24连续传代6次,每次进行摇瓶发酵培养,观察其遗传稳定性,在几次传代中,突变株SC-001-24的谷胱甘肽产量都比出发菌株提高18%以上,显示了良好的遗传稳定性,故使用突变株SC-001-24作为后续研究的出发菌株。
2.2 10 L发酵罐发酵结果
2.2.1 一次性补料发酵 GSH是胞内产物,其产量可以通过两个途径提高,一是采用高密度细胞培养技术提高其生物量;二是提高胞内GSH含量[6]。按1.2.4的方法进行一次性补料发酵,图2是一次性补料发酵的参数曲线,由图2可见发酵第18 h补加葡萄糖后发酵液中还原糖浓度由27 g/L上升至84 g/L,如此高浓度的还原糖能保证整个发酵过程中菌体对糖的需要。一次性补料发酵在一定程度上类似于对摇瓶发酵的模拟,这种发酵方式并不能充分发挥发酵罐精确控制的优势,也很难达到细胞高密度培养的目的。由图2可知在发酵进行到18 h后发酵液的pH一直低于4,这种过酸性的环境不利于细胞的生长;细胞最大生物量出现在第48 h,为34.5 g/L;GSH最高产量在54 h,为402.4 mg/L;细胞内GSH含量最高达到1.21%。从发酵结果来看,GSH产量与细胞生物量均过低,远不能满足工业化生产的需要。
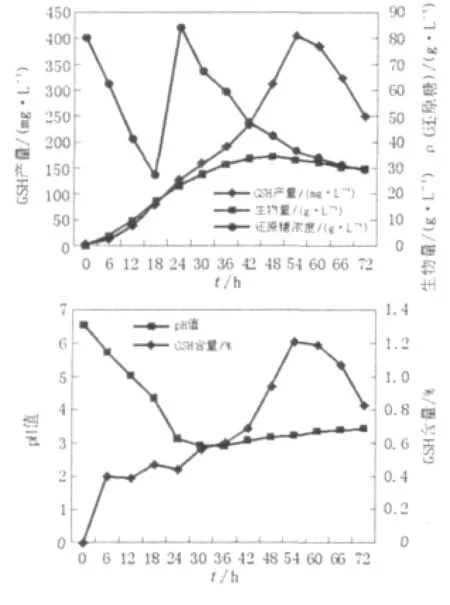
图2 一次性补料发酵曲线Fig.2 The course of batch culture
2.2.2 补料分批发酵 发酵罐在通气量控制、补料控制、pH控制等方面具有摇瓶试验无法比拟的优势,通过将发酵液pH控制在5.5的恒PH发酵具有缓和底物抑制、富集高浓度细胞、克服Crabtree效应以及延长操作时间等优点[6,11]。按1.2.4的方法进行补料分批发酵,根据发酵液pH的变化流加500 g/L的葡萄糖和10%的氨水,使发酵液中始终保持较低的葡萄糖浓度,至60 h流加结束,72 h培养结束。由图3可知,pH自动控制在5.5之后,大部分时间还原糖的浓度低于10 g/L,远远低于一次性补料发酵时的还原糖最低水平,这种低还原糖控制策略减少了乙醇的生成,而发酵过程中乙醇的产生是不利于GSH在细胞内的积累[11]。细胞生物量最高达到47.5 g/L,GSH产量最高达到1 080.8 mg/L,胞内GSH含量最高达到2.29%分别比一次性补料发酵提高了37.7%、168.6%与89.3%。整个发酵过程共补入560 g葡萄糖,GSH的最高产量出现在66 h,此时胞内GSH含量最高,而细胞生物量略低于最高峰。
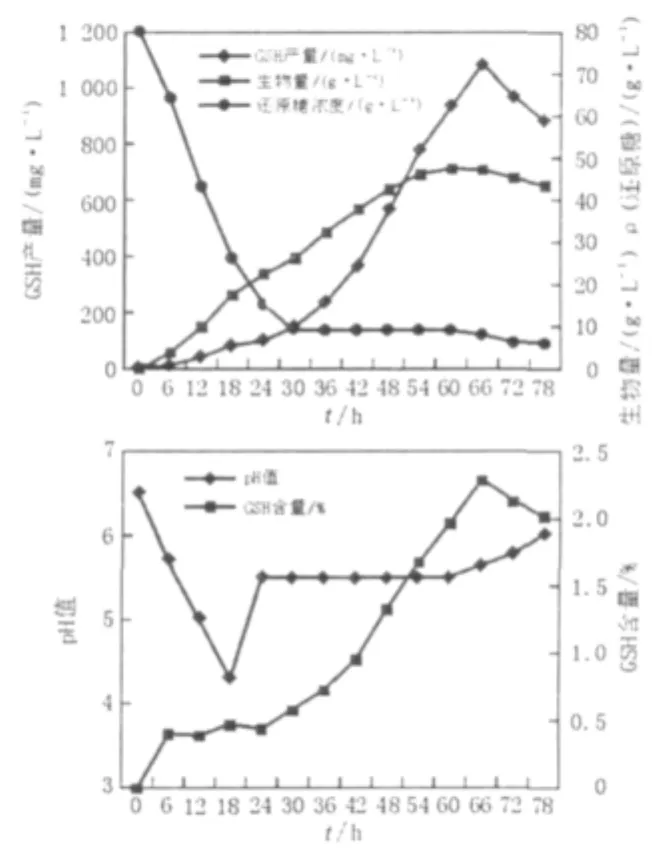
图3 补料分批发酵曲线Fig.3 The course of fed-batch culture
2.2.3 补料分批发酵结合前体氨基酸补加 据文献报道在发酵过程中补加3种前体氨基酸有利于GSH的积累,但Cys的加入能抑制酿酒酵母细胞的生长,最终降低细胞生物量[9,12]。根据前期的摇瓶发酵试验(摇瓶装液量25 mL/250 mL)确认在发酵结束前24 h细胞生物量达到较高程度时一次性补入半胱氨酸1.03 mmol、甘氨酸0.67 mmol和谷氨酸0.34 mmol,有利于GSH的积累,同时对细胞生物量影响较小,因此根据摇瓶试验结果选择在发酵中后期补加3种前体氨基酸,3种前体氨基酸的补加浓度参考摇瓶试验结果,分别为半胱氨酸41 mmol/L、甘氨酸26.7 mmol/L、谷氨酸13.7 mmol/L。不同的3种前体氨基酸补加时间对GSH发酵的影响如表3所示,发酵进行到40 h和44 h补加3种前体氨基酸对GSH的产量提高最有利,此时细胞生物量在37.58 mg/L与39.01 mg/L之间,因此选择当发酵进行至40 h到44 h之间补加3种前体氨基酸。进一步对3种前体氨基酸补加时间进行了验证,结果见图4。
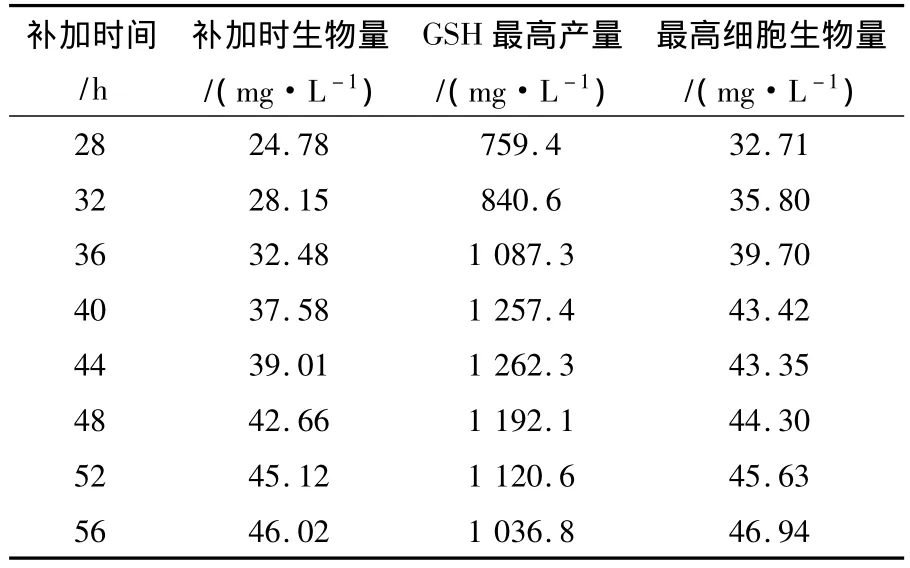
表3 3种前体氨基酸补加时间对GSH发酵的影响Table3 The influence of different addition time of the three precursor amino acids to GSH production
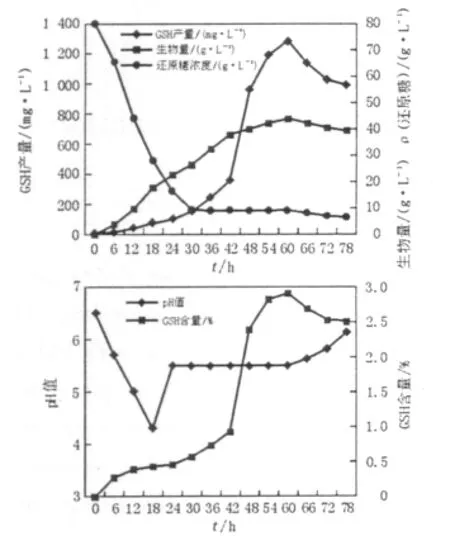
图4 补料分批发酵结合前体氨基酸补加Fig.4 The course of fed-batch culture combined with precursor amino acids addition
所示,当发酵42 h细胞生物量达到37.69 g/L时补入半胱氨酸246 mmol、甘氨酸160 mmol、谷氨酸82 mmol,6 h内GSH产量由350.5 mg/L提高至958.7 mg/L。GSH的最高产量出现在60 h,为1 280.4 mg/L,比未补加前体氨基酸时提高了18.5%。细胞最大生物量为43.96 g/L,比未补加前体氨基酸时略低,但胞内GSH含量最高为2.91%,比未补加前体氨基酸时提高了 27%。GSH的最高产量出现在发酵60 h,而未补加前体氨基酸时GSH最高产量出现在发酵66 h,可见前体氨基酸的补加不仅能够提高发酵液中GSH的产量,而且能够缩短发酵时间。
3 讨论
利用紫外诱变结合乙硫氨酸和氯化锌的底物筛选可有效筛选出有较高GSH产量的酿酒酵母菌株,经过2轮诱变筛选到突变株SC-001-24,其GSH产量为743 mg/L,比出发菌株提高了22%。通过在10 L发酵罐中对突变株SC-001-24的发酵调控发现把发酵液pH控制在5.5的恒PH补料分批发酵能够有效提高GSH的产量,GSH产量达到1 080.8 mg/L。结合前体氨基酸的补加,酿酒酵母菌株SC-001-24发酵生产GSH的最高产量可达1 280.4 mg/L,显示了良好的应用前景。
[1]Harington CR,Mead TH.Synthesis of Glutathione[J].Biochem J,1935,29(1):1602-1611.
[2]程元恺.谷胱甘肽的解毒作用与毒性代谢物[J].生物化学与生物物理进展,1994,21(5):395-399.
[3]Yin Li,Gongyuan Wei,Jian Chen.Glutathione:a review on biotechnological production[J].Appl Microbiol Biotechnol,2004,66(3):233-242.
[4]Penninckx MJ.An overview on glutathione in Saccharomyces versus non-conventional yeasts[J].FEMS Yeast res,2002,2(3):295-305.
[5]赵波,赵文杰,顾敏,等.硫酸铵与pH对酵母高密度发酵生产谷胱甘肽的影响[J].微生物药物与生物技术,2009,40(3):180-182.
[6]Shaohong Wen,Tao Zhang,Tianwei Tan.Maximizing production of glutathione by amino acid modulation and high-cell-density fed-batch culture ofSaccharomyces cerevisiae[J].Process Biochemistry,2006,41(12):2424-2428.
[7]童群义,陈坚,李华钟.高产谷胱甘肽的酵母菌选育及其培养条件研究[J].工业微生物,2002,32(2):13-17.
[8]Miaomiao Wang,Jinggeng Sun,Tianwei Tan,et al.The effect of intracellular amino acids on GSH production by high-celldensity cultivation ofSaccharomyces cerevisiae[J].Appl Biochem Biotechnol,2012,168(1):198-205.
[9]Shaohong Wen,Tao Zhang,Tianwei Tan.Optimization of amino acid composition in glutathione fermentation[J].Process Biochemistry,2005,40(11):3474-3479.
[10]胡林华,谭天伟.高产谷胱甘肽酵母菌株的选育和培养条件的初探[J].高校化学工程学报,2005,19(2):273-276.
[11]Zheng Wang,Tianwei Tan,Jie Song.Effect of amino acids addition and feedback control strategies on the high-cell-density cultivation ofSaccharomyces cerevisiaefor glutathione production[J].Process Biochemistry,2007,42(1):109-111.
[12]Alfafala CG,Kanda A,Shioi T,et al.Effect of amino acids on glutathione production bySaccharomyces cerevisiae[J].Appl Microbiol Biotechnol,1992,36(2):538-540.