花生仁脂肪酸GC-MS指纹图谱研究
李京华,李国琛,王晓钰,王念虎,王颜红,赵春杰,*
(1.沈阳药科大学药学院,辽宁沈阳 110016;2.中国科学院沈阳应用生态研究所,辽宁沈阳 110016)
花生是我国重要的油料作物和经济作物,在我国辽宁、江西、福建等十几个省份广泛种植,种植面积达467 万hm2[1]。研究证实我国不同产地的花生品质差异大[2-3]。花生仁中含量最高的营养成分是脂肪,其含量达50%[4]。脂肪酸是花生仁脂肪的主要成分,包括饱和、不饱和以及特殊脂肪酸。不饱和脂肪酸具有抗氧化、抗自由基、抗肿瘤、增强免疫、降低高密度脂蛋白血清胆固醇的作用,进而减少高血压、心脏病及中风等疾病的发病率[5]。已有研究发现花生油含不饱和脂肪酸80%以上(其中含油酸41.2%,亚油酸37.6%),另外还含有软脂酸,硬脂酸和花生酸等饱和脂肪酸19.9%[6-7]。已有文献研究主要集中在花生仁脂肪酸组成成分的鉴定及相对含量的测定[8-11]。目前关于花生仁脂肪酸指纹图谱的文献报道较少[12-13]。研究初步证实,依据花生仁脂肪酸图谱可以鉴别不同产地的花生[14],但对于同一花生品种在不同地理分布区脂肪酸的差异性研究较少。本研究以江西、福建、湖北、黑龙江4 个省份的同一品种的花生仁样品为研究对象,建立了其脂肪酸气相色谱指纹图谱,明确了花生仁脂肪酸成分,并结合主成分分析建立模型对花生样品进行了分类,为花生的质量品质评价和产地溯源研究提供了一定参考依据。
1 仪器与材料
STCS/GL-ZD-340 气相色谱串联质谱仪:中国Thermo Fisher 公司;20PR-52D 自动高速冷冻离心机:日本Hitachi 公司;BS110 型电子分析天平:北京赛多利斯仪器系统有限公司。
石油醚、甲醇、氢氧化钠均为分析纯:山东禹王实业有限公司;去离子水:中国科学院沈阳应用生态研究所实验室自制。花生仁样品由课题组自采,采制日期为2012 年10 月份,样品编号及来源见表1。
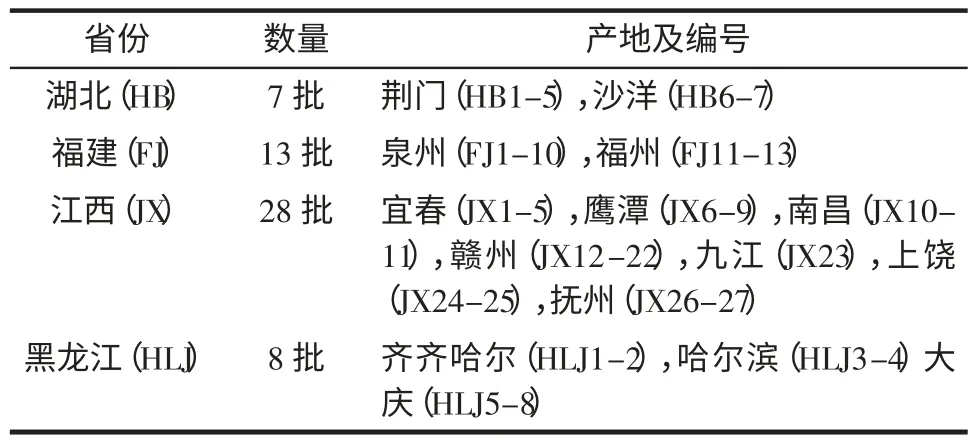
表1 花生仁样品来源Table 1 Origin of peanut seeds
2 方法与结果
2.1 样品的制备
不同产地的花生样品置通风阴凉处自然风干,粉碎后过200 目筛。称取3 份,每份约50 mg,精密称定置于10 mL 带刻度离心管中,加入石油醚2 mL,振荡5 min。向提取液中加入0.5 mol/L 甲醇钠2 mL,振荡10 min 进行甲酯化,加入去离子水2 mL,于高速冷冻离心机离心10 min(4 ℃10 000 r/min),吸取上清液进行GC-MS 分析。
2.2 GC-MS 分析条件
色谱条件:色谱柱为DB-1 石英毛细管柱(0.25 μm×0.25 mm×30 m);载气为氦气;升温程序:初温140 ℃,保持1 min,以8 ℃/min 升至190 ℃,保持5 min,再以2 ℃/min 升至220 ℃,保持1 min,再以5 ℃/min 升至260 ℃,保持10 min 进样口温度280 ℃;进样量1 μL;分流比20 ∶1;流速1.0 mL/min;溶剂延迟5 min。
质谱条件:离子源为电子轰击(EI)离子源;离子源温度250 ℃;发射电流50 μA;气相色谱质谱接口温度250 ℃;质量扫描范围m/z 40~500。
2.3 脂肪酸组分的确定
[7]和NIST 标准质谱图库,鉴定色谱图中各峰。共鉴别出16 种脂肪酸成分,GC-MS 总离子流色谱图如图1 所示。
2.4 方法学考察及样品测定
2.4.1 精密度试验
取同一批花生样品供试品溶液(FJ13),同一色谱条件下连续进样6 次,记录指纹图谱信息,计算各主要色谱峰的保留时间和其峰面积的RSD 值。结果保留时间的RSD<0.13%,色谱峰面积的RSD<5.0%,说明仪器的精密度良好。
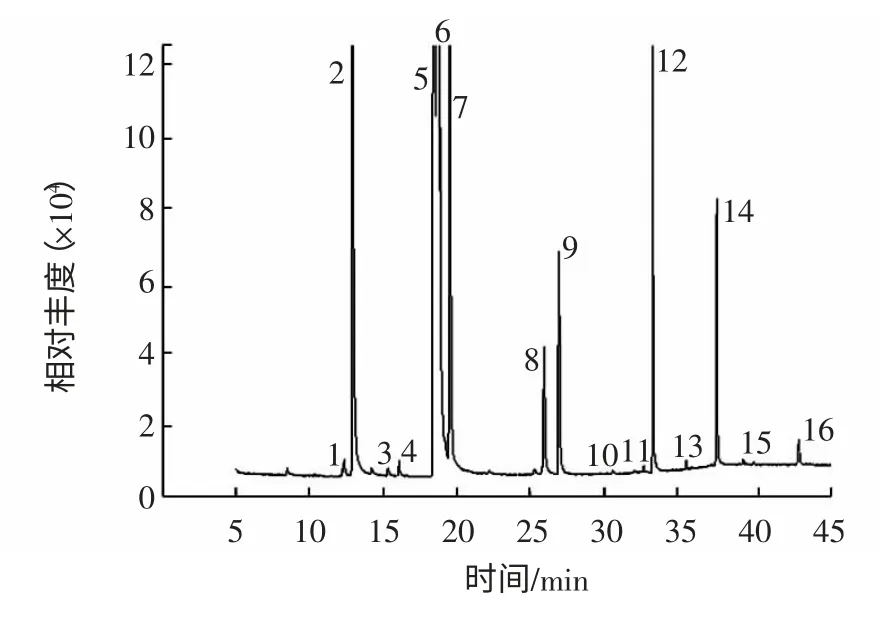
图1 花生仁脂肪酸总离子流色谱图Fig.1 Total ion current chromatogram of fatty acids from peanut seed
2.4.2 重复性试验
取同一批次样品供试品溶液(FJ13),按供试品溶液的制备方法分别制备6 份供试品溶液,进样并记录指纹图谱信息。计算得出谱图中各主要色谱峰保留时间的RSD<0.14%,峰面积的RSD<5.0%。说明该方法的重复性较好。
2.4.3 稳定性试验
取同一批供试样品(FJ13),分别于0、2、4、16、24、48 h 检测供试品的指纹图谱,计算各主要色谱峰保留时间和峰面积,结果得保留时间的RSD<0.18%,峰面积的RSD<5.0%,表明样品溶液在48 h 内稳定性良好。
2.4.4 样品色谱指纹图谱
不同批次的样品按2.1 项供试品溶液制备方法以及2.2 项下测定分析条件进行实验,记录指纹图谱16个主要脂肪酸色谱峰,计算得共有峰面积占总峰面积95%以上,采用面积归一化法计算各主要色谱峰的相对峰面积。
2.5 相似度分析
相似度可以定量描述指纹图谱,本研究采用相似度计算方法对样品进行比较,定量、客观地对样品进行评价。本研究以55 批样品谱峰面积均值建立花生脂肪酸的气相色谱指纹图谱共有模式,然后采用夹角余弦、相关系数为测度[15]计算样品与共有模式之间的相似度。
2.6 主成分分析
本研究借助SIMCA-P11.5 软件对不同批次的样品进行PCA 分析,主成分分析提取了两个主成分,评价主成分提取的两个参数是R2X(cum)和Q2(cum),R2X 和Q2 的数值分别为88.7%和75.6%,说明主成分信息提取较完全。PCA 分析载荷图如图2 所示。
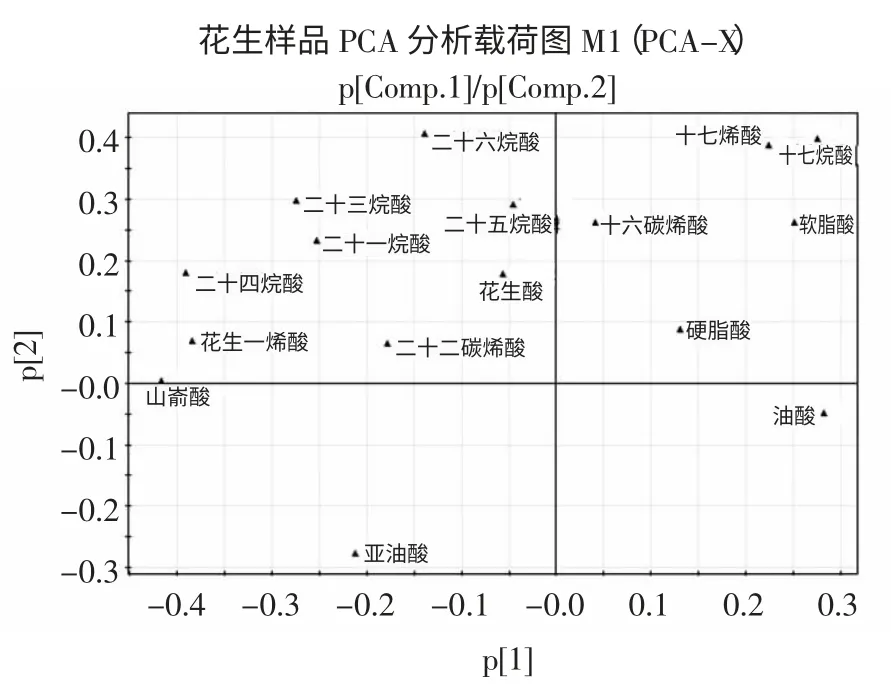
图2 PCA 分析载荷图Fig.2 PCA loading plots
载荷图反映了16 个脂肪酸组分变量对花生样本主成分得分值的贡献大小,载荷值越大,表明该变量对该主成分的贡献率越高。结合得分图中组间分布差异,可找出对这种差异贡献较大的变量。观察其主成分的载荷图,发现其脂肪酸成分均距原点较远,说明这些共有谱峰对花生脂肪酸组成差异均有较大贡献。以PCA 得分图为基础进行不同样品的脂肪酸分析,每个点分别代表一个样品,点与点之间的距离代表各个样品之间存在的特征差异程度[16]。PCA 得分图如图3所示。
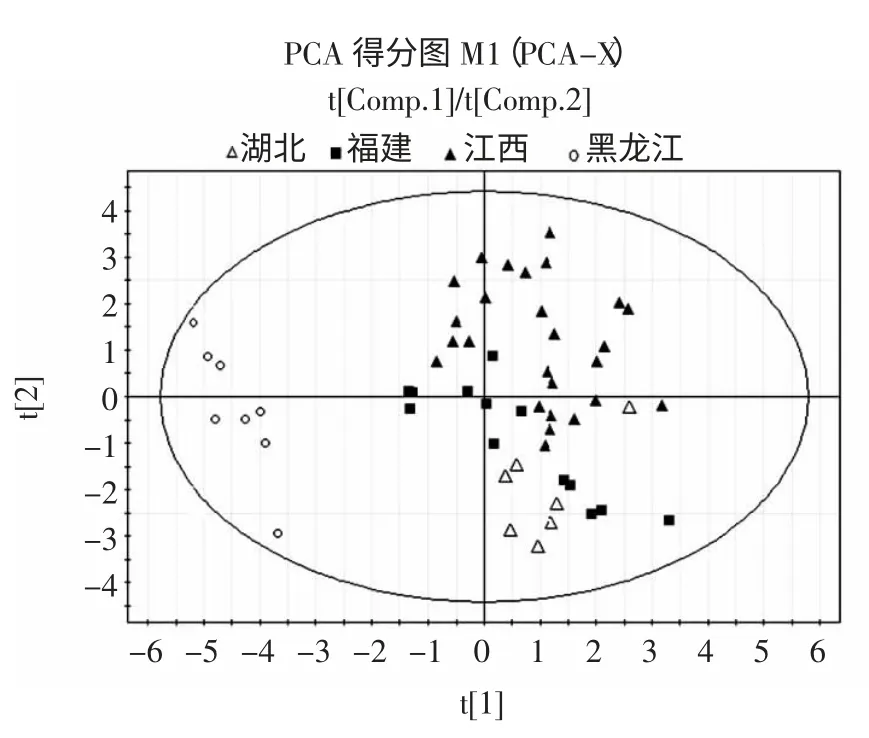
图3 PCA 得分图Fig.3 PCA score
3 讨论
3.1 指纹图谱分析
由花生脂肪酸总离子流色谱图可以看出各主要色谱峰的保留时间、峰面积及各峰之间的相对比例是评价指纹图谱的重要指标参数。从谱峰相对保留时间看,55 批花生样品气相色谱指纹图谱相似性较高,说明建立的指纹图谱准确可靠。计算谱图中的16 个主要脂肪酸色谱峰得不饱和脂肪酸油酸、亚油酸含量最高,其峰面积占共有总峰面积的61.7%~70.2%,其次是软脂酸、硬脂酸、花生酸等。不饱和脂肪酸含量的高低可以为花生仁脂质质量的评价提供一定的参考依据。
3.2 指纹图谱的建立
由于花生中的脂肪酸成分主要是油酸和亚油酸,因此两者对指纹图谱有比较高的的贡献率,其峰面积与比值对指纹图谱的分析结果影响较大。不同产地的样品存在差异,结果图谱特征峰的相对含量即存在一定差异,在进行相似度分析时不同批次的样品结果即表现出了一定的差异。借助夹角余弦和相关系数值比较4 个省份指纹图谱的相似度,结果显示江西、福建、黑龙江3 省样品相关系数值在0.94~1.00 之间,夹角余弦值在0.95~1.00 之间,表明此3 省的花生脂肪酸和共有模式的有较高的相似性,3 省花生脂肪酸差异较小。而黑龙江省相关系数值在0.80~0.87 之间,夹角余弦值在0.81~0.85 之间,由此可以看出黑龙江花生脂肪酸和共有模式的相似性较低,并和其它3 省存在较大的差异。
本文在建立GC 指纹图谱时发现指纹信息量大,主要是指色谱峰的数目多且各峰面积的变化大,但试验的重复性相对较差,尤其是不同批次的样品更难于重复测定,因此本实验将花生仁石油醚提取物甲酯化后,主要检测花生仁中的脂肪酸类成分。这样不仅简化了GC 指纹图谱的信息量,提高了实验的可重复性,并且明显的突出了各脂肪酸成分含量的变化特征,以此为基础建立了花生仁脂肪酸GC 指纹图谱。
3.3 主成分分析结果
PCA 得分图显示4 个省份的花生样品能实现基本分离:如图3 所示55 批样品聚集为两大类,江西、福建、湖北3 省地区和黑龙江省样品分布区域存在明显差别,江西、福建、湖北样品集中分布在一起,黑龙江与其它3 省样品分散,距离较远,表明黑龙江和其它3 省花生仁脂肪酸存在较大的差异;江西、福建、湖北3 省样品部分存在交叉分布,导致该结果的原因可能是3省地域接壤,地域相近地区的花生生长环境差别小,导致脂肪酸差异较小所造成的,但图中仍可显示出3省样品各自聚集分布区域,各省个别样品分布较为分散的原因尚不明确,有待于进一步研究。由此可以看出借助花生脂肪酸含量的差异,PCA 分析可以基本实现不同产地的花生样品分类。
4 结论
指纹图谱结合化学计量学方法可以为花生的鉴别研究提供有效的方法。通过GC-MS 建立了花生仁脂肪酸的指纹图谱,利用不同产地的花生脂肪酸差异性进行主成分分析。研究结果表明,根据花生仁脂肪酸的差异建立的主成分分析模型可以实现不同产地花生样品的分类,并可以为花生产地溯源研究提供一定的依据,同时可以表明地理分布因素可以对同一品种的花生产生不同的影响。
参考文献:
[1]殷冬梅,张幸果,王允,等.花生主要品质性状的主成分分析与综合评价[J].植物遗传资源学报,2011,12(4):507-512,518
[2]郭际华.不同栽培环境不同品种花生品质的差异及改良潜力研究[D].山东农业大学硕士学位论文.(2008-06-12)[2009-02-12].http://www.cnki.net/KCMS/detail/detail.aspx
[3]王才斌,刘云峰,吴正锋,等.山东省不同生态区花生品质差异及稳定性研究[J].中国生态农业学报,2008,16(5):1138-1142
[4]张忠信,朱松,刘莉娜,等.花生的营养成分与食疗方剂[J].中国食物与营养,2007(11):57-58
[5]胡锐,李宝莉.多不饱和脂肪酸对心血管系统的作用及机制[J].西北药学杂志,2008,23(2):118-120
[6]腾葳,柳琪,郭栋梁.花生主要营养物质含量的统计与分类分析[J].食品研究与开发,2003,24(3):84-85
[7]顾黎.花生油中脂肪酸组成的气相色谱-质谱分析[J].林区教学,2007(2):124-125
[8]侯冬岩,回瑞华,李铁纯,等.黑花生和白花生中脂肪酸成分的比较[J].食品科学,2011,32(2):177-179
[9]王瑞,孙长霞,张泽生.几种坚果植物中脂肪酸含量的分析研究[J].天津农学院学报,2007,14(4):39-41
[10]高慧敏,张颖君.花生种子脂肪酸含量的微量、快速测定[J].中国农学通报,2010,26(13):98-103
[11]禹山林,朱雨杰,闵平,等.傅立叶近红外漫反射非破坏性测定花生种子主要脂肪酸含量[J].花生学报,2010,39(1):11-14
[12]李晓丹,曹应龙,胡亚平,等.花生种子发育过程中脂肪酸累积模式研究[J].中国油料作物学报,2009,31(2):157-162
[13]SHIN EUI-CHEOL,RONALD B PEGG,PHILLIPS R DIXON,et al.Commercial Runner peanut cultivars in the USA:Fatty acid composition[J].Eur J Lipid Sci Technol,2010,112:195-207
[14]SHIN EUI-CHEOL,BRIAN D CRAFT,RONALD B PEGG,et al.Chemometric approach to fatty acid profiles in Runner-type peanut cultivars by principal component analysis(PCA)[J].Food chemistry,2010(119):1262-1270
[15]王玺,王文宇,张克荣,等.中药HPLC 指纹图谱相似性研究的探讨[J].沈阳药科大学学报,2003,20(5):360-362
[16]杜强,贾艳丽.SPSS 统计分析从入门到精通[M].北京:人民邮电出版社,2009:115-130

