超声波辅助提取甜葫芦中葫芦素E的工艺研究
范宏,朱珠,文连奎,许丽丽,王敬涵
(1.吉林工商学院粮油食品深加工吉林省高校重点实验室,吉林长春 130062;2.吉林农业大学食品科学与工程学院,吉林长春 130118)
甜葫芦[Lagenaria siceraria(Molina)Standl.var.hispisa(Thund.)Hara],又名菜葫芦,干瓢,是属于葫芦科葫芦属的一种爬藤植物,同时是一种优质高产的蔬菜,不仅含有维生素、葡萄糖和果糖,同时还含有钙、磷、钾等多种元素和氨基酸,除其嫩果可食用外,嫩苗、嫩叶亦常作蔬菜食用[1-3]。甜葫芦含有的葫芦素是一类高度氧化的四环三萜类植物次生物质,是葫芦科30 多属100 多种植物的特征化合物[4]。近代研究表明葫芦素在生态系统中作为异源化学信息素可起到保护葫芦科植物免受众多植食性动物和病原菌的侵害的作用[5-7]。葫芦素同时还具有消退黄疸,消除腹水、抗肿瘤等多种生物活性,在对激发细胞免疫功能,抑制肝纤维增生等方面也有一定的作用[8-11]。超声波提取技术是近年来兴起的提取技术,与传统提取方法相比,具有生产周期短、有效成分不易被破坏、节约提取成本等优点[12]。本实验利用超声波辅助浸提工艺,确定超声波辅助提取甜葫芦中的葫芦素E 的最佳提取工艺条件,从而为甜葫芦的开发和利用奠定一定的理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
甜葫芦干制品:市售;甲醇(色谱纯);葫芦素E 标准品(编号130502):北京捷诚科远化工技术研究所。
1.1.2 主要仪器
Y92-11 超声波细胞粉碎机:宁波新芝生物科技股份有限公司;T6 新世纪紫外可见分光光度计:TECHCOMP;TGL-16G 型台式离心机:上海安亨科学仪器厂;A-88 组织捣碎机:江苏金坛医疗仪器厂。
1.2 步骤与方法
1.2.1 葫芦素E 标准曲线的绘制
1.2.1.1 葫芦素E 最大吸收峰的测定
取葫芦素E 的甲醇标准溶液,然后用紫外分光光度计进行全波长扫描(190 nm~1 100 nm),得到葫芦素E 标准品的最大吸收峰为234 nm,所以将葫芦素E 的检测波长确定为234 nm。
1.2.1.2 葫芦素E 标准曲线的绘制
准确称取干燥至恒重的葫芦素E 标准品2.5 mg,用甲醇溶解并定容至50 mL 的容量瓶中,配成质量浓度为50 μg/mL 的葫芦素E 标准储备液,量取该标准储备液0.4、0.8、1.2、1.6、2.0 mL,用甲醇定容到10 mL 容量瓶中,配制成质量浓度为2、4、6、8、10 μg/mL 的标准溶液,然后在波长234 nm 处测吸光值,以葫芦素E 的质量浓度为横坐标(X),吸光值为纵坐标(Y),绘制标准曲线,得线性回归方程。紫外分光光度法测定葫芦素E 的含量的标准曲线见图1。
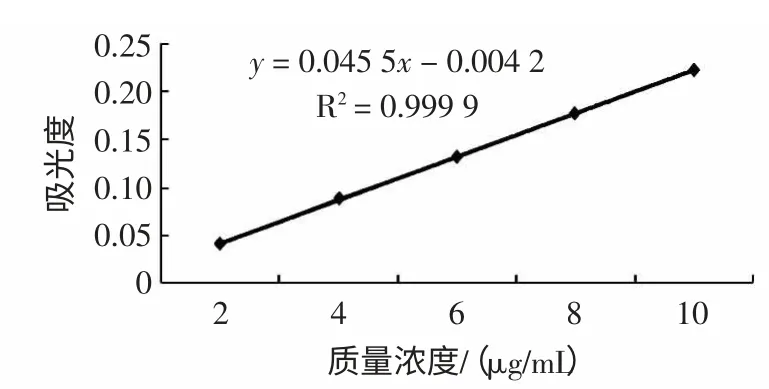
图1 葫芦素E 标准曲线Fig.1 Cucurbitacin E standard curve
1.2.2 样品中葫芦素E 含量的测定
将甜葫芦干制品进行粉碎、过筛(80 目),精确称量甜葫芦干粉2 g,放入50 mL 的烧杯中,加入一定体积的甲醇溶液,常温条件下按一定的超声条件(料液比,溶剂浓度,提取时间,超声波功率)提取葫芦素E,离心10 min,去掉沉淀纯化并取上清液,将上清液稀释100 倍经紫外分光光度计测得每个上清液的吸光值,根据回归方程计算样品中葫芦素E 的含量。葫芦素E得率的计算公式为:
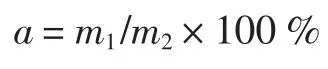
式中:a 为葫芦素E 得率,%;m1为样品溶液中葫芦素E 质量,g;m2为甜葫芦干粉的质量,g。
1.2.3 超声波提取葫芦素E 的单因素及正交试验设计
分别针对不同的料液比(1 ∶8、1 ∶9、1 ∶10、1 ∶11、1 ∶12 g/mL)、溶剂浓度(50%、60%、70%、80%、90%)、提取时间(10、15、20、25、30 min)、超声波功率(200、300、400、500、600 W)影响葫芦素E 得率的因素进行单因素试验,并在单因素试验的基础上采用L(934)正交试验,以吸光值为考察指标,确定超声波辅助提取甜葫芦中葫芦素E 的最佳提取工艺条件。
2 结果与分析
2.1 超声波提取葫芦素E 的单因素试验结果与分析
2.1.1 料液比对葫芦素E 得率的影响
在溶剂甲醇浓度为70%,时间为20 min,超声功率为400 W 条件下对葫芦素E 的进行超声波提取,确定适宜的料液比。料液比对葫芦素E 得率的影响见图2。
由图2 可知,当料液比大于1 ∶10(g/mL)时,得率将不再增加。料液比的大小影响着固相主体与液相主体之间的浓度差,即传质推动力,料液少,继而两相间的浓度差小,从而传质推动力小。其次,料液比的大小还会影响两相的混合度情况。料液的提高必然会较大程度的提高传质推动力,但同时也提高了生产成本及后续处理的难度,所以溶剂也不宜太多。因此,本试验料液比选择1 ∶9、1 ∶10、1 ∶11(g/mL)3 个水平进行正交试验。
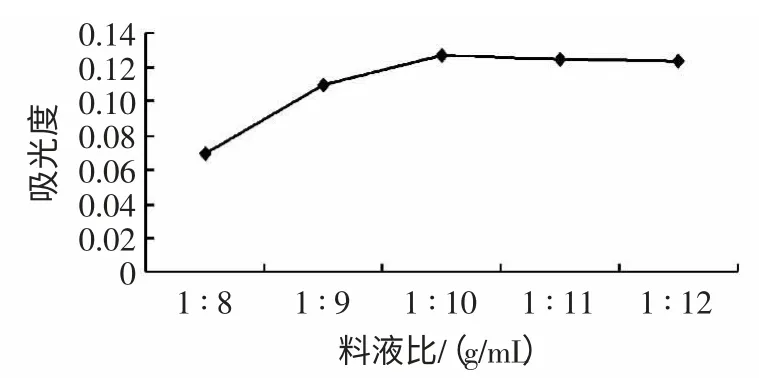
图2 料液比对葫芦素E 得率的影响Fig.2 Effect of different rate of solid to solution on yield of cucurbitacin E
2.1.2 溶剂浓度对葫芦素E 得率的影响
在料液比(g/mL)为1 ∶10,时间为20 min,超声功率为400 W 条件下对葫芦素E 的进行超声波提取,确定适宜的溶剂浓度。溶剂浓度对葫芦素E 得率的影响分别见图3。
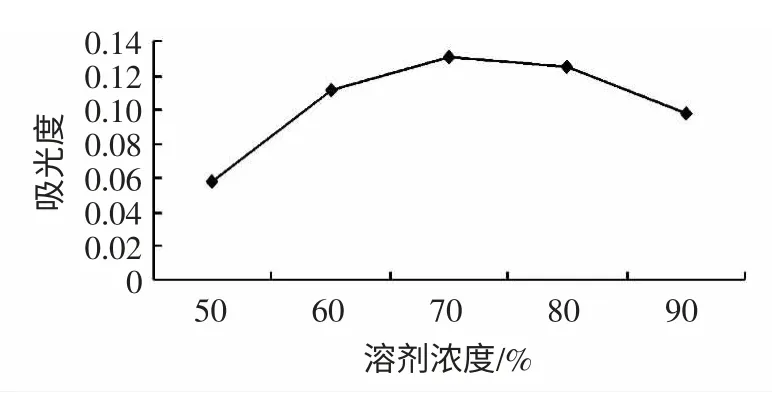
图3 溶剂浓度对葫芦素E 得率的影响Fig.3 Effect of different solvent concentration on yield of cucurbitacin E
由图3 可知,当溶剂甲醇浓度小于70%时,得率随之甲醇浓度的增加而增加,甲醇浓度为70%时,得率最大,提取效果最好;但随着甲醇浓度继续增加,得率下降,原因是一些杂质同时也溶解出来。因此,本试验甲醇浓度选择60%、70%、80%3 个水平进行正交试验。
2.1.3 提取时间对葫芦素E 得率的影响
在料液比(g/mL)为1 ∶10,溶剂甲醇浓度为70%,超声功率为400 W 条件下对葫芦素E 的进行超声波提取,确定适宜的提取时间。提取时间对葫芦素E 得率的影响分别见图4。
由图4 可知,随着提取时间的增加,葫芦素E 得率先升高后降低,当提取时间为20 min 时,葫芦素E得率最高。因此,本试验提取时间选择15、20、25 min 3 个水平进行正交试验。
2.1.4 超声波功率对葫芦素E 得率的影响
图4 超声时间对葫芦素E 得率的影响Fig.4 Effect of different ultrasonic time on yield of cucurbitacin E
在料液比(g/mL)为1 ∶10,溶剂甲醇浓度为70%,时间为20 min 条件下对葫芦素E 的进行超声波提取,确定适宜的超声波功率。超声波功率对葫芦素E 得率的影响分别见图5。
图5 超声时间对葫芦素E 得率的影响Fig.5 Effect of different ultrasonic power on yield of cucurbitacin E
由图5 可知体系中介质分子的振动速度会随着超声功率的增加而增大,在超声强度高于空化阈值后,空化气泡也就随着介质分子振动速度的增大而增多,空化效果也就更明显[13],本实验超声功率为400 W时,葫芦素E 得率最高。因此,本试验超声波功率选择300、400、500 W 3 个水平进行正交试验。
2.2 超声波提取葫芦素E 的正交试验结果与分析
在单因素试验的基础上,对影响葫芦素E 得率的因素进行L9(34)正交试验(见表1),葫芦素E 正交试验结果见表2。
表1 葫芦素E 提取的L9(34)正交试验因素与水平设计Table 1 Factors and levels design of L9(34)orthogonal tests for cucurbitacin E extraction
由极差R 大小分析可知,影响葫芦素E 提取效果因素的主要因素顺序为B>C>A>D,即溶剂浓度>时间>料液比>超声波功率,由K 值可知,其最优组合为A2B2C1D3,即料液比1 ∶10(g/mL)、溶剂浓度70%、超声时间15 min、超声功率500 W。然而通过正交试验得出的最佳条件组合并不在正交试验表的9 个试验内。因此为了得到确定的结果,按照上面得出的最佳条件A2B2C1D3进行验证试验。
表2 葫芦素E 提取正交试验结果Table 2 Results of orthogonal tests for cucurbitacin E extraction
2.3 最佳工艺条件验证试验
按A2B2C1D3,即料液比1∶10(g/mL)、溶剂浓度70%、超声时间15 min、超声功率500 W 的条件下分别进行3 次葫芦素E 超声波提取的平行实验,平均得率为0.695%,由此可知正交试验的结果是准确的,确定A2B2C1D3为葫芦素E 超声波提取的最佳工艺选择。
2.4 不同因素对葫芦素E 得率的影响分析
由2.2 可知,溶剂浓度对葫芦素E 的提取效果影响最大,超声波功率影响最小,时间和料液比依次次之。原因是依据相似相溶原理,葫芦素E 易溶于有机溶剂,所以溶剂浓度对葫芦素E 的提取效果影响较大。超声波破碎过程是一个物理过程,而根据甜葫芦的属性和葫芦素E 的结构特性,葫芦素E 的提取效果受超声波功率影响最小。
3 结论
通过单因素试验与正交试验得到了最佳的提取条件为:料液比1 ∶10(g/mL)、溶剂浓度70%、超声时间15 min、超声功率500 W。在此条件下葫芦素E 的得率为0.695%
[1]郭本功.保健佳蔬话瓠瓜[J].蔬菜,2003(9):34
[2]邱明华,陈书坤,陈剑超,等.葫芦科化学分类学[J].应用与环境生物学报,2005(12):20
[3]周玲.瓠瓜的药用食疗与菜谱[J].食疗烹苑,1997(8):43
[4]Metcalf R L.Coevolutionary adaptations of rootworm beetles(Coleoptera Chrysomelidae) to cucurbitacins[J].Journal of chemical ecology,1986,12(5):1109-1124
[5]Tallamy DW,Stull J,Ehresman NP,et al.Cucurbitacins as feeding and oviposition deterrents to insects[J].Environmental entomology,1997,26(3):678-783
[6]Tallamy DW,Whittington DP,Defurio F,et al.Sequestered cucurbitacins and pathogenicity of Metarhizium anisopliae(Moniliales Moniliaceae)on spotted cucumber beetle eggs and larvae(Coleoptera Chrysomelidae)[J].Environmental entomology,1998,27(2):366-372
[7]Balkema-Boomstra AG,Zijlstra S,Verstappen FWA,et al.Role of cucurbitacin Cresistance to spidermite(Tetranychusurticae) in cucumber(Cucumissativus L)[J].Journal of chemical ecology,2003,29(1):225-235
[8]刘昌孝,张振伦,叶桂珍,等.葫芦素BE 的药理研究[J].中草药,1985,16(10):21-23
[9]Chen JC,Chiu MH,Nie RL,et al.Cucurbitacins and cucurbitane glycosides:structures and biological activities[J].Nat Prod Rep,2005,22(3):386-399
[10]湖南医药工业研究所药理室肝炎组.葫芦素B、E 抗肝炎药理研究[J].中草药,1982,13(11):25-26
[11]湖南医药工业研究所药理室肝炎组.甜瓜蒂抗肝炎有效成分的药理研究[J].中草药通讯,1979(9):30-32
[12]张晔,赵晶晶,王锴,等.超声波辅助提取辣椒红色素[J].食品研究与开发,2011,32(1):71-74
[13]吴永福,汪一飞.茶叶深加工产品开发的现状[J].中国茶叶,2001,23(6):39-31

