香草醛-硫酸测定甘草浸膏中甘草酸含量
张慧慧,刘明言,凌宁生
(1天津大学化工学院,天津 300072;2天津中新药业集团股份有限公司中新制药厂,天津 300457)
甘草为豆科(Leguminosae)甘草属(Glycyrrhiza)植物,主要有效成分为三萜化合物、黄酮类和多糖化合物等[1-6]。甘草酸是甘草的根和根茎中所含的一种五环三萜皂苷,具有抗炎、抗氧化、抑菌等作用[2],但过量服用甘草酸可能引起钠潴留和高血压[3]。甘草中含有多类有效成分,甘草提取物多是利用甘草酸。为了节约资源,需对提取甘草酸后的残余成分开展利用研究。大多研究为对提取完甘草酸后甘草渣的利用,但是尚未见到从提取完甘草多糖后的甘草浸膏中提取甘草酸的研究报道。
目前,甘草酸含量测定方法主要有:重量法、比色法、紫外分光光度法、薄层扫描法[4]、高效液相色谱法[5]及毛细管电泳法[6]等。高效液相色谱和毛细管电泳法精确度高,但成本高,更适用于较少甘草酸含量的测定。比色法在测定皂苷类成分含量方面仍比较常见,鱼红闪等[7]、张恩淑[8]利用香草醛-硫酸法测定甘草酸含量时,均用乙醇溶液溶解显色剂进行直接测定,但刘芃岩等[9]研究发现甲醇、乙醇等溶剂对该法显色有很大干扰。张中伟等[10]研究发现香草醛-高氯酸法作为三萜皂苷常用的显色剂,较香草醛-硫酸法精密度高,受糖类干扰小,兰霞等[11]利用香草醛-高氯酸法测定甘草中总皂苷的含量,并对该方法进行了条件的优化和方法学考察,但该法需要用到冰乙酸和高氯酸两种溶剂。从提取完甘草多糖后的甘草浸膏中提取分离甘草酸,由于涉及的甘草浸膏不含糖类的特性以及所用的分离方法为流化床,重点考察的是含量的变化趋势,所以本研究主要对文献中香草醛-硫酸法进行改进,旨在建立一种简便、准确的甘草提取完糖类后浸膏中甘草酸含量的测定方法。
1 实验材料
UV759系列紫外-可见分光光度计,上海精密科学仪器有限公司;AUY120型分析天平,SHIMADZU公司;HH-4型数显恒温水浴锅,金坛市精达仪器制造厂。
甘草酸标准品(99.21% UV,75% HPLC,上海融禾医药科技发展有限公司),甘草浸膏(天津中新药业集团股份有限公司中新制药厂甘草提取糖类后的浸膏),无水乙醇、香草醛、浓硫酸(98%)(均为分析纯,天津市江天化工厂)。
2 实验方法
称取 0.0333 g甘草酸标准品(实际含甘草酸0.025 g),溶于25 mL 25%乙醇,80 ℃水中微热,配制成1.0 mg/mL的甘草酸标准品溶液。
2.1 最大波长的确定
准确吸取0.25 mL标准品溶液,在80 ℃水浴中挥去乙醇,冷却,加入0.25 mL 5 mg/mL香草醛溶液(0.15 g香草醛溶于30 mL蒸馏水中,80 ℃水中微热溶解,新鲜配制),放入冷水中,加入2.50 mL 78%硫酸,摇匀,在60 ℃水浴中加热20 min,迅速冷却至室温,以0.25 mL蒸馏水代替试样液为空白对照,进行400~600 nm波长扫描。
2.2 比色条件的优化
通过对影响显色的因素(香草醛浓度、硫酸浓度、硫酸用量、时间、温度)进行考察,得到最优的比色条件。
方法:取0.25 mL 标准品溶液,80 ℃水浴中挥去乙醇,冷却后,加入新鲜配制的0.25 mL不同浓度的香草醛溶液,放入冷水中,加入不同体积浓度及不同体积的硫酸溶液,摇匀,在不同温度水浴中加热不同时间,迅速冷却至室温,进行吸光度的测定。
2.3 方法学的考察
2.3.1 显色稳定性
在最佳显色条件下,进行显色反应,设置紫外分光光度计在1 h内每隔1 min测定一次显色后溶液的吸光度。
2.3.2 标准曲线的制备
配制不同浓度的甘草酸标准品溶液:0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL,各取0.25 mL,按最佳显色条件进行显色,以吸光度A为横坐标,甘草酸浓度c为纵坐标,绘制标准曲线。
2.3.3 精密度的测定
将0.025 g干燥的甘草浸膏,溶于25 mL 25%乙醇中,80 ℃水中微热,得到样品待测液。吸取相等体积样品待测液6份,按最佳显色反应条件进行显色测定吸光度,按标准曲线计算甘草酸含量,通过相对标准偏差RSD评价精密度。
2.3.4 加样回收率
吸取5 mL样品待测液5份,分别加入1 mL的0.50 mg/mL、0.75 mg/mL、1.00 mg/mL、1.25 mg/mL、1.50 mg/mL甘草酸纯品,摇匀,按最佳显色反应条件进行显色测定吸光度,通过标准曲线得到甘草酸含量,对能检测到的甘草酸纯品进行回收率考察,得到平均回收率,并通过RSD对结果进行评价。
3 结果与讨论
3.1 最大波长的确定
香草醛-硫酸是测定三萜皂苷含量常用的一种显色剂,反应原理即甘草酸在浓硫酸作用下脱氢,与香草醛加成形成特征性的红色络合物[10],通过紫外可见分光光度计进行含量的测定。采用前述显色方法,扫描后的最大吸收波长为535 nm。
3.2 比色条件的优化
3.2.1 最佳香草醛浓度的确定
结果如图 1,随着香草醛浓度的增加,吸光度增加,大于7 mg/mL浓度虽然显色更好,但实验中发现重复性差,所以选择6 mg/mL浓度香草醛溶液进行显色反应。

图1 香草醛浓度对显色反应的影响
3.2.2 最佳硫酸浓度的确定
采用 45%、50%、55%的硫酸进行实验,未发生显色反应,这是因为这些浓度的硫酸不具有足够的氧化性,这也间接证明了该显色反应中硫酸的作用主要是氧化作用。从图2中可以看出,75%硫酸用于显色效果较好。但是随着硫酸浓度的继续增加,吸光度开始下降,这是由于过高浓度的硫酸会引起香草醛自身缩合反应[12],导致与甘草酸反应的香草醛减少从而使产物减少。

图2 硫酸浓度对显色反应的影响
3.2.3 最佳硫酸用量的确定
不同的硫酸用量,对显色反应具有一定的稀释作用,相比反应体系的体积,硫酸的稀释作用对测定结果有较大影响,故对吸光度值进行了校正,即乘以体积相对系数,排除稀释作用的影响。图3显示,2.0 mL硫酸加入量显色效果较佳。随着硫酸用量的增加,溶液pH值降低,甘草酸的溶解度降低,吸光度减少。
3.2.4 最佳显色温度的确定
从图4可知,吸光度随着温度的升高逐渐增加,75 ℃之后基本稳定,故选择在 75 ℃进行显色反应。
3.2.5 最佳显色时间的确定
图5显示,随着反应时间的增加,吸光度逐渐增加,在 25 min反应基本完成,故选择显色反应25 min即可。
通过对比色条件的影响因素的考察,得到最佳的比色条件:0.25 mL待测液,进行预处理,加入0.25 mL浓度为 6 mg/mL香草醛溶液和2.0 mL 75%硫酸,在75 ℃反应25 min,在该条件下显色,效果最好。
3.3 方法学的考察
3.3.1 显色稳定性
吸光度测定值RSD=1.093%,表明显色反应在1 h内基本稳定,可以满足测定的要求。

图3 硫酸用量对显色反应的影响

图4 温度对显色反应的影响
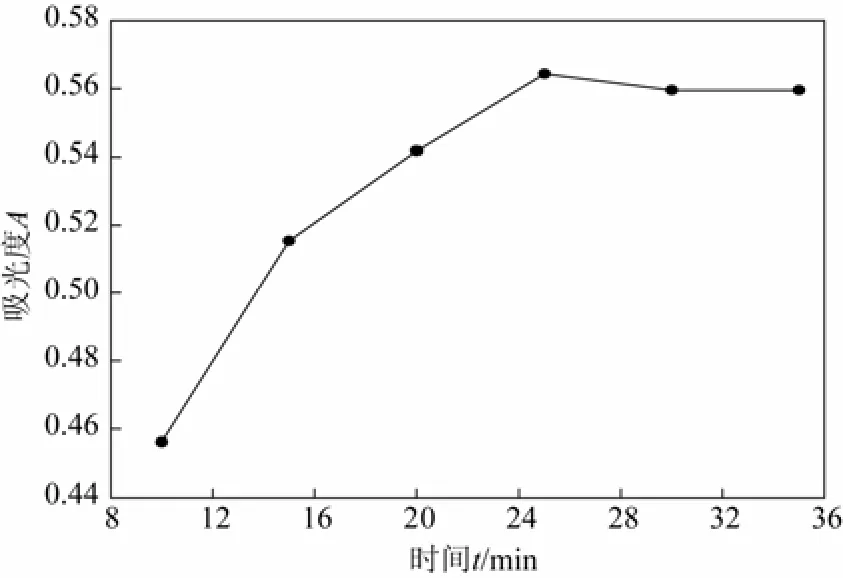
图5 显色时间对显色反应的影响
3.3.2 标准曲线
在最佳显色条件(0.25 mL 6 mg/mL香草醛溶液和2.0 mL 75%硫酸,75 ℃反应25 min)下显色,通过吸光度的测定,得到回归曲线数据(见表1)。如图6所示,标准曲线方程为:C=0.1517A–0.0078,R2=0.9996,在0.0200~0.1000 mg/mL范围内,线性相关性较好。
3.3.3 精密度的测定
精密度测定结果见表2。
吸光度RSD=4.39% ,表明该方法测定甘草酸含量重现性较好。
3.3.4 加样回收率
如表3所示,平均回收率X=95.93%,RSD=4.62%,可以保证最终测定结果的可靠性。

表1 测定的回归曲线数据

图6 甘草酸的标准曲线

表2 精密度实验结果

表3 加样回收率实验结果
3.3.5 甘草酸粗品的制备与含量测定
取甘草干浸膏5 g,加入100 mL水,25 ℃磁力搅拌溶解,缓慢滴加50%硫酸,至溶液的pH=2,静置,抽滤得到沉淀,进行两相系统分离[13](乙醇∶K2HPO4∶水=548 g∶137 g∶365 g), 25 ℃磁力搅拌溶解,静置24 h,取上层清液,滴加50%硫酸至不再有沉淀析出,抽滤,烘干,得到甘草酸粗品。取干燥后的甘草酸粗品0.2319 g,溶于100 mL 25%乙醇溶液,分别取0.25 mL 置于80 ℃水浴中加热1 h,待其冷却至室温,加入0.25 mL 6.0 mg/mL香草醛水溶液,置于冰水中加入2.0 mL 75%硫酸,取出,待其恢复室温,在 75 ℃水浴中进行显色反应25 min,在535 nm处测定吸光度,按标准曲线计算甘草酸含量,结果显示甘草酸粗品平行样中甘草酸纯度分别为6.87%、6.85%、6.94%,平均值为6.89%。
4 结 论
本研究方法主要用于甘草提取甘草多糖后浸膏中甘草酸含量的测定及变化趋势考察。通过对影响香草醛-浓硫酸方法影响因素的考察发现,0.25 mL待测液中加入0.25 mL 6 mg/mL香草醛溶液和2.0 mL 75%硫酸,在75 ℃反应25 min,显色效果最好。由于实验所用甘草浸膏中不含有糖类物质,该方法精密度可以得到较好的提高。在最佳显色条件下对该法进行方法学考察也发现,该法显色稳定、样品精密度和重复性都较好,可以满足测定要求。同时,该方法只需一种显色溶剂,相比香草醛-高氯酸法,操作更简便。
[1]国家药典委员会.中华人民共和国药典一部—2010[S].北京:中国医药科技出版社,2010.
[2]赵雅欣, 高文远, 张连学,等.甘草在化妆品中的应用[J].香料香精化妆品, 2010(4):47.
[3]Fu Boqiang, Liu Jie, Li Huan, et al.The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid [J].J.Chromatography.A, 2005, 1089:18-24.
[4]石力夫, 全山丛.薄层扫描法测定甘草制剂中甘草酸含量的研究[J].中草药, 1993, 24(6):296-297.
[5]Charles H Risner.Evaluation of HPLC mobile phases and extracts for the determination of glycyrrhizic acid in Licorice and tobacco [J].J.Liq.Chromatogr.Relat.Techno., 2008, 31(9):1337-1345.
[6]Wang P, Li S F Y, Lee H K.Determination of glycyrrhizic acid and 18-β-glycyrrhetinic acid in biological fluids by micellar electrokinetic chromatography [J].J.Chromatography.A, 1998, 811:219-224.
[7]鱼红闪, 吴少杰, 金凤燮,等.树脂法提取甘草中甘草苷的研究[J].食品与发酵业, 1998, 25(1):40.
[8]张恩淑.甘草酸提取新工艺的研究[D].吉林:吉林大学, 2007.
[9]刘芃岩, 胡汉芳, 阎正,等.用比色法测定不同产地甘草中甘草酸的含量[J].河北大学学报:自然科学版, 1998, 18(4):369-371.
[10]张中伟, 谢明勇, 王远兴,等.比色法测定苦瓜总皂苷 [J].南昌大学学报:理科版, 2005, 29(5):447-453.
[11]兰霞, 王洪新.比色法测定甘草中总皂苷的含量 [J].时珍国医国药, 2007, 18(4):886-887.
[12]杨依姗, 李春美, 陈美红.香草醛/硫酸法测定柿子单宁含量条件的优化[J].食品科技, 2010, 35(12):267-271.
[13]Tan Tianwei, Huo Qing, Ling Qiang.Purification of glycyrrhizin from Glycyrrhiza uralensis Fisch with ethanol/phosphate aqueous two phase system [J].Biotechnology Letters, 2002, 24:1417-1420.

