热传递对甲烷水合物生成速度的影响研究
庞维新 李清平 孙福街 陈光进
1.中海油研究总院,北京 100027;
2.中国石油大学(北京)重质油国家重点实验室,北京 102249
0 前言
由于1 m3甲烷水合物可以储存164 m3天然气,且储存温度高于压缩天然气和液化天然气,使得水合物储运天然气技术成为水合物研究的一个重要方向[1-2]。但大规模生成水合物时,水合物的生成速度和储气量是制约该技术能否实施和是否具有经济优势的关键因素。大量的研究主要集中于向溶液中加入化学添加剂以提高水合物的生成速度和增大储气量[3-5]。但在体积10 L的静态反应器中针对甲烷水合物储气的放大研究结果表明[6],当用于生成甲烷水合物的水量从1 kg增加到5 kg时,甲烷水合物的生成时间急剧增长,而储气量也有较大的降低。分析认为,虽然合适的化学添加剂在一定程度上可以提高甲烷水合物的生成速度,但当较大规模合成甲烷水合物时,制约甲烷水合物生成速度的主要因素是热传递。
1 实验装置和方法
实验装置主要包括反应系统、制冷/加热系统、天然气供应/回收系统等,见图1。反应系统主要设备有甲烷水合物反应器,采用的甲烷水合物反应器直径为200 mm,高320 mm,容积为10 L。反应器内部设有制冷盘管,盘管浸没在水溶液中,使实验过程中的反应热可及时被带走。制冷/加热系统主要设备有制冷箱和加热槽,可为甲烷水合物的生成/分解提供制冷和加热。天然气供应/回收系统主要设备有气体钢瓶和压缩机。实验装置采用量程为0~16 MPa,精度为0.1 MPa的压力表进行压力测量,采用Pt100,精度为0.1℃的热电偶进行温度测量。
实验采用十二烷基硫酸钠(SDS)作为甲烷水合物生成促进剂,详细实验方法见参考文献[6]。

图1 实验装置
2 结果与讨论
2.1不循环制冷液时水合物的合成状况
实验首先考察了水溶液的温度为276.15 K,没有制冷液循环时甲烷水合物的合成情况,实验结果见图2~4。从图2~3可以看出,在经过约60 min的溶解和诱导期后,甲烷水合物才开始生成,系统压力逐渐降低。此时,由于甲烷水合物生成时放出的热量不能被及时带走,体系温度特别是液相温度急剧上升,很快达到反应压力下的平衡温度,甲烷水合物停止生成,系统压力保持不变。最后,由于环境温度较高,反应器自然而缓慢地吸收热量,导致生成的甲烷水合物开始分解,系统压力升高。从图3还可以看出,由于甲烷水合物合成时放出的热量不能被及时带走,体系温度升高速度比从外界自然吸收热量时升温速度要快很多。
从图4中1 g H2O累计耗气量也可以清晰地看出整个反应过程的情况。图4中第一个耗气量峰值是气体溶解导致的;随后在甲烷水合物生成诱导期,1 g H2O耗气量保持不变;当甲烷水合物开始生成时,1 g H2O耗气量急剧升高;最后在甲烷水合物分解阶段,1 g H2O耗气量又逐渐下降。


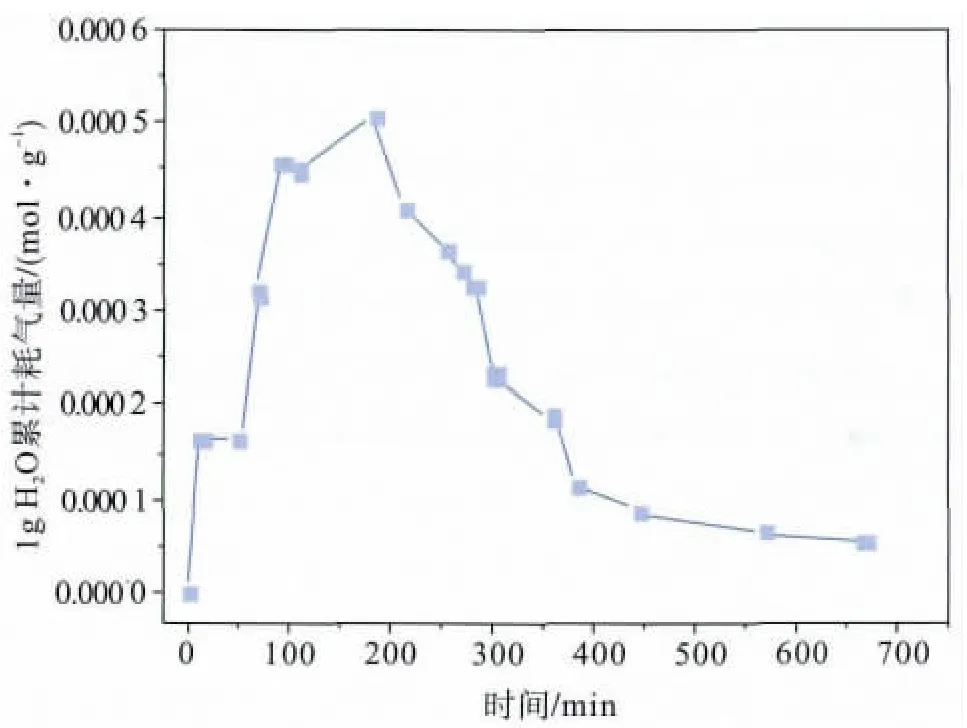
图4 不循环制冷液时反应过程中体系累计耗气量变化
由此可以看出,在较大量生成甲烷水合物时,虽然加入了效果较好的化学添加剂[3-6],但如果甲烷水合物生成热不能及时被带走,反应体系温度很快升高,甲烷水合物生成速度变慢甚至很快停止。对比有制冷液循环但不加入化学添加剂的实验结果[6]可以看出,热量传递才是影响甲烷水合物合成速度和储气量的关键因素。
2.2 制冷液温度对甲烷水合物合成的影响
制冷液温度对甲烷水合物合成情况的影响见图5~6。实验采用的制冷液温度分别为275.15、273.15、272.15、271.15 K,流量为 7.0、5.5、3.5、2.0 L/min,由于规律基本相同,只有部分实验结果列于图5~6中。
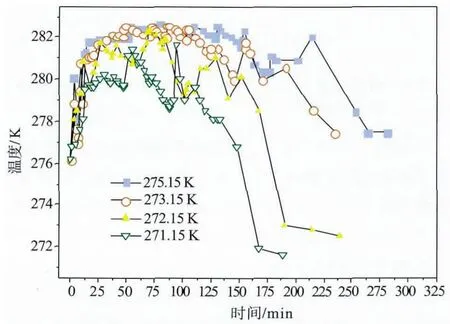
图5 盘管流量为3.5 L/min时,不同制冷液温度下反应器中的液相温度
从图5甲烷水合物生成过程中的液相温度变化可以清晰地看出制冷条件下甲烷水合物的生成机理。与没有制冷液循环不同,有循环制冷液的情况下,甲烷水合物很快生成,随着反应的剧烈进行,液体温度迅速升高,此后,反应体系达到一个动态平衡,在这一阶段,反应放出的热量与制冷液带走的热量相等,体系温度基本保持不变,直到反应逐渐结束,液相温度逐步趋向于制冷液温度。
从图5可见当制冷液温度较低时,液相温度波动较大。这是因为为了保持反应器压力在(6.6±0.2)MPa的范围内,需要向反应器中不停地充入气体以补充反应消耗掉的气体。而实验过程中这种向反应器中补充气体导致液相温度短暂升高1~2 K的现象一直存在。当体系自身温度较高时,补充气体造成的液相温度波动较小。
从图5还可以看出,甲烷水合物合成过程中液相温度比制冷液的温度约高8 K,比实验设定的液相反应温度值276.15 K高4~6 K。在以前针对甲烷水合物储气的研究中,反应器体积一般都较小,放在空气浴或水浴恒温箱中,恒温箱设定的温度被认为就是反应器内反应液体的温度。但如本实验测量结果所示,这两者间有较大的差别。这种温度差以前很少有研究者考虑,在众多甲烷水合物生成模型研究中,恒温箱设定温度即被简单假定为反应体系温度[7-9],这种假定会给模型参数的拟合带来很大的偏差,在以后的研究中需要认真考虑。

图6 盘管流量为3.5 L/min时,制冷液温度对甲烷水合物生成的影响
从图5~6可以看出,在实验条件范围内,当流量相同时,制冷液温度越低,甲烷水合物合成热越容易被带走,体系温度越低,甲烷水合物合成速度越快。但同时还可以看出,当制冷液温度降低到一定程度时,对甲烷水合物合成速度的影响逐步减小,如制冷液温度为272.15 K和271.15 K时结果所示。因为此时水相温度在整个反应过程中可以一直保持在较低温度范围内,热传递不再是控制甲烷水合物合成速度的主要因素,体系反应速度受甲烷水合物自身合成速度即反应动力学的控制。
2.3 制冷液流量对甲烷水合物生成的影响
本节实验考察了温度相同时制冷液流量对甲烷水合物合成的影响,实验结果见图7~9。从图7可以看出,当制冷液温度较高时,流量越大,甲烷水合物合成速度越快。当制冷液温度较低时,流量对甲烷水合物合成速度的影响开始变小。对比图8和图9可以看出,当制冷液温度较高时,流量不同,反应过程中液相温度差别较大,如流量为7.0 L/min和2.0 L/min时,液相整体温差为2~3 K。而当制冷液温度较低时,流量虽不同,但反应过程中液相温度均保持在一个较为狭小的范围内,差别较小。这是因为,当制冷液温度较高时,反应过程中体系温度与制冷液温度之差较小,此时增大流量可以更快地带走甲烷水合物合成时放出的热量,使得体系温度较低,甲烷水合物合成速度较快。当制冷液温度较低时,两者之间的温差较大,在流量较小的情况下,制冷液也可以带走较多的热量。

图7 制冷液流量对甲烷水合物合成的影响

图8 制冷液温度为273.15 K时,不同流量下反应器中的液相温度
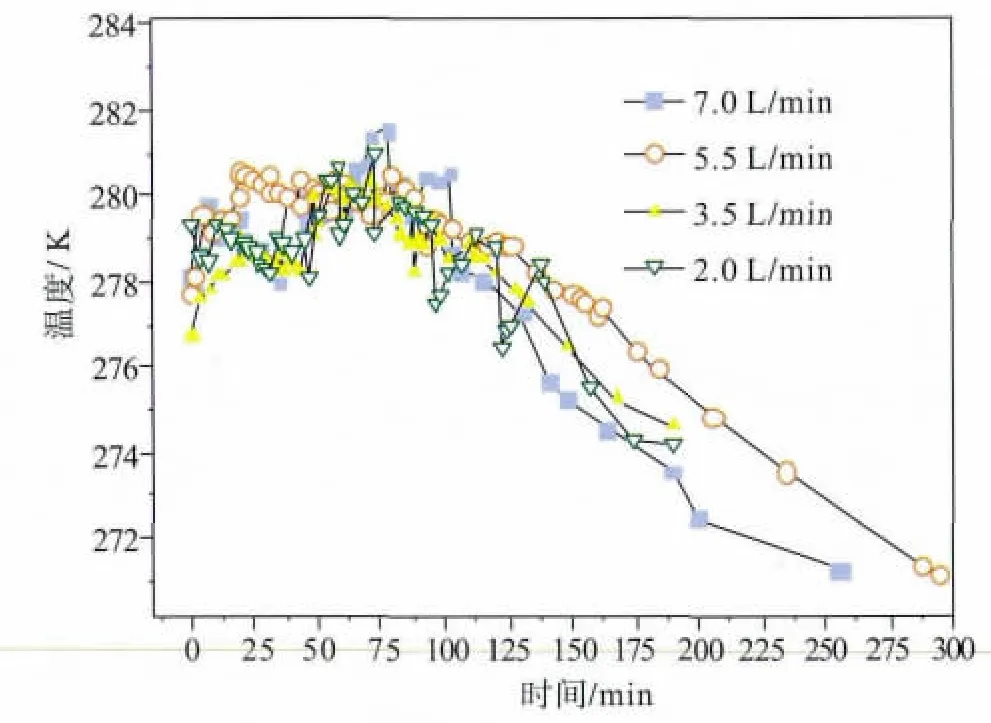
图9 制冷液温度为271.15 K时,不同流量下反应器中的液相温度
2.4 气相温度对甲烷水合物合成的影响
在长期的实验过程中,发现气体温度对甲烷水合物的合成也有较大的影响,对此进行了研究,结果见图10。图10中标出的温度为气体经过冷却后进入反应器前的初始温度。由于节流效应,气体注入反应器后的温度低于注入反应器前的温度。反应过程中气体的实际测量温度见图11。各组实验过程中,除气体温度外,其它实验条件保持相同。
从图10~11可以看出,反应器中气体初始温度越高,甲烷水合物合成诱导时间越长,合成速度越慢。而当气相温度足够低时,甲烷水合物合成诱导期基本消失,且反应速度较快。当气体初始温度为281.75 K时,气体充入反应器数分钟后甲烷水合物即开始合成。而当气体初始温度为286.35 K时,由于整个实验过程中气体温度一直保持在282 K以上,见图11。经过约3 h的诱导后,甲烷水合物才开始慢慢合成,且合成速度较慢,见图10。这充分说明气体温度对甲烷水合物的合成有很明显的影响,但以前的研究中,很少对此进行认真考虑,实际过程中值得引起进一步的研究和重视。

图10 气体温度对甲烷水合物合成过程中耗气量的影响
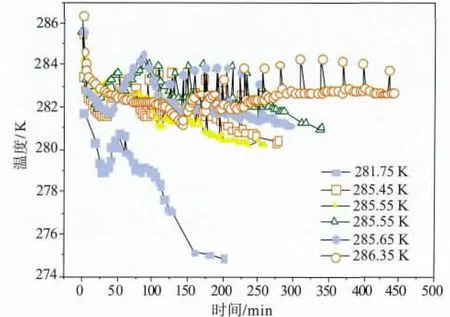
图11 不同初始气体温度条件下合成甲烷水合物过程中测量的气体实际温度值
3 结论
a)当较大量合成甲烷水合物时,传热是影响甲烷水合物合成速度的主要因素。如果甲烷水合物合成热不能被及时带走,液相温度将迅速上升,导致甲烷水合物合成速度变慢甚至停止合成甲烷水合物。
b)气相温度对甲烷水合物的合成速度也有很大的影响,气相温度越高,甲烷水合物合成诱导期越长,合成速度越慢。
c)实验发现,甲烷水合物合成过程中反应器中的液相温度比制冷液的设定温度高8 K左右,比反应液体的设定温度高4~6 K。并不像部分模型研究假定的那样实验设定控制温度即等于反应液相温度,这种差别在模型研究中特别值得注意。
[1]熊 颖,王宁升,丁 咚,等.天然气水合物的应用技术[J].天然气与石油,2008,26(4):12-15.Xiong Ying,Wang Ningsheng,Ding Dong,et al.Application technology of Natural Gas hydrate(NGH)[J].Natural Gas and Oil,2008,26(4):12-15.
[2]刘雪梅,谢 英,杨挺志,等.一种煤层气储运技术及其应用[J].天然气与石油,2008,26(3):19-23.Liu Xuemei,Xie Ying,Yang Tingzhi,et al.Technology for coalbed Gas Storage and Transportation and its Application[J].Natural Gas and Oil,2008,26(3):19-23.
[3]Zhong Y,Rogers R E.Surfactant Effects on Gas Hydrate Formation[J].Chemical Engineering Science,2000,55 (19):4175-4187.
[4]Karaaslan U,Parlaktuna M.Surfactants as Hydrate Promoters?[J].Energy&Fules,2000,14(5):1103-1107.
[5]宋 琦,王树立,陈 燕,等.复合型添加剂对天然气水合物生成条件的实验及理论研究[J].天然气与石油,2010,28(5):9-13.Song Qi,Wang Shuli,Chen Yan,et al.Reserch on Effects of Compoand Additives on Gas Hydrate Formation Conditions[J].Natural Gas and Oil,2010,28(5):9-13.
[6]Pang W X,Chen G J,Dandekar A,et al.Experimental Study on the Scale-up Effect of Gas Storage in the Form of Hydrate in a Quiescent Reactor[J].Chemical Engineering Science,2007,62(8):2198-2208.
[7]Englezos P,Kalogerakis N E,Dholabhai P D,et al.Kinetics of Formation of Methane and Ethane Gas Hydrates[J].Chemical Engineering Science,1987,42(11):2647-2658.
[8]Englezos P,Kalogerakis N E,Dholabhai P D,et al.Kinetics of Gas Hydrate Formation from Mixtures of Methane and Ethane[J].Chemical Engineering Science,1987,42(11):2659-2666.
[9]Clarke M A,Bishnoi P R.Determination of the Intrinsic Kinetics of CO2Gas Hydrate Formation Using in Situ Particle Size Analysis[J].Chemical Engineering Science,2005,60(3):695-709.

