不同逆转录载体系统应用于水牛胎儿成纤维细胞转基因的探索
邓彦飞,刘真真,李云芳,刘庆友,罗 婵,杨素芳,石德顺
(广西大学 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁530005)
水牛是我国南方重要的家畜品种之一,具有役用、肉用和奶用等多种用途.水牛低繁殖力、低产奶量一直是传统方式进行育种改良的难题,采用先进的转基因克隆技术有望提高水牛的生产性能.在转基因技术中,选用合适的方法达到基因转移和表达是生产转基因动物的第一步.常用的转基因方法主要包括:氯化钙法、脂质体法、电转染法和病毒载体法等[1].目前,常用于运载目的基因的病毒载体主要包括逆转录病毒载体、慢病毒载体和腺病毒载体.逆转录病毒载体法以其自身高效的转基因效率,最早被用于基因治疗、转基因研究和诱导多能干细胞(iPSC)的研究中[2-3].一些常用的逆转录病毒载体有pMSCV、pMIG、pMX 和pLXSN 等.
逆转录病毒载体转基因系统主要包括运载外源基因的载体,稳定转染到包装细胞的包装蛋白(gagpol)和包膜质粒携带包膜蛋白(env)[4].病毒的包膜蛋白决定重组病毒的靶向性,包膜蛋白能否与靶细胞上的受体结合,是病毒载体实现基因转移成功与否的关键.不同物种或同一物种的不同类型细胞,因其细胞表面的受体不同,与不同逆转录病毒的结合能力也不相同.本研究选用2 种不同的逆转录病毒包装体系:一种是由小鼠胚胎干细胞病毒(Murine embryonic stem cell virus,M-ESV)改造而来的逆转录病毒载体系统pMSCV(pMSCV +PT67 包装细胞系),可以通过筛选稳定的产毒细胞系生产重组病毒.另一种是由莫洛尼小鼠白血病病毒(Moloney murine leukemia virus,M-MLV)改造而来的pMX 逆转录病毒载体系统(pMX+包膜质粒pCMV-VSVG +Platinum-GP 包装细胞系),通过病毒包装后由瞬时产毒细胞生产重组病毒.试验中,将携带EGFP 基因的重组逆转录病毒载体pMX-EGFP 和pMSCV-EGFP,分别经过病毒包装后感染水牛胎儿成纤维细胞(BFFs),筛选出适用于BFFs的转基因逆转录病毒系统.在最适逆转录病毒系统下,探索能提高感染BFFs 效率的感染方式.本研究将为逆转录病毒法转基因水牛的生产和水牛iPSC 的研究提供技术依据.
1 材料与方法
1.1 主要材料与试剂
3~5月龄水牛胎儿取自南宁市屠宰场,pMSCV和pMX 逆转录病毒载体、PT67/Platinum-GP 包装细胞由广西大学郑喜邦老师惠赠,NIH3T3 细胞和293细胞由广西大学亚热带农业生物资源保护与利用国家重点实验室保存,pEGFP-C1 由广西大学亚热带农业生物资源保护与利用国家重点实验室保存,DMEM高糖基础液体培养基(GIBCO),青霉素、链霉素(双抗,100×,GIBCO),胎牛血清(FBS,Hyclone),脂质体转染试剂(LTX,Invitrogen),G418、促感染剂Polybrene(Sigma),胰酶(Sigma),pMD18-T 克隆载体、Taq 酶、内切酶(EcoR Ⅰ和Xho Ⅰ)和T4 连接酶(TaKaRa),质粒去内毒提取试剂盒(QIAGEN),倒置显微镜(Nikon),活细胞工作站荧光检测(Nikon Ti),0.22 和0.45 μm 滤器(Millipore),引物合成和序列测定(上海生工生物工程有限公司).
1.2 表达载体构建
以pEGFP-C1 载体为模版,采用带有EcoRⅠ(上游)和Xho Ⅰ(下游)酶切位点的特异性引物(EGFP5'-GAATTCATGGTGAGCAAGGGCGAGGAG,EGFP3'-CTCGAGTTACTTGTACAGCTCGTCCATG)扩增EGFP 基因的编码区,连接到pMD18-T 上,构成pMD18T-EGFP 载体.采用EcoRⅠ和XhoⅠ分别双酶切pMD18T-EGFP、pMSCV 和pMX 质粒.将酶切获取的EGFP、pMSCV 和pMX 分别经过胶回收之后,采用T4 连接酶,将EGFP 分别连接到pMSCV 和pMX 上,最终获取能表达EGFP 的逆转录病毒载体pMSCVEGFP 和pMX-EGFP.
1.3 细胞培养
水牛胎儿成纤维细胞的培养:取水牛胎儿耳部的皮肤组织,PBS 洗3 次,体积分数为75%乙醇消毒30 s,再用PBS 洗3 次,将组织块放入1.5 mL 的EP 管中,剪碎,用PBS 冲洗到50 mL 的离心管中,加入5~10 mL 胰酶(2.5 mg/mL),37 ℃条件消化10~15 min(每隔3~5 min 用移液管吹打10 下),加入30 mL 左右的DMEM完全培养基(DMEM+体积分数10% FBS),混匀之后接种到10 cm 培养皿,放入37 ℃、体积分数为5% CO2培养箱,每隔3~4 d 换液1 次,待细胞长到80%左右汇合度时,胰酶消化传代或者液氮冻存备用.PT67 和Platinum-GP 病毒包装细胞系、NIH3T3 和293 病毒滴度测定细胞系均采用DMEM+体积分数10%FBS 培养,胰酶消化法传代,液氮保存备用.
1.4 逆转录病毒包装
pMSCV-EGFP 稳定产毒细胞系的筛选:将PT67细胞接种到60 mm 细胞培养皿里,待细胞到60%~70%的汇合度时进行细胞转染.转染前2 h 将培养基改换无血清无双抗的DMEM(双无DMEM)3 mL.采用脂质体LTX + Plus 法进行转染:取1 mL 双无DMEM,加入pMSCV-EGFP 质粒9 μg 和Plus 9 μL,混匀,室温孵育5 min;加入LTX 12 μL,混匀,室温孵育30 min 后,均匀滴加到PT67 细胞培养基中;5 h 后改换DMEM 完全培养基,转染后48 h 收集病毒上清液,0.45 μm 的滤器过滤备用.若需要建立稳定的产毒细胞系,转染后48 h 传代,在培养基中添加600 μg/mL 的G418 进行筛选,每隔3 d 换液,筛选21 d后克隆形成,荧光显微镜下通过EGFP 表达挑选克隆,扩大培养后将细胞冻存.将细胞复苏后48 h 收集病毒上清液,过滤备用.
pMX-EGFP 逆转录病毒的包装:将Platinum-GP包装细胞接种到60 mm 培养皿里.转染步骤同使用脂质体LTX 的转染方法.其中采用pMX-EGFP 和包膜质粒pCMV-VSVG(水泡口炎病毒包膜蛋白)共转Platinum-GP 包装细胞,按照6 μg pMSCV-EGFP 质粒+3 μg pCMV-VSVG(质量比为2∶1)的量进行.转染48 h 后,即可收集病毒上清液,0.45 μm 的滤器过滤备用.
1.5 逆转录病毒的浓缩
本试验采用超速离心的方法对病毒进行浓缩.由于pMSCV 和pMX 逆转录病毒系统所使用的包膜蛋白不同(分别是10A1 和VSV-G),在超速离心力的作用下不会对VSV-G 所包装出的病毒颗粒造成破损[5].因此,本试验仅对pMX 逆转录病毒系统所产生的病毒上清液进行超速离心浓缩.超速离心的参数是:12 000 r/min,4 ℃,120 min.离心后,去掉上清液,加入PBS 重悬底部的病毒颗粒,分装备用.
1.6 病毒滴度测定
采用经典的LaSRT 病毒滴度测定法,通过EGFP标记的阳性细胞数量计算滴度.pMSCV-EGFP 逆转录病毒滴度测定:在滴度测定前20 h 左右,接种NIH3T3 细胞于96 孔板,每9 个孔为1 组.添加病毒上清液前,换成体积分数为2% FBS 的DMEM 培养基90 μL,在第1 个孔加入10 μL 新鲜病毒上清液(病毒包装48 h 后直接收集的病毒上清液),以后每个孔按体积比10∶1 倍比稀释.感染48 h 后,荧光显微镜下统计EGFP 的阳性细胞数,以无EGFP 表达的前一个孔作为计量孔.计量孔EGFP 阳性细胞数记为m,按照以下公式计算病毒的滴度:病毒滴度=m×(计量孔相对于第1 孔的稀释倍数×1 IU)/第1孔加入病毒上清液的体积.新鲜病毒上清液和超速离心浓缩后的pMX-EGFP 逆转录病毒滴度测定:滴度测定步骤与pMSCV-EGFP 逆转录病毒滴度测定相同,用于滴度测定的细胞为293 细胞.
1.7 逆转录病毒感染BFFs
将BFFs 复苏后,传至第3~5 代,感染时的细胞汇合度为70% 左右,感染时添加病毒的感染复数(Multiplicity of infection,MOI)为30~40,同时添加6 μg/mL Polybrene 促进感染.感染BFFs 时分别按照以下几种方式进行:①pMSCV 逆转录病毒上清液感染BFFs 1 次,感染24 h;②pMSCV 稳定产毒细胞系的病毒上清液感染BFFs 2 次,每次感染12 h;③pMX逆转录病毒上清液感染BFFs 1 次,感染24 h;④pMX逆转录病毒上清液感染BFFs 2 次,每次感染12 h;⑤超速离心后的pMX 逆转录病毒感染BFFs 1 次,感染24 h.感染24 h 后,改换为DMEM 完全培养基,72 h后在活细胞工作站荧光检测EGFP 的表达情况.
2 结果与分析
2.1 构建逆转录病毒表达载体
pMSCV-EGFP 和pMX-EGFP 重组质粒的构建过程见图1 和图2.
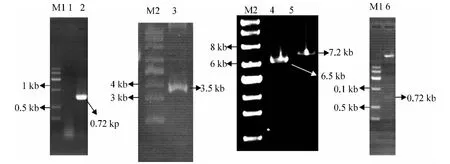
图1 pMSCV-EGFP 逆转录表达载体构建Fig.1 The construction of pMSCV-EGFP retrovirus vector
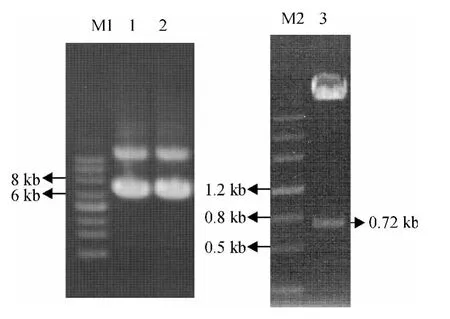
图2 pMX-EGFP 逆转录表达载体的构建Fig.2 The construction of pMX-EGFP retrovirus vector
PCR 扩增得到EGFP 的长度为0.72 kb(图1-泳道2),将EGFP 连接到pMD18-T 载体上(图1-泳道3),经过EcoRⅠ和XhoⅠ双酶切后,T4 连接酶连接到经过相同双酶切的pMSCV 和pMX 载体上,组建pMSCV-EGFP 和pMX-EGFP 表达质粒(图1-泳道5 和图2-泳道1、泳道2).采用EcoRⅠ和XhoⅠ对2 个表达质粒进行双酶切鉴定后可以看到明显的目的条带(图1-泳道6 和图2-泳道3).
2.2 病毒的包装和阳性产毒细胞株的筛选
将pMSCV-EGFP 转入包装细胞PT67,48 h 后在荧光显微镜下可以观察到EGFP 的表达(图3A).将细胞分盘培养后,添加600 μg/mL 的G418 进行筛选,获得能稳定生产逆转录病毒并表达EGFP 细胞株(图3B).同样,pMX-EGFP 结合pCMV-VSVG 共转platinum-GP 细胞,48 h 后同样能检测到EGFP 的表达(图3C).

图3 病毒包装和产毒细胞系的荧光检测Fig.3 EGFP expression in the packaging cells after virus packaging
2.3 逆转录病毒滴度
采用NIH3T3 细胞和293 细胞分别对2 种逆转录病毒的滴度进行检测.结果发现,pMSCV 和pMX逆转录系统包装出来的病毒滴度都可达106;pMX 逆转录病毒系统所包装的病毒经过超速离心浓缩后可达107(图4).

图4 不同逆转录病毒的滴度测定Fig.4 Virus titer test of different retroviruses
2.4 不同逆转录病毒系统感染BFFs
筛选能有效感染BFFs 的不同逆转录病毒系统和最佳感染方式,荧光显微镜下观察BFFs 中EGFP的表达情况.结果表明:采用pMSCV-EGFP 病毒上清液感染BFFs 1 次或者2 次,荧光视野下只有少量的BFFs 表达EGFP,尤其是1 次感染组只有零星的细胞表达EGFP(如图5A、5B);而采用pMX-EGFP 病毒上清液感染BFFs 1 次后可以看到大部分细胞呈EGFP 阳性(如图5C),当采用2 次感染的方式或者超速离心浓缩后感染BFFs 1 次可以显著地提高感染效率(图5D、5E).因此,pMX 系统比pMSCV 逆转录病毒系统更适合于感染BFFs,能有效地实现基因的转移和表达.同时,增加病毒的感染次数和提高病毒的滴度可以显著提高逆转录病毒感染BFFs 的效率.

图5 2 种逆转录病毒感染BFFs 后荧光检测Fig.5 EGFP expression in BFFs after retrovirus infection
3 讨论
本研究主要探索能高效实现基因转移并在BFFs中表达的逆转录病毒载体系统.构建能表达绿色荧光蛋白的pMSCV-EGFP 和pMX-EGFP 2 种逆转录病毒表达载体,经过各自的病毒包装体系生产重组病毒,感染BFFs,通过EGFP 在BFFs 中的表达情况,确定能高效感染BFFs 的逆转录病毒系统.同时,采用病毒1 次感染、2 次感染和超速离心浓缩后感染等3种方式感染BFFs,探讨能高效感染BFFs 的最佳感染方式.结果表明:pMX 逆转录病毒系统感染BFFs 的效率高于pMSCV 逆转录病毒系统;pMX 逆转录病毒2 次感染或者超速离心后感染的方式能更有效地感染BFFs.
目前,容易被逆转录病毒感染的靶细胞主要是人和小鼠的细胞,病毒法在人和小鼠细胞的转基因操作中应用最多[6].由于物种间和细胞间的差异,其他物种的体细胞能否通过合适的逆转录病毒系统,实现基因转移和表达,有待进一步探索.这主要是因为不同重组逆转录病毒系统生产的假病毒在感染体细胞时具有靶向性,感染不同靶细胞的效率不同.逆转录病毒在携带目的基因进入靶细胞,并实现表达的过程中,受到诸多因素的影响,如逆转录病毒载体的结构、包装细胞包装病毒的稳定性、包膜蛋白的靶向性、靶细胞表面的受体和靶细胞的生长状态等[7].本研究所使用2 种经典的逆转录病毒系统中,pMSCV 的包装细胞为经过NIH3T3 改造而来的PT67 细胞,整合了病毒包装所需的gag-pol 和包膜蛋白10A1[8];pMX 的包装细胞为经过293 细胞改造而来的Platinum-GP 细胞,整合了gag-pol,而包膜蛋白需要另外的包装质粒(本试验使用pCMV-VSVG)提供[7].结果表明,pMX 逆转录病毒系统所包装的逆转录病毒感染BFFs 的效率显著高于pMSCV 系统.除了BFFs 不易被感染之外[9],不同包装系统本身的组成也会影响感染效率:如pMX 载体骨架本身表达外源基因的能力高于pMSCV;pMSCV 所使用的包装细胞PT67 整合了全部逆转录病毒包装所需的元件,长期的体外扩增可能会导致某个元件丢失或者重组,影响包装病毒的能力;2 个包装系统所使用的包膜蛋白不同,VSV-G 包装出的病毒为泛嗜性逆转录病毒(Pantropic retrovius),能感染的靶细胞范围较广,而10A1 所包装出的病毒为兼嗜性逆转录病毒(Amphotropic retrovius),感染靶细胞的范围相对较窄;与之对应的是,水牛体细胞上所存在的能结合不同病毒的受体和受体的量也会影响感染效率[6].
在找到能感染BFFs 的合适逆转录病毒包装系统之后,病毒的滴度和不同的感染方式也会影响逆转录病毒的感染效率.一个细胞所接触的病毒颗粒的数量,即感染复数的大小,是决定病毒能否结合靶细胞的重要因素.通常采用对病毒进行超速离心浓缩,或者增加感染次数来提高病毒的滴度和感染复数[10].本研究对pMX 逆转录病毒系统包装的病毒进行超速离心后感染BFFs 1 次,或者使用新鲜病毒感染BFFs 2 次,都能更有效地感染BFFs.这说明,对于一些不易被感染的细胞,可以通过提高病毒的滴度和增加感染次数来提高感染效率.同时,本试验中也添加了促感染试剂Polybrene 对细胞进行处理,消除细胞和病毒颗粒之间的电荷排斥,促进感染效率.
值得说明的是,在同样的病毒滴度和感染方式下,pMSCV 系统不易感染BFFs,在荧光显微镜下只有零星的几个细胞表达EGFP.通过荧光显微镜就能准确地判断pMX 系统感染BFFs 的效率显著高于pMSCV 系统,因此,本试验没有采用流式细胞技术等统计感染效率.对适合于水牛体细胞转基因操作的逆转录病毒系统进行探索,可以为转基因水牛生产和水牛iPSCs 生产等提供研究基础.
[1]刘中华,王华岩,乔宪凤,等.转基因技术在动物遗传改良上的应用进展[J].湖北农业科学,2009,48(2):481-486.
[2]BUSHMAN F D.Retroviral integration and human gene therapy[J].J Clin Invest,2007,117(8):2083-2086.
[3]TAKAHASHI K,YAMANAKA S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676.
[4]MILLER A D,ROSMAN G J.Improved retroviral vectors for gene transfer and expression[J].Biotechniques,1989,7(9):980-990.
[5]BURNS J C,FRIEDMANN T,DRIEVER W,et al.Vesicular stomatitis virus G glycoprotein pseudotyped retroviral vectors:Concentration to very high titer and efficient gene transfer into mammalian and nonmammalian cells[J].Proc Natl Acad Sci USA,1993,90(17):8033-8037.
[6]ANNENKOV A E,DALY G M,CHERNAJOVSKY Y.Highly efficient gene transfer into antigen-specific primary mouse lymphocytes with replication-deficient retrovirus expressing the 10A1 envelope protein[J].J Gene Med,2002,4(2):133-140.
[7]KITAMURA T,KOSHINO Y,SHIBATA F,et al.Retrovirus-mediated gene transfer and expression cloning:Powerful tools in functional genomics[J].Exp Hematol,2003,31(11):1007-1014.
[8]MILLER A D,CHEN F.Retrovirus packaging cells based on 10A1 murine leukemia virus for production of vectors that use multiple receptors for cell entry[J].J Virol,1996,70(8):5564-5571.
[9]DENG Yanfei,LIU Qingyou,LUO Chan,et al.Generation of induced pluripotent stem cells from buffalo(Bubalus bubalis)fetal fibroblasts with buffalo defined factors[J].Stem Cells Dev,2012,21(13):2485-2494.
[10]叶玲玲,许建,李世崇,等.基于逆转录病毒载体的外源基因表达系统的评价和应用[J].生物工程学报,2011,27(8):1225-1231.

