杂交竹白纹羽病生防菌的筛选与应用
朱天辉,李姝江,韩 珊,谯天敏,张丽娜,邵宝林
(四川农业大学林学院,四川 雅安 625014)
撑×绿杂交竹是南方重要的经济用材竹,也是四川等地引种发展的主要经济竹种之一[1]。近年来,由褐坚壳菌[Rosellinia necatrix (Hart.)Berl.]引起的杂交竹白纹羽病[2]导致根系腐烂、竹整株枯死,造成较大的经济损失,极大地威胁着长江中上游地区退耕还林进程和生态屏障建设[1,3]。目前主要采用化学防治和营林技术,而生物防治措施研究尚未涉及。化学防治虽是一种有效的防治手段,但存在病原菌抗药性、环境与食品安全、药害等许多实际问题,一些化学杀菌剂在许多发达国家和地区已严格限制使用[4,5]。而与环境友好的生物农药越来越受到人们的青睐,是未来农业可持续发展的重要组成部分[6-9]。该病土传根病侵染循环不明显,发病环境相对稳定,最适宜于生物防治。本文以健康杂交竹根际土中芽孢杆菌为筛选对象,通过初筛、复筛、盆栽试验获得目标菌株,在此基础上,经发酵培养后进行生防研究,以期为环保型生防制剂研究提供技术支撑。
1 材料与方法
1.1 供试病原菌
供试病原菌为杂交竹白纹羽病菌[Rosellinia necatrix (Hart.)Berl.],分离于雅安某杂交竹林地。
1.2 芽孢杆菌的分离和纯化
取健康杂交竹根际土壤(表层10 cm 以下)装入无菌样品袋带回实验室,备用。每份样品称量10 g 转至装有90 mL 生理盐水和少量玻璃珠的三角瓶中,充分混匀后制成土壤悬浮液,放入100 ℃水浴中加热5 min。冷却后,无菌条件下取1 mL 加入装有9 mL 无菌水的试管中,充分混匀得到10-2的样品稀释液,按照此法依次稀释,分别获得10-3、10-4、10-5和10-6的土壤稀释液,取10-3、10-4、10-5和10-6的土壤稀释液各0.1 mL,分别采用稀释平板涂布法[10]将其涂布在LB 培养基上,倒置在30 ℃恒温培养箱中,48 h 后根据菌落形态特征,挑取单菌落进行平板划线,以保证菌落纯度,分别保存于斜面备用。
1.3 生防芽孢杆菌的初筛
将斜面培养的产孢白纹羽病菌用无菌水洗出分生孢子,用移液枪取1 mL 加入无菌培养皿中,然后倒入45 ℃左右的PDA 培养基15 mL,充分混合均匀,冷却后制成含菌平板。采用点菌法[11],接种分离获得的芽孢杆菌,倒置在30 ℃恒温培养箱中,24 h 后观察有无抑菌圈产生进行生防芽孢杆菌的筛选,并做好记录。
1.4 发酵液活性的测定(复筛)
1.3 筛选出抑菌活性较强的芽孢杆菌菌株,活化后分别将其接种于LB 肉汤培养液中,30 ℃,120 r·min-1的恒温摇床中培养,培养24 h 后,作为种子液以1∶1比例加入含有葡萄糖的LB 肉汤培养基,30℃,120 r·min-1的恒温摇床中培养48 h 后取出,用牛津杯法和打孔法[12]进行抑菌试验,检测发酵液是否有抑菌活性。
1.5 发酵滤液活性的测定
用移液枪吸取5 mL 经过24 h 培养的种子液,加入装有45 mL 含葡萄糖的LB 肉汤培养液的250 mL 三角瓶中,30 ℃,120 r·min-1的恒温摇床中培养,36 h 后,经3 000 r·min-1,离心5 min 后,取上清液,用0.2 μm 细菌过滤器过滤,获得无细胞发酵滤液。取0.1 mL 病原菌稀释液涂布于平板上,采用牛津杯法、打孔法[12]测定发酵滤液对病原菌的抑菌活性,重复3次,并设对照,2 d 后测量抑菌圈直径。
同时对发酵液进行121 ℃,15 min 高温处理,按照上述方法检测拮抗活性的有无。
结合1.3 和1.4 实验结果,筛选出最佳生防芽孢杆菌进行后续试验。
1.6 盆栽试验
选取一年生盆杂交竹为实验对象,PDA 斜面白纹羽病菌分生孢子(106cfu·mL-1)接种根系一周后,用筛选出的生防菌经发酵后,取其发酵液采用灌根法分不同浓度(原液、50 倍、100 倍、200 倍、500倍、1 000倍)对竹苗进行灌根处理,每盆200 mL,并以无菌水作对照,重复3次,统计杂交竹发病情况。
1.7 生防芽孢杆菌的鉴定
1.7.1 形态特征观察
将待测菌株接种在LB 琼脂培养基上,24 h 后观察菌落颜色、质地、光学特性、色素、边缘及形态。
1.7.2 个体形态观察
对待测细菌进行革兰氏染色、芽孢染色和菌体形状进行观察[13]。
革兰氏染色:取一张干净的载玻片,在其中央滴加一滴无菌水,用接种环蘸取少量培养18 h~24 h的待测芽孢杆菌进行涂片固定,待风干后在涂片位置滴加结晶紫进行初染,1 min 后用自来水进行冲洗,待无明显紫色后甩掉多余水分,滴加碘液进行媒染,1 min 后用自来水进行冲洗,甩掉多余水分后滴加95%的酒精进行脱色,脱色时需轻轻晃动,20 s后用自来水冲洗,去掉多余水分滴加番红进行复染,2 min 后用自来水冲洗,去掉多余水分待风干后进行镜检。如果镜检菌体颜色为紫色,说明待测菌为革兰氏阳性菌;颜色为红色,待测菌为革兰氏阴性菌。
芽孢染色:在干净的载玻片中央滴加少量无菌水,用接种环蘸取培养72 h 后的待测菌进行涂片固定,在涂片位置滴加甲醇,30 s 后倾掉并用酒精灯火焰进行干燥,滴加番红进行染色,在酒精灯火焰上方加热(略见蒸汽时为宜,防止染液过快蒸发),维持1 min 稍冷却后去掉多余染液,用自来水进行冲洗,待风干后镜检。
1.7.3 生理生化鉴定
根据菌体和菌落形态特征、革兰氏染色等,结合生理生化鉴别试验,参照《伯杰氏细菌鉴定手册》(第8 版)[14]进行鉴定。
1.8 田间防治
1.8.1 B2 液体制剂制作
①一级斜面种子:常规方法制作牛肉膏蛋白胨斜面培养基(牛肉膏7 g,蛋白胨10 g,NaCl5 g,琼脂17 g,水1 000 mL),接种蜡样芽孢杆菌B2 后在26℃~28 ℃下培养24 h~36 h 制成一级种子。
②二级液体种子:营养肉质培养液(牛肉膏7 g,蛋白胨10 g,NaCl5 g,竹根浸渍液1 000 mL)经高压灭菌后,按100 mL 液体盛于300 mL 三角瓶比例(通氧控制)装瓶,在无菌状态接种蜡样芽孢杆菌B2斜面种子,每瓶接种两支斜面种子,温度26 ℃~28℃,初始pH 值6.0,120 r·min-1振荡培养36h,制成蜡样芽孢杆菌B2 液体种子。
③液体发酵:营养肉质培养液(牛肉膏7 g,蛋白胨10 g,NaCl5 g,竹根浸渍液1 000 mL)经高压灭菌后,按200 mL 液体盛于500 mL 三角瓶比例(通氧控制)装瓶,在无菌状态接种B2 液体种子,接种量10%(体积比),温度26 ℃~28 ℃,初始pH 值6.0,120 r·min-1振荡培养72 h,制成B2 液体制剂。
1.8.2 田间预防与治疗试验
①预防处理:选择未发病杂交竹用上述液体制剂0~1 000倍(体积比)稀释度沿根系幅面灌根,每株100 mL,每年春季施用一次,重复6次,用清水和70%甲基托布津1 000倍分别作对照。
②防治处理:选择发病杂交竹按0~1 000 倍(体积比)稀释度沿根系幅面灌根及附近土壤淋灌,每株200 mL,春、夏各1次,连续3 a,用清水和70%甲基托布津800 倍分别作对照。
2 结果与分析
2.1 生防芽孢杆菌的初筛与复筛
分离共获得36株芽孢杆菌,根据菌落形态、颜色、边缘、光学特性以及是否产生色素进行合并后,共25株(表1)。分别通过点菌法进行拮抗测定,筛选出杂交竹白纹羽病菌具有较强拮抗做用的菌株4株。抑菌圈直径达到5 mm 以上的共3株,其中B2菌株拮抗作用最强,抑菌圈直径均达到14 mm 左右;其次是B21,抑菌圈直径均达到8 mm 左右;B2A抑菌圈最小,仅达到3 mm。
待测生防菌株发酵后,静置,取上清液,3500 r·min-1,离心5 min,取上清液分别采用打孔法、牛津杯法对指示病原菌进行拮抗测定。
采用打孔法,将指示病原菌分生孢子接种在平板上,直径5 mm 打孔器打孔后,在孔中加入待测的生防菌发酵液,测得B2A、B21 基本不产生抑菌圈,而B2 菌株抑菌圈直径达到20 mm ±0.6 mm,说明B2 对杂交竹白纹羽病菌具有较好的抑制作用。
采用牛津杯法对发酵液进行拮抗活性的测定,测得B2 具有一定的拮抗活性,发酵液对病原菌的抑菌圈直径达到13 mm±0.5 mm,而B2A 和B21 基本看不出抑菌圈,发酵液无抑菌活性。

表1 生防菌株初筛结果Table 1 Screening results of biocontrol bacteria
2.2 目标芽孢杆菌生物活性
B2 菌株经发酵后,取其上清液用细菌过滤器(直径0.2 μm)过滤后获得无菌发酵滤液,用打孔法和牛津杯法分别测定抑菌活性测定。结果表明,B2 菌株经发酵后获得无细胞发酵滤液对指示病原菌表现出一定的拮抗效果,打孔法和牛津杯法产生的抑菌圈带宽分别为4 mm±0.5 mm 和3 mm±0.2 mm。发酵滤液经过121 ℃,15 min 高温处理后仍具有拮抗活性,说明抑菌代谢产物具有耐热性。
2.3 目标芽孢杆菌盆栽生防效果
B2 发酵液经稀释后,表现出不同的防治效果,原液至200 倍以下效果显著,特别是50 倍以下,可基本上控制病害不发生(表2)。
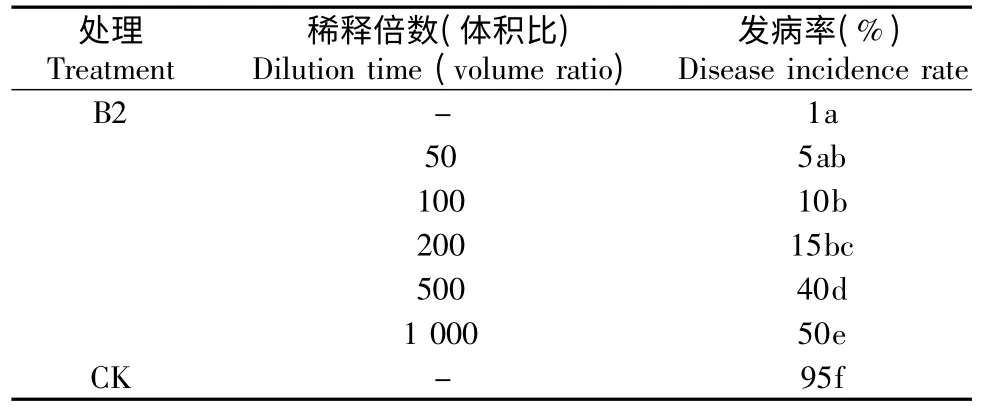
表2 盆栽试验30 d 后菌株B2 的防治效果Table 2 Control effect of B2 after 30 days of pot experiment
2.4 目标芽孢杆菌的分类地位
B2 菌株经LB 琼脂平板培养24 h 后,菌落扁平,颜色为乳白色,不透明,表面略粗糙,呈白蜡状,质地软,略有光泽,无色素,外形不规则近圆形,中部突起,边缘不整齐。显微镜下革兰氏染色呈阳性,菌体呈杆状,末端方,成短或长链,芽孢椭圆中生或近中。B2 芽孢杆菌的生理生化特征见表3,参照《伯杰细菌鉴定手册(第8 版)》,根据B2 菌株菌落形态特征、革兰氏染色和生理生化测定结果(表3),初步确定为蜡样芽孢杆菌Bacillus cereus。
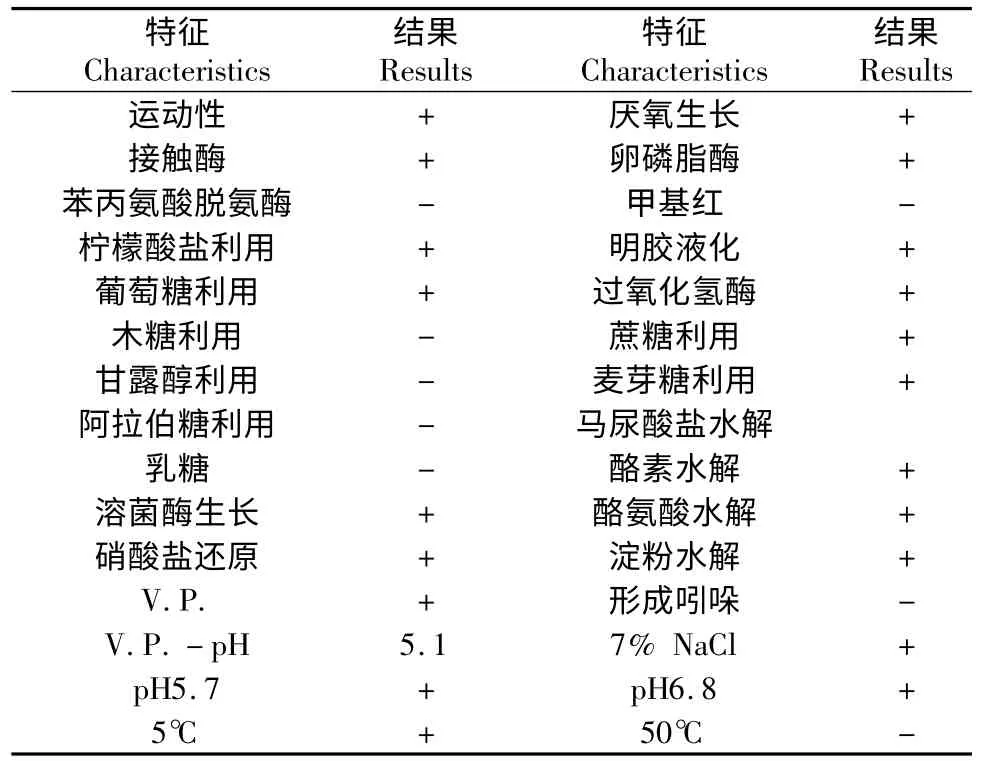
表3 B2 菌株的生理生化特征Table 3 Physiological-biological characteristics of B2
2.5 蜡样芽孢杆菌田间生防效果
在预防处理中,未发病杂交竹用上述液体制剂100 倍~200 倍(体积比)稀释度沿根系幅面灌根,每株100 mL,每年春季施用1次,可预防白纹羽病发生,且优于甲基托布津,甲基托布津预防效果与1000 倍生防制剂相当(表4)。
在防治处理中,发病杂交竹按50 倍~100 倍(体积比)稀释度沿根系幅面灌根及附近土壤淋灌,每株200 mL,春、夏各1次,连续3 a,可效治疗白纹羽病,且优于甲基托布津,而甲基托布津治疗效果与500 倍生防制剂相当(表5)。
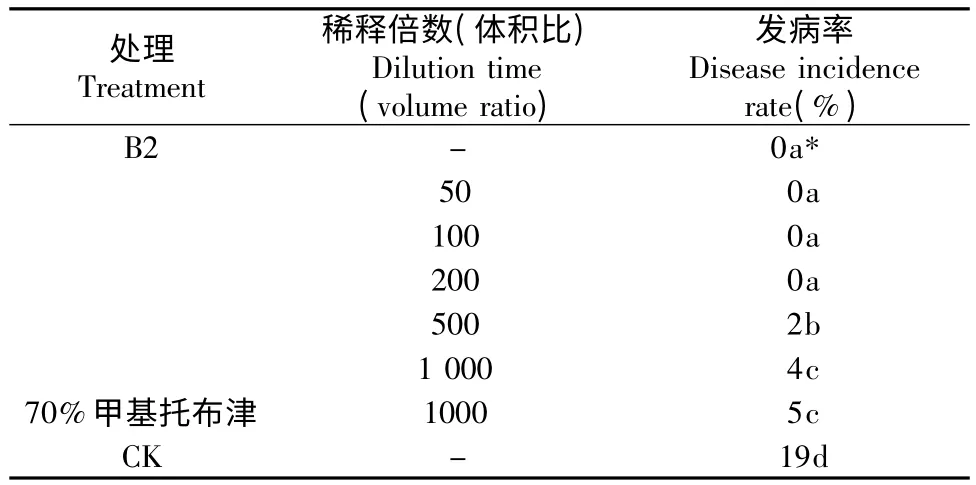
表4 B2 预防效果(1 a 生未发病杂交竹林地)Table 4 Prevent effect of B2 (one year old non-diseased hybrid bamboo)
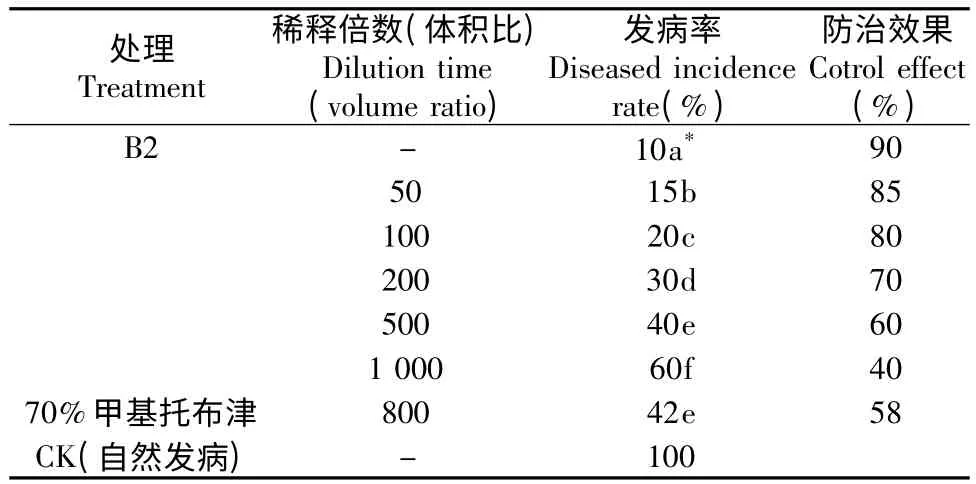
表5 B2 治疗效果(处理3 a 后发病杂交竹林地)Table 5 Control effect of B2 (diseased hybrid bamboo after treated for 3 years)
3 结论与讨论
众多研究表明,细菌有着其他微生物所不具备的优点,如种类和数量庞大,繁殖快速,作用方式多等等,以致在植物病害生物防治中有着非常重要的地位。目前,有18个属的细菌在植物病害生物防治上有潜力[15],特别是芽孢杆菌属的细菌,由于其抗逆性强、商贮性好,更是受到生防工作者重视。本文所分离的蜡样芽孢杆菌,对杂交竹白纹羽病菌拮抗作用强,能抗高温、干燥,易繁殖,是一种有较高开发价值的生防菌。
植物根标存在大量的有益微生物,现已从多种植物根际分离到对植物病害具有良好抑制效果的微生物[16~19],因此利用微生物防治撑×绿杂交竹白纹羽病可成为一种新途径,本文从杂交竹根际获得的芽孢杆菌,能很快定殖、占领土壤空间,排挤病原物,其防效持续、稳定,优于化学农药(甲基托布津)的效果。
[1]朱天辉,黄宗超,高强章,等.撑×绿杂交竹梢枯病病原及发生规律研究[J].中国森林病虫,2009,28(2):10~12,31.
[2]吴大春,刘宝花.笔柏根腐病病原及病原菌的寄生木霉研究[J].长江大学学报(自科版),2005,2(11):5~7,18.
[3]朱天辉,黄宗超,高强章,等.撑×绿杂交竹梢枯病调查及空间分布型研究[J].四川林业科技,2009,30(1):29~31,37.
[4]黄宗超,朱天辉.杂交竹枯梢病菌的室内杀菌剂筛选[J].中国森林病虫,2007,26(3):35~38.
[5]邱德文.我国植物病害生物防治的现状及发展策略[J].植物保护,2010,36(4):15~18.
[6]李潞滨,李术娜,李佳,等.毛竹枯梢病拮抗细菌分离鉴定及其拮抗物质[J].林业科学,2009,45(7):63~69.
[7]Robert W B,Eloise K.Fungal pathogens of Miconia calvescens(Melastomataceae)from Brazil,with reference to classical biological contro1[J].Mycologia,2007,99(1):99~111.
[8]Gabricle B,Christin Z,Jana L,et al.Impact of plant species and site on rhizosphere-associated fungi antagonistic to Verticillium daldiae Kleb[J].Applied and Environmental Microbiology,2005,71(8):4203~4213.
[9]余应建.一株撑绿杂交竹内生菌的分离鉴定及主要培养特性研究[J].安徽农学通报,2008,14(17):64~67.
[10]胡元森,朱明杰,宇光海,等.一株禾谷镰刀菌拮抗菌株的筛选与鉴定[J].南方农业学报,2013,44(2):234~239.
[11]张学君,凌宏通.生物农药麦丰宁B3 对小麦纹枯病菌的抑制作用[J].植物病理学报,1994,24(4):361~366.
[12]Rainey F A,Rainey N W,Kroppenstedt R M,et al.The genus Nocardiopsis represents a phylogenetically coherent taxon and a distinct actinomycete lineage:Proposal of Nocardiopsaceae fam.nov[J].International Journal of Systematic Bacteriology,1996,46(4):1088~1092.
[13]周德庆.微生物学实验手册[M].上海:上海科技出版社,1983.
[14]R.E.布坎南,N.E.吉本斯,等.伯杰细菌鉴定手册(第8 版)[M].北京:科学出版社,1984.
[15]陈海英,廖富蘋,林健荣,等.拮抗细菌在植物病害防治中的应用及展望[J].安徽农业科学,2008,36(20):8690~8691,8706.
[16]吴国江,王占利,李术娜,等.大丽轮枝菌拮抗细菌8-52 菌株的筛选与鉴定[J].河北农业大学学报,2009,32(4):66~70.
[17]任争光,宋庆丰,张志勇,等.杏树根际芽孢杆菌BJ-6 抗菌蛋白的分离纯化及抑菌机理[J].果树学报,2009,26(3):325~328.
[18]张慧,杨兴明,冉炜,等.土传棉花黄萎病拮抗菌的筛选及其生物效应[J].土壤学报,2008,45(6):1095~1101.
[19]江欢欢,程凯,杨兴明,等.辣椒青枯病拮抗菌的筛选及其生物防治效应[J].土壤学报,2010,47(6):1225~1231.

