乳腺叶状肿瘤的诊治分析
李大鹏
(赤峰市红山区中医院,内蒙古赤峰024000)
乳腺叶状肿瘤的诊治分析
李大鹏
(赤峰市红山区中医院,内蒙古赤峰024000)
目的:乳腺叶状肿瘤临床酷似纤维腺瘤,分析其临床病理特点并与乳腺纤维腺瘤鉴别.方法:对比治疗的乳腺叶状肿瘤和纤维腺瘤患者,回顾性分析临床特点.结果:所有患者均经手术治疗,术后5年生存率100%,乳腺叶状肿瘤术后复发率14.28%,纤维腺瘤术后复发率2.50%,分叶状肿瘤的误诊率37.5%.结论:临床表现不易鉴别,诊断主要依靠病理组织检查.术前空芯针穿刺为最佳方法.治疗均以手术切除为主.叶状肿瘤临床具有恶性倾向,手术要求切缘净.主要并发症是局部复发,其原因为手术技术所致.局部切除后反复复发者应行乳房切除.
乳腺叶状肿瘤;纤维腺瘤
前言:乳腺叶状肿瘤是一种少见的乳腺肿瘤,其生物学特性和临床表现多样,组织学分类和治疗方法都存在着不同意见,临床上误诊、漏诊率都比较高.且基础和临床研究均不够深入,治疗手段达不到科学规范,化疗放疗等一些临床实际问题没有统一的指导方案,处理方法及临床预后的不同,要求在手术前最好能作出明确诊断,但本病术前诊断手段匮乏,术前诊断率低,达不到指导手术的要求,部分医生对其认识不足,加剧了误漏诊和手术复发率.作者就多年对乳腺分叶状肿瘤的临床工作经验,结合文献资料,就该病的认识、术前诊断、手术切除规范和辅助治疗及预后情况提出自己的见解.
1 资料与方法
1.1 一般资料
乳腺分叶状肿瘤16例,乳腺纤维腺瘤123例,患者均为女性,年龄16~70岁,中位年龄46.5岁,临床表现均为乳腺肿块,具体情况见表:

分类例数快速生长皮肤静脉曲张与皮肤胸壁粘连活动度腋窝肿大淋巴结分叶状肿瘤168 95不良2纤维腺瘤1233 00良好0
1.2 治疗方法
所有患者均行手术切除,纤维腺瘤行腺瘤摘除,3例在切除灶邻近部位再次生长,二次摘除,分叶状肿瘤中行包块连同周围2cm正常组织切除9例,乳腺切除5例,改良根治术2例.分叶状肿瘤术后病理良性6例,交界性8例,恶性2例,腋窝淋巴结术后病理证实为转移,术后未进行放疗和化疗,乳腺切除术后2例局部复发行二次手术切除.
2 结果
门诊复查随访1~5年,无失访病人,5年生存率100%,2例分叶状肿瘤复发,二次复发率37.5%,3例纤维腺瘤复发,复发率2.50%,二次手术效果良好.比较结果如表:
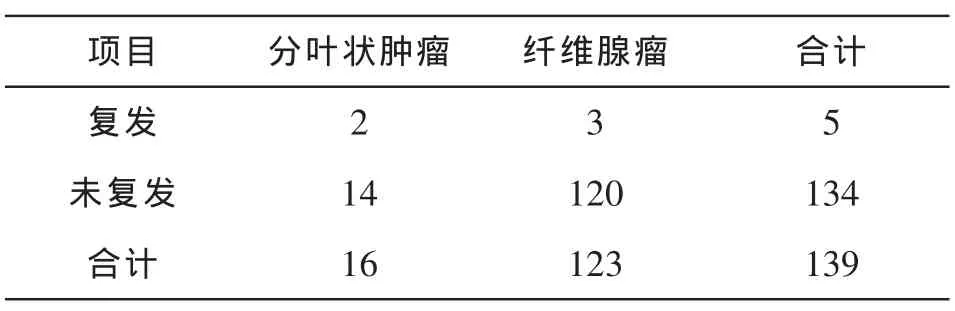
注:p<0.05
3 讨论
乳腺叶状肿瘤(phyllodes tumorsof the breast,PTB)是一种少见的乳腺肿瘤,约占乳腺肿瘤的0.3%~0.9%和乳腺结缔组织与上皮组织混合性肿瘤的2%~3%[1].生物学特性和临床表现多样,组织学分类和治疗方法都存在着不同意见. 2003年WHO乳腺叶状肿瘤分级标准:(1)良性叶状肿瘤:肿瘤膨胀性生长,间质细胞明显增生,排列稀疏,细胞无或轻度异型,核分裂0~4个/10HPF,无出血、坏死;(2)交界性叶状肿瘤:肿瘤膨胀性生长或部分侵润性生长,间质细胞过度生长,细胞中度异型,核分裂5~9个/10HPF,可见小片出血、坏死;(3)恶性叶状肿瘤:肿瘤常为侵润性生长,间质细胞显著过度生长,细胞多型性明显,可伴异源性分化,核分裂≥10个/10HPF,可见大片出血、坏死.恶性乳腺叶状肿瘤是由恶性的间质成分及良性的导管上皮形成的纤维上皮性肿瘤,是一类特殊类型的乳腺肉瘤,约占乳腺肉瘤的70% ~80%.其恶性间质成分的细胞来源不明确,文献Auger[2]认为来自原始间叶细胞,史凤毅等[3]认为,与乳腺癌相比,无论基础和临床研究均不够深入,化疗放疗等一些临床实际问题没有统一的指导方案,手术是治疗本病的最主要手段.
乳腺叶状肿瘤可发生于任何年龄,但主要发生在35~55岁的女性,男性极少发病.通常只累及一侧乳腺,而且左右两侧累及率大致相等,但尚有1%的病例两侧乳房可同时或先后受累.乳腺叶状肿瘤尤其是良性的,表现与纤维瘤类似.肿瘤大者直径可达45cm,但大小与良恶性无关,如肿块过大可表现皮肤紧绷伴有浅表静脉扩张,但皮肤溃疡罕见.本病临床表现主要是无痛性肿块,起病隐匿,进展缓慢,病史较长,可达几年至几十年之久.少数可见短期内迅速增长.纤维腺瘤多见于20岁左右的年龄,年龄较大者(30~40岁)也可发生.一般病史较长(可达数年),肿瘤增长较缓慢.病人除可摸到乳房内有包块外,无其它不适症状.体检:肿瘤质地实韧,有弹性,形状为圆、椭圆或分叶状,边界清楚,光滑,活动度好.用高频探头彩超检查,可见肿瘤形态规整(圆、椭圆或分叶状)、边界清,内部呈均质低回声,可见有侧方声影.瘤内少有血流,或仅可检出少许点状血流.乳腺叶状肿瘤的诊断,临床上误诊、漏诊率都比较高.我们资料中有6例术前诊断纤维腺瘤,术后病理证实为分叶状肿瘤,误诊率37.5%.在各项辅助检查中,钼靶、超声、细针穿刺的诊断率都较低,空芯针穿刺活检诊断率最高.超声检查方便快捷,无创伤,应当作为首选的检查手段.超声检查的特异性征象能对术前诊断提供帮助,对治疗方案的选择具有重要意义.超声图像表现为:分叶状肿块,体积较大,边界多清晰、规则,内部以实性低回声为主,回声不均匀,可有散在无回声区.恶性乳腺叶状肿瘤不遵循乳腺恶性肿瘤后方回声衰减的一般规律,可视为是前者区别于后者的超声征象之一[4].值得一提的是,微钙化作为乳腺癌的常见征象,却鲜见于恶性叶状肿瘤.文献报道利用乳腺钼靶检查可作出明确诊断乳腺叶状肿瘤仅占乳腺全部肿瘤的32%.针吸细胞学检查可以从组织病理学上做出诊断,损伤较小,也是一种重要的检查手段,国外文献[5]报道总的确诊率可达63%.由于叶状肿瘤与纤维腺瘤均属于纤维上皮性病变,笔者认为获得足够和有代表性组织是明确诊断的关键.文献[6]认为出现以下情况时应高度怀疑为乳腺叶状肿瘤:黏着的间质细胞、孤立的间叶细胞样细胞、增生的导管上皮细胞群、异源的巨大细胞、双极裸核及顶泌化生缺失,但最终必须同时出现上皮及间质成分才支持诊断.冰冻病理检查的确诊率较高,达到77.8%,明显高于影像学检查及细胞学检查.空芯针穿刺是目前术前诊断乳腺叶状肿瘤最有价值检查方查方法.有学者报道空芯针活检对诊断叶状肿瘤阳性预测率为83%[7],国内文献的报道也支持这一结果.文献[8]报道,通过免疫组化检测β-catenin和CD117有助于鉴别乳腺叶状肿瘤的良恶性[8].我们对于这两种疾病的术前鉴别诊断建议是超声加空心针活检.
乳腺叶状肿瘤应被看作是良性潜在恶性肿瘤,处理原则不能与纤维腺瘤一样.良性叶状肿瘤常不能与纤维腺瘤区别,而恶性叶状肿瘤治疗不充分会有迅速生长和转移扩散的倾向.乳腺叶状肿瘤首次术式的选择与复发率、病死率密切相关.所以由于处理方法及临床预后的不同,要求在手术前最好能作出明确诊断,以便能进行适当的手术治疗,这样可以有效避免切除不完全或治疗过度.乳腺叶状肿瘤以手术治疗为主.随着对本病的逐渐认识,局部广泛切除为乳腺叶状肿瘤的首选手术方式.鉴于乳腺叶状肿瘤的特性,手术切除的范围应包括距乳腺肿瘤1~2cm以外的正常乳腺组织;如果肿瘤大小与乳房相比不能达到安全切缘或肿瘤直径>10cm时才可考虑单纯乳房切除术[9-11].对于年轻女性,行乳房单纯切除术时,应尽可能保留乳头以便为再造术提供条件.由于乳腺叶状肿瘤主要通过血行转移,腋窝淋巴结转移的概率<5%,故除非手术前、术中发现肿大淋巴结,而且术中活检快速冰冻病理证实有转移,否则无需行腋窝淋巴结清扫.本组腋窝淋巴结转移率12.50%,高于文献报道,可能与样本小有关.文献[12]认为肿瘤复发主要原因为首次手术切除时切缘未达到干净.但对于出现下列情况可考虑扩大手术范围:(1)如肿瘤侵及胸肌筋膜,可同时切除胸肌;(2)如不能除外癌并存时,可同时行腋窝淋巴结清扫;(3)低度恶性者局部切除后,如复发需要扩大切除范围;(4)如为良性病变经局部切除后复发或反复复发者,应按恶性处理.局部复发后再扩大手术范围仍能获得较好效果.一般认为恶性乳腺叶状肿瘤术后放化疗治疗无显著疗效.不主张术后辅助化疗.有学者建议对于反复复发的病例,可考虑术中放疗或术后预防性放射治疗.文献[6-13]等报道恶性叶状肿瘤100%孕激素受体阳性,20%~40%雌激素受体阳性,这说明内分泌治疗对本病可能有效,但目前尚无大样本临床病例报道.
〔1〕李南林,张震,王岭,等.乳腺叶状肿瘤24例病理和临床诊治[J].第四军医大学学报.2003,24(22):2104~2106.
〔2〕Auger M,Hanna W,Kahn HJ.Cystosarcoma phylloides of the breast and its m im ics.An immuohistochem ical and ultrastruc-tural study[J].Arch Pathol Lab Med, 1989,113(11):1231-1235.
〔3〕史凤毅,叶海军,柴薇.乳腺叶状瘤的临床病理学研究[J].中华病理学杂志,2002,31(3):208-212.
〔4〕娄丽,李吉昌,马玉香,等.超声对乳腺叶状囊肉瘤的诊断价值[J].中华超声影像学杂志,2005,14(11):871-872.
〔5〕Jacklin RK,R idgway PF,Ziprin P,et al.Optim ising preoperative diagnosis in phyllodes tumour of the breast [J].JClin Pathol2006,59(5):454-459.
〔6〕Rao CR,Narasimhamurthy NK,Jaganathan K,et al.Cystosarco-ma phyllodes:diagnosis by fine needle aspiration cytology[J].Acta Cytol,1992,36(2):203-207.
〔7〕Komenaka IK,El-Tamer M,Pile-Spellman E,et al. Core nee-dle biopsy as a diagnostic tool to differentiate phyllodes tumor from fibroadenoma[J].Arch Surg, 2003,138(9):987-990.
〔8〕Sawyer EJ,Poulsom JB,Hunt FT,et al.Malignant phyllodes tumours show stromal overexpression of c-myc and c-kit[J].JPathol,2003;200(1):59-64.
〔9〕Zissis C,Apostolikas N,Konstantinidou A,et al.The extent of surgery and prognosis of patients w ith phyllodes tumor of the breast[J].Breast Cancer Res Treat,1998,48:(3)205-210.
〔10〕Abeel A,Barbara L,M ichele A,et al.Surgical management of phyllodes tumors[J].Arch Surg,1999,134(5):487-493.
〔11〕Shih-ping Cheng,Yuan-ching Chang,Tsang-pai Liu, et al.Phyllodes tumor of the breast:The challenge persists[J].World JSurg,2006,30(7):1414-1421.
〔12〕Juan Carlos Roa,Oscar Tapia,Paula Carrasco,et al. Prognstic factors of phyllodes tumor of the breast[J]. Pathol Inter,2006,56(2):309-314.
〔13〕Parfitt JR,Amstrong C,Om alley F,et al.In situ and invasive carcinoma w ith in a phyllodes tumor associate w ith lymph node metastases[J].W orld J Surg Oncol,2004,2(1):46-50.
R737.9
A
1673-260X(2013)01-0147-02

