利用菌体生长限制效应的HBV DNA疫苗发酵工艺※
张明森 丘力功 韦 剑 王灿顶 黄 明
利用菌体生长限制效应的HBV DNA疫苗发酵工艺※
张明森 丘力功 韦 剑 王灿顶 黄 明
目的对HBV DNA疫苗工程菌的发酵工艺进行优化。方法首先通过摇瓶培养确定基础培养基组成,提高单位菌量的质粒表达量。其次,在40 l发酵阶段,通过溶氧反馈调节的补料方式产生生长限制效应,进一步获得高拷贝表达质粒的菌体。结果培养基优化后的工程菌DH5α/pS2S发酵最终可获得质粒304.99mg/l,质粒含量可达到2.40mg/g湿菌,超螺旋质粒DNA的比例达95%以上。结论已建立了在单位体积和单位菌量内高表达质粒HBV DNA疫苗工程菌的发酵工艺,为HBV DNA疫苗的工业规模化生产奠定了基础。
治疗性HBV DNA疫苗;工程菌;发酵;生长限制
治疗性HBV DNA疫苗项目为正在进行临床研究的国家I类新药项目。HBV DNA疫苗含有preS2+S基因的真核表达载体质粒,不仅能诱导体液免疫反应,还能诱导细胞免疫反应,从而打破机体因HBV长期感染所引起的免疫耐受,改善机体内环境,恢复或重建机体的特异性免疫功能,在治疗慢性乙型肝炎方面具有广阔的临床应用前景[1]。原有的发酵工艺[2]虽能产出足够量的质粒用于下游的质粒提取纯化,但由于单位菌量内质量含量不高,增加了下游的纯化负担和成本,有必要为此进行改进以适应临床Ⅲ期和上市后的用量需求。本文利用产生饥饿效应的策略对发酵培养工艺进行了优化,在质粒产量和单位菌量质粒含量等方面取得显著所改进。现将结果报告如下。
1 材料
工程菌DH5 α/pS2S,拜迪公司保存;酵母粉(Yeast Extract)、胰蛋白胨(Tryptone)购自OXOID公司;质粒小量抽提试剂盒,购自QIAGEN公司;紫外可见分光光度计,日本日立公司UV-300型。甘油(Glycerol)、氯化钠(NaCl)、葡萄糖(Glucose)、柠檬酸(Citric acid)、硫酸铵[(NH4)2SO4]、硫酸镁(MgSO4)、磷酸盐(Na2HPO4、KH2PO4)等均为国产分析纯。
2 方法
2.1 培养基的筛选按表1配制培养基,分装至50ml三角锥瓶中(20ml/瓶),灭菌后添加氨苄西林至100μg/ml。其中,配方I、Ⅱ、Ⅲ来源于已有工艺[2]。其后,于LB培养基中加入琼脂(15g/l),铺平皿,接种工程菌,于37℃培养过夜。挑单个菌落,接种于5ml LB(含AMP100μg/ml)中,37℃振荡培养至A600为0.6时,分别取菌液200μl接种到各培养基中按预设的培养参数进行培养。培养结束后分析收菌量(湿菌重)、质粒含量(mg/l),并计算单位湿菌中质粒含量。
2.2 发酵方法
2.2.1 基础培养基为筛选到的优化培养基发酵采用Fed-batch模式,发酵罐50l(德国B.Braun公司产品),发酵培养基按具体实施例配方表1配制,配40l,发酵罐原位灭菌后备用。补料培养基配方为:酵母提取物100g/l,甘油400ml/l。共配10l,灭菌备用。
2.2.2 工艺过程
2.2.2.1 摇瓶培养用冻存菌种接种于摇瓶培养基中,37℃剧烈振荡16hr至对数生长期(A600为0.8)。取400ml菌液接种到发酵罐的发酵培养基中,开始进行批式补料(Fed-batch)模式的发酵培养。
2.2.2.2 Batch阶段接种后首先为Batch阶段。在批式阶段(Batch phase),温度控制在35℃;通过补加10%浓氨水溶液控制PH值在7.0;DO2控制在30%左右,开始阶段搅拌速度设为200r/min,通气量为70 l/min。当DO2水平低于阈值28%时,搅拌速度增加10r/min以促使DO2控制在30%,在批式阶段搅拌速度最高值设为350r/min。在批式阶段后期由于氧供应不足DO2将会下降,最低至2%左右。批式阶段末期营养组分将消耗尽,此时工程菌代谢将趋于停止,DO2值将在短期内跃升,当DO2达到15%时。发酵开始进入补料阶段(Feeding phase)。
2.2.2.3 补料阶段发酵温度升至37℃;DO2值依然控制在30%左右,当DO2值低于30%时搅拌速度以10r/min的增幅增加,直至达到最高转速(700r/min);在补料阶段,当DO2值高于50%、PH值高于7.2时表明生长限制性的碳源缺失,此时按预设的补料速度进行补料(补料值为4ml/min),直到DO2值低于50%或PH值低于7.2时停止补料;在补料阶段,通气量保存不变,当搅拌速度达到最高转数时,DO2因供氧矛盾而趋于下降,当DO2趋于0值时停止发酵。
2.3 分析方法质粒含量和纯度的测定:采用核酸测定含量,并进行1%琼脂糖凝胶电泳,上样量为1μg。经凝胶成像系统扫描,分析超螺旋(SC)质粒的比例[3]。
3 结果
3.1 培养基的筛选培养基摇瓶筛选实验表明,配方IV配制的培养基培养表达的质粒DNA单位含量明显高于其它配方的结果(见表2)。确定配方IV为发酵基础培养基。
3.2 发酵结果按2.2的方法进行连续三批(Lot 1001、Lot 1002与Lot 1003)的发酵。发酵收获液的检测结果表明,与原有工艺的发酵批次相比,改进工艺的发酵批在单位发酵体积质粒含量方面提高了1倍,在单位菌量的质粒含量提高了70%以上(见表3)。
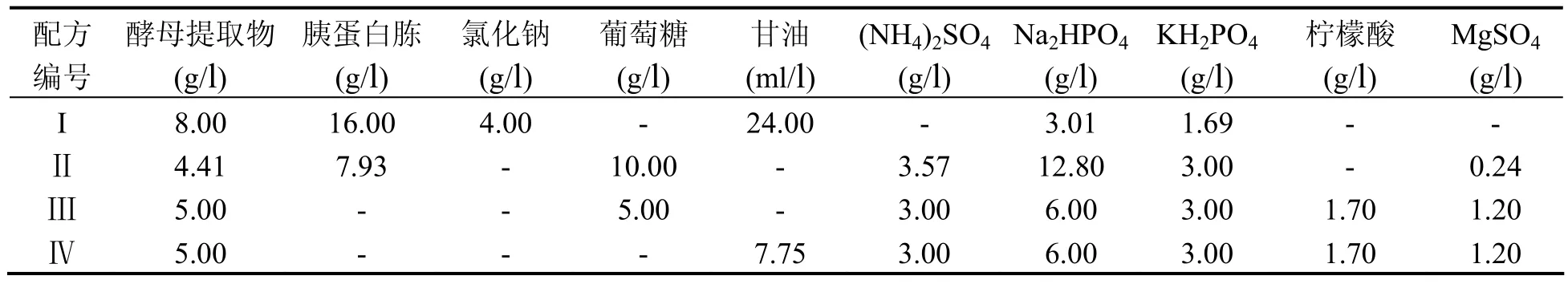
表1 待筛选的培养基配方
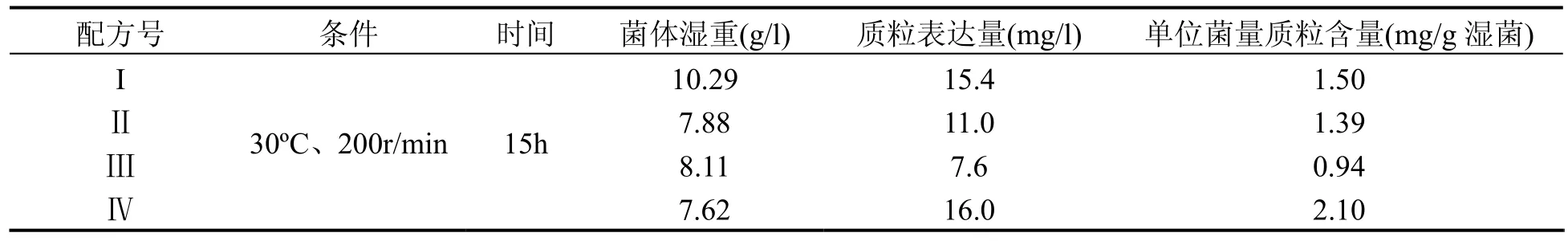
表2 DH5α/pS2S工程菌在不同配方培养基的摇瓶发酵结果
表3 不同发酵工艺条件下DH5α/pS2S工程菌发酵结果比较(±s)

表3 不同发酵工艺条件下DH5α/pS2S工程菌发酵结果比较(±s)
注:*与原有工艺相比,差异十分显著(P<0.01)
工艺来源 发酵批次 发酵结束时A600单位体积收菌量(g/l)单位体积质粒含量(mg/l)单位菌量质粒含量(mg/g,bacteria)原有工艺 3 45.20±5.30 60.50±2.36 82.67±13.24 1.37±0.24改进工艺 3 60.00±6.20 127.08±3.08*304.99±31.06*2.40±0.31*
而根据Lot 1001批的在线检测结果绘制的图谱可以看出:单位发酵体积的质粒含量随着发酵时间而逐渐增加,在发酵结束时达到最大值;单位菌量的质粒含量在批式培养阶段总体亦呈增加趋势,但在后期由于营养物耗竭而有所下降。而在进入溶氧反馈调节为特征的限制性补料阶段后(约在发酵第12小时开始),单位菌量的质粒含量在短时间内有了显著增长。此后增长趋势一直维持至发酵结束(见图1)。
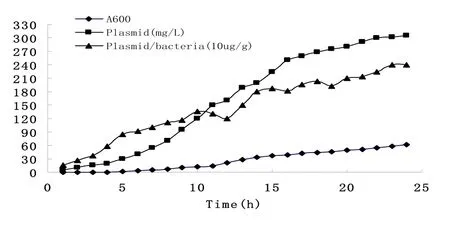
图1 DH5α/pS2S工程菌发酵过程中菌体生长的质粒表达量图谱
琼脂糖凝胶电泳表明,三批发酵批收获液中质粒超螺旋比例检测结果均在95%以上,达到了HBV DNA发酵相关质量标准(见图2)。
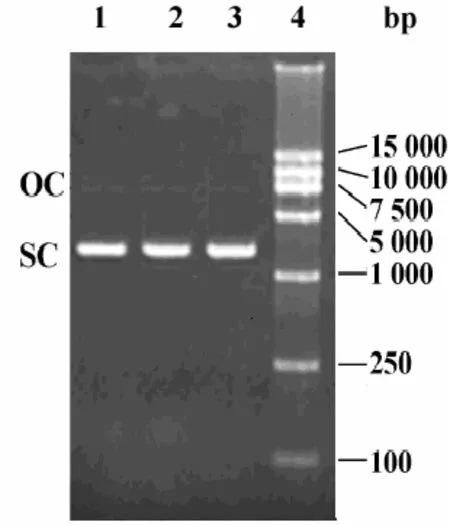
图2 三批改进工艺生产的DH5α/pS2S工程菌发酵纯化质粒琼脂糖凝脉电泳图谱
4 讨论
携带有外源基因的质粒DNA为基因治疗和DNA疫苗研究开发中使用的主要药物载体。目前,治疗性的质粒DNA临床用量已达到了mg级,因此大量制备的质粒DNA需要工业规模的大肠杆菌工程菌发酵技术来制备。在发酵策略方面,为了提高细菌发酵密度,与重组蛋白工程菌发酵工艺相似,现有的质粒DNA发酵工艺普遍采用补料-分批发酵(Fed-batch)的方法进行,即在发酵过程中基础培养基碳源、氮源等营养成分衰竭时,通过恒速或指数型流加补料的方式提高菌体生长密度和目标产物的表达总量[5-7]。
到目前为止,现有文献公开的质粒DNA工程菌发酵工艺目标主要以提高质粒总产量为目标。而良好的质粒DNA发酵工艺除了能生产较高的质粒DNA总量外,还能提高单位菌量内的质粒DNA含量以适应下游纯化工艺的需求。
在本研究中发现,在非工程菌最佳生长的限制性条件下(如限制供应碳源、氮源或溶氧量、较低的生长温度等),菌体趋向于将营养底物转化成质粒,从而提高单位菌量的质粒拷贝数,此即为菌体的生长限制效应。本文中的发酵工艺改进思路为:首先通过配方筛选得出能提高单位菌量质粒含量的基础培养基。在此基础上,在分批发酵阶段采用较低的生长温度以进一步提高菌体的质粒拷贝数水平。在随后的补料阶段,则采用溶氧反馈调节的限制性补料方式以获得高拷贝质粒的菌体。在线检测和最终发酵收获液检测结果证明了改进后的发酵工艺不仅增高了质粒总产量,还显著提高了单位菌量的质粒含量。以上改进为治疗性双质粒HBV DNA疫苗的规模化生产奠定了坚实的基础。
[1]Yang S., Lee C., Park S., et al.Correlation of antiviral T cell response with suppression of viral rebound in chronic hepatitis B carries:a proof-of-concept study[J].Gene Therapy, 2007,13(14):1110-1117.
[2]饶桂荣,黄英,王鹏.治疗性双质粒HBV DNA疫苗工程菌的中试发酵工艺研究[J].中国生物制品学杂志,2007,20(2):110-113.
[3]Sambrook J., Fritsch E., Maniais T.Molecular cloning:a laboratory manual.2nd edition[M].New York:Cold Spring Harbor Laboratory Press, 1989:880-885.
[4]Michael K., Gareth M.Growth Medium Selection and Its Economic Impact on Plasmid DNA Production [J].Journal of Bioscience And Bioengineering,2007,104(6):490-497.
[5]Kevin O.,Ruth F., Frank H., et al.Strategies for high titre plasmid DNA production in Escherichia coli DH5α[J].Process Biochemistry, 2007,42:1039-1049.
[6]Heather A., Chen N.Enhanced High Copy Number Plasmid Maintenance and Heterologous Protein Production in an Escherichia coli Bio film [J].Biotechnology and Bioengineering, 2007,97(3):439-446.
[7]Filomena S.Plasmid fermentation strategies:influence on plasmid stability and cell physiology[J].Appl Microbiol Biotechnol, 2012,93:2571-2580.
Optimization of HBV DNA Plasmid Fermentation Process by the Strategy of Bacterial Growth Limitation
Zhang Mingsen Qiu Ligong Wei Jian Wang Canding Huang Ming
ObjectiveTo optimization of HBV DNA plasmid fermentation process.MethodsThe composition of batch medium was determined to increase plasmid copy number per bacteria by shaking flask test.In the fed-batch phase of 40l fermentation,the plasmid copy number was further increased by growth limitation strategy which is characterized by DO2feedback feeding control.ResultsBy using the optimized fermentation process,plasmid content from the fermentation harvest reached 304.99mg/l or 2.40mg/g bacteria,and the proportion of supercoiled plasmid DNA was higher than 95%.ConclusionThe fermentation process was developed,with high copy number of plasmid both per liter and per bacteria.It laid a foundation of industrial scale production of the therapeutic HBV DNA vaccine.
Therapeutic HBV DNA vaccine; Recombinant engineered bacteria; Fermentation; Growth limitation
R392
A
1673-5846(2013)08-0027-03
广州白云山拜迪生物医药有限公司,广东广州 511495
广东省2012年重大科技专项(重要新药创制)计划项目(2012A080204009)
张明森,制药工程师,电话:13802930361;E-Mail:13380009138@139.com。
丘力功,电话:13660769433;E-Mail:007qiu@21cn.com。

