颈动脉粥样硬化斑块性质、血清hs-CRP水平在脑梗死发病预测及病情判定中的应用
张东平,李淮玉
(安徽医科大学附属省立医院,合肥230001)
脑梗死是老年人常见的致残和死亡原因,颅外 颈动脉粥样硬化被认为是缺血性脑梗死的重要病因和危险因素,发生于颈动脉斑块粥样硬化破裂之后的动脉—动脉途径的血栓栓塞是缺血性脑血管病发生、发展的重要机制[1]。研究[2]显示,炎症反应在动脉粥样硬化的发生、发展和粥样斑块的不稳定化过程中起关键作用。目前,已经公认CRP是一种非特异的炎性反应标志物[3],而高分辨率彩超检查可特征性识别颈动脉不稳定斑块。2012年5~11月,我们对83例脑梗死患者进行了颈动脉彩超及血清超敏—C反应蛋白(hs-CRP)水平检查,旨在探讨两者在动脉粥样硬化性脑梗死诊治中的临床价值。
1 资料与方法
1.1 临床资料 同期收治的83例脑梗死患者(梗死组),男47例,女36例;年龄48~82岁,平均58岁。入院时病程≤3 d,均符合全国第四次脑血管病学术会议修订的脑梗死诊断标准,合并经头部CT和(或)MRI证实为前循环脑梗死;按照美国国立卫生研究院卒中量表(NIHSS)评分,轻度神经功能障碍23例,中度神经功能障碍42例,重度神经功能障碍18例。排除标准:并感染、肿瘤、免疫性疾病、风湿性心脏病及严重肝、肾疾患;发病前1周内使用抗血小板活性药物及抗炎药物。对照组为同期我院健康体检者50例,男28例、女22例,年龄50~75岁(平均51岁),无高血压、高血脂、糖尿病,无心脑血管病和肝肾疾病、肿瘤等。两组年龄和性别均无统计学差异(P >0.05)。
1.2 血清 hs-CRP水平检测 梗死组于发病24 h内、对照组于体检当日清晨(空腹),使用含促凝剂的真空采血管采静脉血5 mL,采用日本日立7600全自动生化仪以免疫比浊法检测血清hs-CRP水平。试剂盒购自上海裕平生物科技有限公司,正常参考值:0~3 mg/L,操作过程严格按仪器及试剂说明书进行。
1.3 颈动脉粥样硬化斑块检测 应用美国GE公司生产的Vivid 7型多功能型彩色多普勒超声诊断仪,探头频率7.5~10 MHz。患者取仰卧位,充分暴露颈部,颈部垫一软枕,头部向检查对侧偏斜。将探头置颈部,在颈动脉起始处进行纵向、横向探查,依次检查双侧颈总动脉、颈内动脉颅外段等部位。观察斑块有无、大小、表面及内部回声特征;在距颈总动脉分叉部近端1.5 cm处测量内—中膜厚度(IMT),≤1.0 mm 为正常、1.0 ~1.2 mm 为增厚(可判定为早期动脉粥样硬化)。颈动脉粥样硬化斑块阳性判断标准[4]:局部IMT≥1.2 mm,或比邻近部位厚0.5 mm,或≥邻近部位IMT值的1.5倍;或彩色图像显示血管腔某处彩色血流缺损,缺损处面积≥10 mm2。其中扁平斑(内膜面局部隆起或弥漫增厚,呈均匀的中等或低回声,内膜线光滑)、硬斑(内膜面呈局限性强光斑)为稳定斑块;软斑(斑块形态不规则,呈不均匀的低或中等回声,部分长轴面呈“沙丘状”)、混合斑(呈多个低回声及强回声混杂)、溃疡斑(斑块较大,基底宽,顶部出现凹陷,边缘回声较低)为不稳定斑块。
1.4 统计学方法 采用SPSS18.0软件进行统计学处理。计量资料以¯x±s表示,两组均数比较采用t检验,多组均数比较采用方差分析;计数资料比较用χ2检验,两变量间关系采用Spearman相关分析法。P≤0.05为差异有统计学意义。
2 结果
2.1 斑块阳性率、IMT及血清hs-CRP水平 梗死组和对照组 IMT 分别为(1.16±0.23)、(0.67±0.07)mm,斑块阳性率分别为 73.5%(61/83)、16.0%(8/50),血清 hs-CRP 分别为(5.87 ±2.04)、(2.62 ±0.97)mg/L,两两比较均有显著差异(t=5.74、χ2=4.13、t=6.83),P 均 < 0.05。梗死组中13例稳定斑块和48例不稳定斑块者IMT分别为(0.92 ±0.13)、(1.17 ±0.28)mm,血清 hs-CRP 分别为(4.36 ±1.72)、(7.91 ±2.84)mg/L,两两比较均有显著差异(t=4.78、7.25),P 均 <0.05。梗死组不同神经功能障碍程度者IMT及血清hs-CRP水平比较见表1。
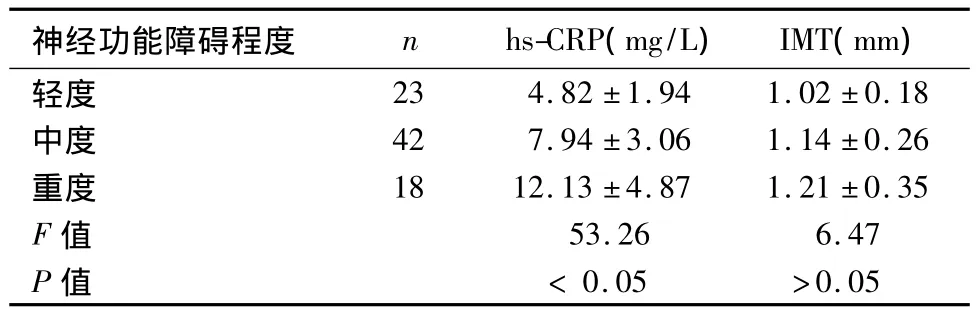
表1 不同程度神经功能障碍的脑梗死患者颈动脉IMT及血清hs-CRP水平比较(¯x±s)
2.2 血清hs-CRP水平与IMT及神经功能障碍程度的关系 血清hs-CRP水平与IMT及神经功能障碍程度均呈正相关,r值分别为0.67、0.58(P均 <0.05)。
2.3 斑块性质与同侧脑梗死发生率的关系 稳定斑块和不稳定斑块者同侧脑梗死发生率分别为38.5%(5/13)、81.2%(39/48),P <0.05(χ2=8.95)。
3 讨论
脑梗死是指因脑部血液循环障碍、缺血、缺氧所致局限性脑组织的缺血性坏死或软化,最常见的病因是动脉粥样硬化[4,5],早期病理改变主要累及动脉内膜,表现为IMT增厚、内膜变粗糙,其后逐渐形成斑块并突入管腔内造成管腔狭窄。稳定斑块纤维帽较厚,炎症细胞少,不易破裂;不稳定斑块的纤维帽薄、脂质核心较大,有大量的炎细胞浸润和新生微血管形成,其成分易于脱落成栓子导致栓塞。Fisher等[6]研究证实,颈动脉斑块导致管腔狭窄、血流动力学改变及斑块溃破、脱落形成栓子是引起脑梗死的主要机制。本研究显示,梗死组斑块阳性率明显大于对照组,且不稳定斑块与同侧脑梗死发生率显著相关,提示脑梗死与颈动脉粥样硬化斑块特别是不稳定斑块形成有密切关系。
越来越多的研究表明,炎症反应在动脉粥样硬化的发生、发展过程中扮演了重要角色,而炎症反应标志物中以血清CRP最为人们所关注。有资料显示,血清CRP水平升高可作用于动脉内膜,使血管通透性增加、内皮细胞产生纤溶酶原抑制剂,损伤血管内皮,最终形成血栓[7]。Koenig 等[8]研究发现,血清CRP水平升高不仅与炎症活动相关,而且与动脉硬化斑块的稳定状态相关,可反映斑块的稳定状态并预测斑块预后。本研究亦表明,梗死组血清hs-CRP水平明显高于对照组,其中不稳定斑块者明显高于稳定斑块者,且血清hs-CRP与IMT呈正相关。提示炎症反应与颈动脉动脉粥样硬化发生、发展密切相关。本研究还显示,神经功能障碍程度不同者血清hs-CRP水平亦有显著差异。提示血清hs-CRP水平升高不仅反映体内炎症反应的程度,也能反映脑梗死的严重程度。故有不少学者认为,血清hs-CRP水平可以作为判断心脑血管疾病风险及预后的高敏感性、非特异性指标[9,10]。
近年来重大研究成果显示,缺血性脑血管病最常见的病因不在颅内而在颅外段颈动脉。颈动脉IMT增厚被认为是早期动脉粥样硬化标志[11],可间接反映动脉粥样硬化情况和预测卒中风险。von Sarnowski等[12]对1 922位患者的颈动脉超声检查结果进行的为期5 a追踪研究发现,IMT可独立预测颈动脉斑块的形成,且是颈动脉不稳定斑块形成的独立危险因素。因此,超声所示颈动脉IMT增厚是一种反映早期动脉粥样硬化的无创性指标。本研究结果显示,梗死组IMT明显高于对照组,且不稳定斑块者IMT明显大于稳定斑块者。与Hollander等[13]研究结果相符。表明IMT与动脉粥样硬化及卒中风险密切相关。但本研究同时发现不同程度神经功能障碍患者IMT并无明显差异,可能是因为IMT只是判断早期动脉粥样硬化的敏感指标,可以用来评估卒中风险,并不能反映脑梗死的严重程度。
综上所述,早期检测和评估颈动脉粥样硬化病变及其斑块性质,及早发现易损斑块对预防缺血性脑血管病的发生有重要意义。颈动脉彩超因为其无创、经济、简便易行、可重复、准确性高等优点,已成为血管检查和诊断的首选方法,其不仅可测量IMT及对斑块作定性和定量分析,还可显示血管病变处的解剖形态和血流状态,对缺血性卒中的诊断意义显著[14]。但颈动脉彩超检查受人为因素影响较大,操作手法、探头角度、个人的诊断经验和水平等均可影响检查结果,如能在此基础上结合血清hs-CRP水平检测,有利于更准确地评估血管情况及卒中风险,为指导临床诊治提供依据。
[1]Chalela JA.Evaluating the carotid plaque:going beyond stenosis[J].Cerebrovasc Dis,2009,27(Suppll 1):19-24.
[2]黄惠敏,王涛.炎症、动脉粥样硬化与缺血性卒中[J].国际脑血管病杂志,2007,15(6):464.
[3]Liu RW.Modern laboratory diagnosis and clinical testing[M].2nd ed.Beijing:Chemical Industry Press,2009:159-160.
[4]Sztajzel R.Ultrasonographic assessment of the morphological characteristics of the carotid plaque[J].Swiss Med Wkly,2005,135(43-44):635-643.
[5]吴江,贾建平,崔丽英,等.神经病学[M].2版.北京:人民卫生出版社,2010:158.
[6]Fisher M,Paganini-Hill A,Martin A,et al.Carotid plaque pathology:thrombosis,ulceration,and stroke pathogenesis[J].Stroke,2005,36(2):253-257.
[7]Noor JI,Ueda Y,Ikda T,et al.Edaravone inhibits lipid peroxidafion in Neonatal hypoxic-ischemic rats:an invivo microdialysis study[J].Neumsci Lett,2007,414(1):5-9.
[8]Koenig W,Lowel H,Baumert J,et al.C-reactive protein modulates risk prediction based on the results from a large cohort study in Southern Germany[J].Circulation,2004,109(11):1349-1353.
[9]Di Napoli M,Elkind MS,Godoy DA,et al.Role of C-reaction protein in cerebro-vascular disease:a critical review[J].Expert Rev Cardiovasc Ther,2011,9(12):1565-1584.
[10]Rajeshwar K,Kaul S,Al-Hazzani A,et al.C-reactive protein and nitric oxide levels in ischemic stroke and its subtypes:correlation with clinical outcome[J].Inflammation,2012,35(3):978-984.
[11]Finn AV,Kolodgie FD,Virmani R.Correlation between carotid intimal/medial thickness and atherosclerosis:a point of view from pathology[J].Arterioscler Thrombo Vasc Biol,2010,30(2):177-181.
[12]von Sarnowski B,Ludemann J,Volzke H,et al.Common carotid intima-media thickness and framingham risk score predict incident carotid atherosclerotic plaque formation:longitudinal results from the study of health in Pomerania[J].Stroke,2010,41(10):2375-2377.
[13]Hollander M,Hak AE,Koudstaal PJ,et al.Comparison between measures of atherosclerosis and risk of stroke,the Rotterdam Study[J].Stroke,2003,34(10):2367-2373.
[14]玛依努尔·买买提,牛晓珊,党辉,等.踝臂指数、颈部血管彩超、经颅多普勒超声与缺血性脑卒中的相关性研究[J].中风与神经疾病杂志,2012,29(5):450-453.

