MUM1、UBE1在弥漫性大B细胞淋巴瘤中的表达及意义
陈 冰 苏祖兰 朱晓群 陶香香 何 雷 王素芬
(1皖南医学院病理教研室;2皖南医学院弋矶山医院病理科,安徽 芜湖241001;3中山大学附属第三医院病理科,广州 510630)
弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)占非霍奇金淋巴瘤(non-Hodgkin's lymphomas,NHL)的30%-40%,是 NHL中最常见的一个亚型[1]。作为高异质性疾病,其病情进展快,预后差,但化疗后约50%的患者可完全缓解,由于目前尚缺乏统一的组织学标准,对其预后判断较困难,寻找简单易行、经济可靠的方法进行预后判断成为当前研究的热点。虽然DNA微阵列技术将其分为两种类型[2],但该技术由于成本高、对样本要求新鲜等原因难以在临床上推广,而免疫组化技术由于操作简单、条件易控制、成本低已成为临床必不可少的手段。选择合适的指标组建合理的方案进行免疫组化检测具有更实际的临床意义。
MUM 1(multiple myeloma oncogene 1)是一种与骨髓瘤相关的癌基因,MUM1的癌基因功能最初于多发性骨髓瘤中被识别,主要表达于B细胞发育的后期和浆细胞[3]。泛素蛋白酶体通路参与了多种细胞过 程,泛 素 激 活 酶 (Ubiquitin-activating enzyme,UBE1)是泛素与底物蛋白结合所需的第一个酶。前期研究证实UBE1的表达在DLBCL的发生发展中起着一定的作用[4]。鉴于二者可能与DLBCL的侵袭及预后有关,我们收集80例弥漫性大B细胞淋巴瘤,非特殊型(DLBCL,NOS)标本应用免疫组织化学方法检测其中MUM1、UBE1蛋白的表达,以进一步探讨MUM1及其与UBE1过表达在DLBCL预后判断中的应用价值。
材料和方法
1.材料
收集皖南医学院附属弋矶山医院2007年10月-2010年12月外检标本中诊断明确的DLBCL,NOS 80例,其中男性49例,女性31例;年龄25-82岁,中位年龄60岁。所有标本均经10%中性福尔马林固定,石蜡包埋,常规HE染色,所有标本的切片均经2位以上病理专家重新阅读。UBE1(编号AC0419)为浓缩型抗体,稀释倍数为1∶200,购自ABGENT公司。MUM1(克隆号 MUM1P)抗体类型为即用型、DAB显色剂及EnVision二步法试剂盒均购自福建迈新生物技术公司。
2.方法
2.1 免疫组织化学EnVision二步法检测
主要步骤:4μm的石蜡切片常规脱蜡至水,高压热修复抗原处理后,冷却至室温,3%H2O2处理10min。PBS冲洗5min×3,滴加一抗放入4℃冰箱孵育过夜。PBS冲洗5min×3,滴加聚合物增强剂,37℃孵育箱孵育20min,PBS冲洗3min×3,滴加酶标抗鼠/兔聚合物,37℃孵育箱孵育30min,PBS冲洗5min×4。DAB镜检显色3-5min,自来水冲洗终止显色,苏木精复染,脱水透明,中性树胶封片。PBS代替一抗作阴性对照,用已知的阳性片作为阳性对照。抗体阳性判断标准为:细胞核染成棕黄色,以>20%的肿瘤细胞染色判为阳性。
2.2 临床相关评分标准
体力状况评分参照 Zubrod-ECOG-WHO(ZPS,5分法)标准分为0-5分;根据国际预后指数IPI分为低危(无或1个预后差因素)记为0-1分、低中危(2个预后差因素)记为2分、中高危(3个预后差因素)记为3分和高危(4个及4个以上预后差因素)记为4-5分。乳酸脱氢酶(LDH)测定采用自动生化分析仪进行(速率法),高于250U/L判为升高。结外侵犯部位若为两处及两处以上则为>1,否则为≤1。
3.统计学方法
百分数的比较用χ2检验和Fisher精确检验;Logistic回归研究相关性;Kaplan-Meier生存分析方法比较患者生存率,P<0.05有统计学意义。
结 果
1.MUM1和UBE1在DLBCL患者中的表达及与临床资料的相关性
80例DLBCL患者中MUM1表达的阳性率为62.5%(50/80),MUM1表达于细胞核,弥漫性分布,且着色深(图1);UBE1表达的阳性率为65.0%(52/80),UBE1主要表达于细胞核,少数表达于细胞浆,表达的阳性细胞多为弥漫分布且核膜着色非常清晰,而且胞浆中也有较强的表达(图2)。50例MUM1阳性标本中32例同时表达UBE1,占其总数的64%(32/50)。将患者按年龄、体力状况评分、Ann Arbor分期、LDH水平高低、结外侵犯部位数目及国际预后指数的危险度分组,结果显示MUM1及其与UBE1同时表达与患者的年龄、Ann Arbor分期、结外侵犯部位数目、LDH高低以及国际预后指数的危险度相关(P<0.05),而与性别、体力状况评分无关 (表1)。
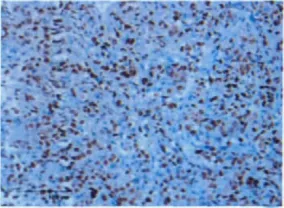
图1 MUM1蛋白在DLBCL中阳性表达EnVision法×400Fig.1 Positive expression of MUM1protein in DLBCL EnVision TM ×400

图2 UBE1蛋白在DLBCL中阳性表达EnVision法×400Fig.2 Positive expression of UBE1protein in DLBCL EnVision TM ×400

表1 MUM1表达和UBE1同时表达与DLBCL临床资料的相关性Table1 MUM1and UBE1expression and clinical significance of DLBCL associated
2.MUM1和UBE1蛋白表达与预后的关系
80例患者中58例可进行预后分析,随访时间为2-36个月,中位随访时间28个月。58例中,死亡9例,其余49例仍在随访中。Kaplan—Meier生存分析显示,MUM1表达的无病生存率显著低于未表达的患者(分别为45.3%、73.7%),二者有显著性差别(P<0.05),但总体生存率(分别为70.6%、95.5%)二 者 差 异 无 统 计 学 意 义 (P>0.05)。MUM1与UBE1同时表达时患者的无病生存率和总体生存率(58.0%和67.7%)显著低于其中MUM1未表达而UBE1表达的患者(无病生存率和总体生存率分别为86.9%和98.8%)(P<0.05)。
讨 论
DLBCL是成人淋巴瘤中最常见的一种类型。因其具有高度异质性且没有明确的组织学标准进行细分,患者的预后难以预测。Hans等[2]应用DNA微阵列技术根据CD10、Bcl-6及 MUM1将DLBCL分为 (germinal center B-cell-like,GCB)型 和 non-GCB型,GCB型的预后明显好于non-GCB型,但因价格昂贵在临床难以推广。寻找简单、经济的预测方法成为必然。随着抗原技术的进步、抗体的广泛应用、自动免疫组化仪的普及,免疫组化技术成为检测肿瘤细胞起源最价廉物美的方法。目前DLBCL中,运用较多的是CD10、Bcl-6及 MUM1的联合检测。但此方案中Bcl-6染色不稳定,造成检测结果解释困难,因此寻找更合适的免疫组化方案预测DLBCL患者的预后成为众多学者近年来研究的热点[5]。本实验在前期研究的基础上,选择检测MUM1和UBE1在DLBCL中的表达,以寻找更确切、更经济的免疫组化方案来预测患者的预后。
转录因子 MUM1,又称为LSIRF(lymphoid specific IRF),是一种与骨髓瘤相关的癌基因,是干扰素调节因子家族的新成员,在细胞的增殖、分化和生存方面中起重要作用。其异常表达是由于t(6;14)(p25;q32)染色体易位,易位的结果导致 MUM1蛋白过表达,从而促进肿瘤的形成[6]。因 MUM1单独作为预后因素尚有争议[7],由此我们设想MUM1是否能和前期研究的其它指标结合起来组建新的免疫组化方案用于DLBCL患者预后的预测。
泛素激活酶UBE1其编码基因定位于人类染色体Xp11.23,是泛素与底物蛋白结合所需的激活酶。泛素蛋白酶体降解障碍将导致肿瘤的癌基因的增加和抑癌基因的减少,现已发现很多癌基因和抑癌基因蛋白酶体降解的靶点[8]。研究表明UBE1参与某些半衰期较短的mRNA如一些肿瘤抑制基因、细胞因子等的mRNA的选择性灭活,通过这种选择性灭活,UBE1调节真核细胞的基因表达以维持各种复杂生理功能之间的协调与平衡[9]。本课题组在前期,应用自行设计的cDNA芯片在mRNA水平筛选出NHL中10个差异表达基因,其中UBE1表现显著上调。并在此基础上采用免疫组化法检测了49例DLBCL患者UBE1的表达,总阳性表达率为65.3%,检测到 UBE1在DLBCL和RH中表达的阳性率具有显著性差异(P<0.05),可能在DLBCL发生发展中起着一定的作用[4]。值得注意的是,其中UBE1的表达阳性率较高,且染色较深,易于辩认,因此设想其是否可作为DLBCL预后判断免疫组化方案中的新成员,同时查阅文献,联合检测MUM1和UBE1的表达亦未见相关报道。
通过对80例DLBCL,NOS标本采用免疫组化(EnVision二步法)技术进行了MUM1和UBE1的检测,结果表明UBE1表达的阳性率较高(65.0%),与前期研究一致[4],UBE1表达阳性细胞多为弥漫分布且核膜着色非常清晰,呈棕色的阳性反应,显微镜下易于辩认;MUM1表达的阳性率也较高,为62.5%,和国内外报道的DLBCL患者中有50%-77%MUM1表达的结果相一致[10],MUM1主要在核表达,着色也较深,经复染后,棕蓝色对比显著,且无明显的背景着色,这一结果显示,其与UBE1的表达在镜检时都易判断结果。
实验将MUM1、UBE1均阳性表达患者的临床资料进行比较,发现与性别、体力状况评分无关,主要表达于年龄≥60岁、LDH升高、Ann Arbor分期Ⅲ/Ⅳ、结外侵犯部位>1处、以及国际预后指数中的中高危和高危的患者,应用Kaplan—Meier生存分析,发现MUM1在DLBCL中高表达提示预后不良,特别是在同时出现UBE1高表达时更显著,提示MUM1表达和UBE1同时表达可能在预后方面有重要价值,为组建易判断、稳定的免疫组化方案提供了重要参考。
MUM1的高表达可能与其在肿瘤细胞中的激活能够抑制细胞凋亡,促进细胞增殖有关。近来研究发现MUM1和c-myc关系密切。MUM1激活c-myc,c-myc又反激活MUM1,随后激活MUM1依赖性的肿瘤驱动基因网络[11]。正常细胞中c-myc原癌基因一旦被异常激活为癌基因,c-myc mRNA和c-Myc蛋白表达异常增高,活化转录,使细胞脱离正常生长调节的限制而处于高度增生状态,将开始向恶性表型转化;同时c-myc的高水平表达还抑制细胞的分化,其诱导细胞凋亡的作用也遭到破坏而参与到肿瘤形成机制中;c-myc表达失控还是许多癌症发生和肿瘤治疗效果不明显的主要原因之一[12]。因此,MUM1可能是通过与c-myc的相互作用参与到肿瘤细胞的增殖中,进而造成患者的预后及疗效差。
MUM1与UBE1同时高表达,我们推测可能是因为在肿瘤的后期,MUM1促进癌细胞增殖,且癌基因大量出现要求泛素蛋白酶体降解功能亢进,但此时癌基因生成的速度远超过泛素蛋白酶体的降解速度,以至于表达失控,成为DLBCL后期治疗效果及预后更差的主要原因,具体机理还有待进一步研究。
综上所述,DLBCL中MUM1和UBE1表达的阳性率均较高,阳性定位佳,弥漫分布,无明显背景着色,具有表达特异性强、易诊断等优点,选择检测MUM1和UBE1蛋白表达水平的高低可能有助于更精确判断DLBCL的预后,对临床制定更合理的治疗方案,具有重要的意义。
[1]Møller MB,Pedersen NT,Christensen BE,et al.Diffuse large B-cell lymphoma:clinical implications of extranodal versus nodal presentationa population-based study of 1575cases.Br J Haematol,2004,124(2):151-159
[2]Hans CP,Weisenburger DD,Greiner TC,et al.Confirmation of the molecular classification of difuse large B-cell lymphoma by immunohistochemistry using a tissue mieroarray.Blood,2004,103:275-282
[3]Natkunam Y,Warnke RA,Montgomery K,et al.Analysis of MUMl/IRF4protein expression using tissue microarrays and inmmnohistochemistry.Mod Pathol,2001,14(7):686
[4]陈冰,苏祖兰,莫祥兰等.UBE1蛋白在DLBCL及良性淋巴组织中的表达差异及临床意义;第十次全国淋巴瘤学术会议论文汇编2007年
[5]Meyer PN,Fu K,Greiner TC,et al.Immunohistochemical methods for predicting cell of origin and survival in patients with diffuse large B-celllymphoma treated with rituximab.J Clin Oncol,2011,29(2):200-207
[6]Natkunam Y,Warnke RA,Montgomery K,et al.Analysis of MUM1/IRF4protein expression using tissue mi-eroarrays and imunohistochemistry.Mod Pathol,2001,14(7):686-694
[7]Colomo L,López-Guillermo A,Perales M,et al.MClinical impact of the differentiation profile assessed by immunophenotyping in patients with diffuse large B-cell lymphoma.Blood,2003,101(1):78-84
[8]Hoeller D,Hecker C,Dikic I.Ubiquitin and ubiquitinlike proteins in cancer pathogenesis.Nat Rev Cancer,2006,6(10):776-788
[9]Mani A,Gelmann EP.The ubiquitin-proteasome pathway and its role in cancer.J Clin Oncol,2005,23(21):4776-4789
[10]Salaverria I,Philipp C,Oschlies I,et al.Translocations activating IRF4identify a subtype of germinal centerderived B-cell lymphoma affecting predominantly children and young adults.Blood,2011,118(1):139-147
[11]Nie Z,Hu G,Wei G,et a1.c-Myc Is a Universal Amplifier of Expressed Genes in Lymphocytes and Embryonic Stem Cells.Cell,2012,151(1):68-79
[12]Miller DM,Thomas SD,Islam A,et a1.c-Myc and Cancer Metabolism.Clin Cancer Res,2012,18(20):5546-5553

