草果精油成分鉴定及其抗菌活性研究
孟大威, 李 伟, 王鹏君, 重松正己, 任慧峰, 陆占国,*
(1.哈尔滨商业大学食品工程学院/黑龙江省高校食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.燕山大学环境与化学工程学院,河北秦皇岛 066004;3.日本萜化学(株),日本神户 658-0031;4.东京海洋大学海洋环境学科,日本东京 108-8477)
草果(Amomum tsao-ko Crevost et Lemaire)为姜科豆蔻属多年生草本植物,英文名Tsao-ko amomum[1]或者 Amomum tsao-ko[2],简称 tsao-ko,可作为中药材和调味料,主要分布在我国广西,云南,贵州和福建[3-4].
关于草果精油的萃取以及成分的研究如采用水蒸汽蒸馏法[5-6],溶剂萃取法[5],微波[5-6]、超声波辅助-溶剂萃取法[6-7]所获得的精油成分进行比较.采用水蒸汽蒸馏萃取法萃取产地不同草果,比较精油成分的差异[8-11].还有采用超临界CO2法进行萃取的报道[12-13].
关于草果精油功能性研究报道如仇厚援等[14]用超声波辅助-有机溶剂萃取云南文山县产草果,比较各萃取物对金黄葡萄球菌和黑曲霉的抑菌效果,发现乙酸乙酯相对金黄葡萄球菌抑菌能力最强.谢小梅等[15]报道了水蒸汽蒸馏法萃取草果获得的精油对桔青霉,黑曲霉,产黄青霉,黑根霉,黄绿青霉,黄曲霉的抗菌活性,发现草果具有很好的抑菌活性.
国外关于草果研究的报道仅有Nguyen等[16]采用水蒸汽蒸馏法萃取越南产草果,以1.4%产率获得精油,鉴定出21个成分,主要成分1,8-桉树脑占30.06%;Yang等[17]采用水蒸气蒸馏法萃取桂林产草果,以16.9 mL/kg的产率得到精油,解析出占总精油含量97.65%的73个化学成分,主要成分1,8-桉树脑占45.24%,并测定了精油的抗菌活性.Starkenmann等[18]用乙酸乙酯萃取昆明购买的草果,从乙酸乙酯萃取物中分离出来一个新的单萜化合物并进行了合成.
本课题组[19-20]曾用固相微萃取法等研究了草果干果实释放出的香气成分并与精油进行了比较;还发现草果精油具有清除NaNO2活性[21].为了对上述内容进行深入研究,本文采用Clevenger法萃取云南产草果得到的精油成分,通过GC-MS分析检测,采用保留指数RI(retention index)法解析并于匹配度解析法比较,定量分析主要成分1,8-桉树脑含量.并选择与文献[14],文献[15],文献[17]不同的6种菌,即大肠杆菌,白葡萄球菌,枯草芽孢杆菌,青霉,根霉及米曲霉,用于测定草果精油的抗菌活性,为草果精油的应用提供参考数据.
1 实验部分
1.1 主要材料与仪器
草果产自云南,2010年3月购于哈尔滨香辛料市场.C6~C26正构烷烃标样,美国Supelco公司).大肠杆菌、白葡萄球菌、枯草芽孢杆菌、青霉、根霉和米曲霉由哈尔滨商业大学生物实验室提供.牛肉膏、蛋白胨、琼脂(北京奥博星生物技术有限责任公司).1,8桉树脑(GC纯度99.99%,日本萜化学公司).
6890N/5973型气相色谱质谱联用仪,美国Agilent公司;气质色谱柱为HP-5 ms(30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,美国 Agilent公司;GC-9A型气相色谱仪,日本岛津公司;气相色谱柱SE-54(30 m ×0.25 mm ×0.4 μm),大连中汇达科学仪器有限公司;LD2X-30KBS型立式高压灭菌锅,上海电安医疗器械厂;DHP-9032型电热恒温培养箱,上海一恒科技有限公司;DL-CJ-1F型超净操作台,哈尔滨仪器五厂;13395HZX型显微镜,上海莱卡显微镜系统有限公司.
1.2 实验方法
1.2.1 Clevenger法的草果精油萃取操作
Clevenger法的草果精油萃取操作参照文献[20]和文献[21].
1.2.2 GC-MS分析条件及成分解析
GC-MS分析条件参照文献[20]和文献[21].成分解析时,与数据库标准谱图对照的解析方法是采用标准质谱数据库NIST 98进行匹配对照,取85%以上匹配度数据.当有多个高于85%匹配度时,选取最高值,同样匹配度时,选择匹配度概率较高值,匹配度低于85%者为未知.根据保留指数RI解析方法是使用C6~C26正构烷烃标样,与精油样品同样条件下进行GC-MS分析,将所得数据经AMDIS 32软件分析得到保留指数RI,与文献的RI值[22]越接近准确度越高.成分相对含量采用峰面积归一化法计算.
1.2.3 1,8-桉树脑的定量分析
GC分析条件是柱温在60℃保持1 min,以5℃/min升到150℃,保持1 min,再以20℃/min升到230℃,保持5 min,载气为N2,进样量1 μL,分流比 60∶1(v/v).
1,8-桉树脑标准曲线的绘制是用无水甲醇配制质量浓度为80,60,40,20,10 mg/mL的1,8-桉树脑标准样品溶液,并按N2000工作站(杭州大学智达信息工程有限公司)单组份5点校正法以峰面积的响应值绘制标准曲线.
精油中1,8-桉树脑的含量测定是将草果精油用甲醇稀释10倍后,按1.2.3中GC条件分析3次取其平均值,得到稀释后草果精油中桉树脑的峰面积响应,由标准曲线求得稀释后的草果精油中桉树脑浓度,再乘以稀释倍数10,即得草果精油中1,8-桉树脑的质量浓度C.
草果精油密度测定和1,8-桉树脑的定量计算是草果精油密度按照中国药典附录41相对密度测定法进行测定,再用式(1)计算草果精油中桉树脑的质量分数.
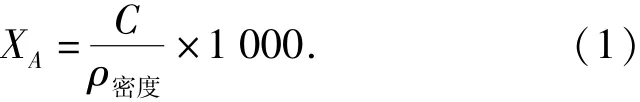
式(1)中ρ密度是草果精油的绝对密度,g/mL;C是标准曲线测定的纯草果精油中桉树脑的质量浓度,mg/mL;XA是草果精油中桉树脑的质量分数,%.
1.2.4 抗菌活性测定
1.2.4.1 培养基的配制
细菌液体培养基是使用蛋白胨1 g,NaCl 0.5 g,牛肉膏0.5 g,按照常规方法制备,灭菌待用.
霉菌液体培养基是使用马铃薯200 g和葡萄糖20 g,按照常规方法制备,灭菌待用.
细菌和霉菌固体培养基是加入1.5%的琼脂粉于上述各液体培养基,灭菌得到营养琼脂培养基(细菌用)和马铃薯葡萄糖琼脂培养基(霉菌用).
1.2.4.2 液体菌悬液的配制
0.9 %质量分数的生理盐水的配制是取9 g氯化钠用1 000 mL蒸馏水定容后灭菌备用.此生理盐水用于液体菌悬液的配制.
所有菌种均制备成液体菌悬液,调整菌落总数为108~109cfu/mL.细菌是通过培养时间来调整,霉菌则是采用固体培养基培养出相应的霉菌后,将其制成高浓度孢子悬液,用无菌生理盐水稀释法调整,具体配制方法如下.
细菌菌悬液的制备是取大肠杆菌、白葡萄球菌、枯草芽孢杆菌种接入细菌液体培养基中,于37℃下培养:大肠杆菌培养14 h、白葡萄球菌14 h、枯草芽孢杆菌22 h,用GB/T 4789.2—2003食品卫生微生物检验法测定其菌落总数,用无菌生理盐水稀释法调整至108~109cfu/mL备用.
霉菌菌悬液的制备是将青霉、根霉、米曲霉接种于马铃薯葡萄糖琼脂培养基后,于30℃下培养10 d后,在生理盐水中将菌落刮下,过滤后即得高浓度孢子悬液.用血球计数板计数霉菌的孢子总数,用无菌生理盐水稀释法调整至108~109cfu/mL备用.
1.2.4.3 抗菌性测定及抑菌率的计算
向培养皿中加入20 mL融化并冷却到45~55℃的无菌固体培养基,待其凝固后,用移液器吸取0.3 mL制备好的液体菌悬液注入其中并涂布均匀.取灭菌滤纸片(直径6.00 mm)放置于培养皿中央,用移液器吸取5 μL的样品(草果精油或桉树脑)注入到滤纸片的正中央后,细菌于37℃培养24 h,霉菌30℃培养72 h后,测定抑菌圈直径.每个样品和对照物同时进行3个平行实验,取其平均值.抑菌率计算如式(2).
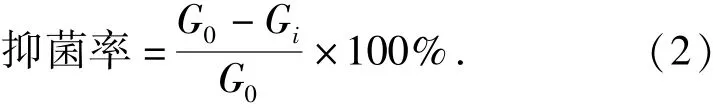
式(2)中G0为空白对照的菌种生长量,Gi为样品或对照物的菌种生长量.菌种生长量(mm)=培养基的直径(mm)-抑菌圈直径(mm).
实验抑菌率所有数据均用数据处理软件PASW Statistics 18中用邓肯极差法进行ANONA差异性分析处理,数值用均值和标准差表示,用不同的小写字母表示不同的显著差异.
2 结果与讨论
2.1 草果精油成分分析结果
用GC-MS分析草果精油获得总离子流谱图及匹配度法解析结果参见文献[20]和文献[21].共检测出38个成分,根据数据库标准谱图匹配度对照法,解析出占总成分98.40%的32个成分,精油主要成 分 是 1,8-桉 树 脑 (40.89%),α-水 芹 烯(9.77%),2-异丙基苯甲醛(6.99%)等.
由于很多植物精油的主要成分是由萜类化合物构成,萜类化合物具有异构体数量多,差别较小的特点,虽然,用数据库标准谱图对照匹配度对照法解析鉴定植物精油成分具有简便快速的优点,但是,在解析时,会出现几种萜类化合物同时都具有很高的匹配度,虽然,通常选择匹配度概率较高值,但是,有时会出现很难确定的成分,而采用保留指数RI法,利用与脂肪烃标样保留指数比较,就可以容易解决此类问题,国外普遍采用此法进行复杂的精油成分分析.
根据保留指数RI法解析草果精油的结果如表1.解析鉴定出占总成分97.14%的30个成分,与匹配度对照法比较,二者一致的成分有24个成分,占总成分的92.81%,从顺序看,所鉴定的大部分成分与匹配度法[20-21]基本一致.
匹配度对照法鉴定出来的莰烯、(+)-4-蒈烯、茚满-4-甲醛,在RI法中并没能鉴定出来;匹配度对照法鉴定出来的2-异丙基苯甲醛、α-甲基肉桂醛、(E)-2-十二烯-1-醛、β-荜澄茄烯等成分,在 RI法中分别被确定为4-丙基苯甲醛、古巴烯、乙酸(E)-2-癸烯醇酯和大根香叶烯,这是因为它们之间结构非常相似的缘故.
2.2 草果精油主成分1,8-桉树脑含量分析结果
虽然,采用GC-MS分析可以得到精油各成分相对分含量,但是,并非真实的成分质量分数.本文采用GC面积外标法对草果精油主成分1,8-桉树脑进行定量分析.1,8-桉树脑标准曲线的绘制结果如图1.由图1可知得到桉树脑标准曲线为y=5.82×10-5x.其中x为峰面积响应值;y为桉树脑质量浓度,mg/mL;R2=0.999 0.
用GC分析草果精油得到1,8-桉树脑峰面积见表2.由表2可以看出,草果精油峰面积的相对标准偏差为3.75%,小于5%,说明重复性好,精密度高.
表2中的峰面积平均值,由标准曲线求得相应稀释后精油中桉树脑的浓度为44.398 mg/mL,换算后,草果精油中桉树脑的浓度为443.98 mg/mL,再由测得草果精油的密度为0.924 3 g/mL计算得到草果精油中的主要成分1,8-桉树脑质量分数为48.03%,高于GC-MS面积归一化法(40.89%),即草果精油中1,8-桉树脑的质量分数应为48.03%.
2.3 抗菌活性测定结果与分析
2.3.1 对细菌的抗菌活性测定结果与分析
用草果精油、1,8-桉树脑分别对大肠杆菌、白葡萄球菌以及枯草芽孢杆菌等3种常见细菌的抑菌活性进行了测定,结果见图2,图3和图4.
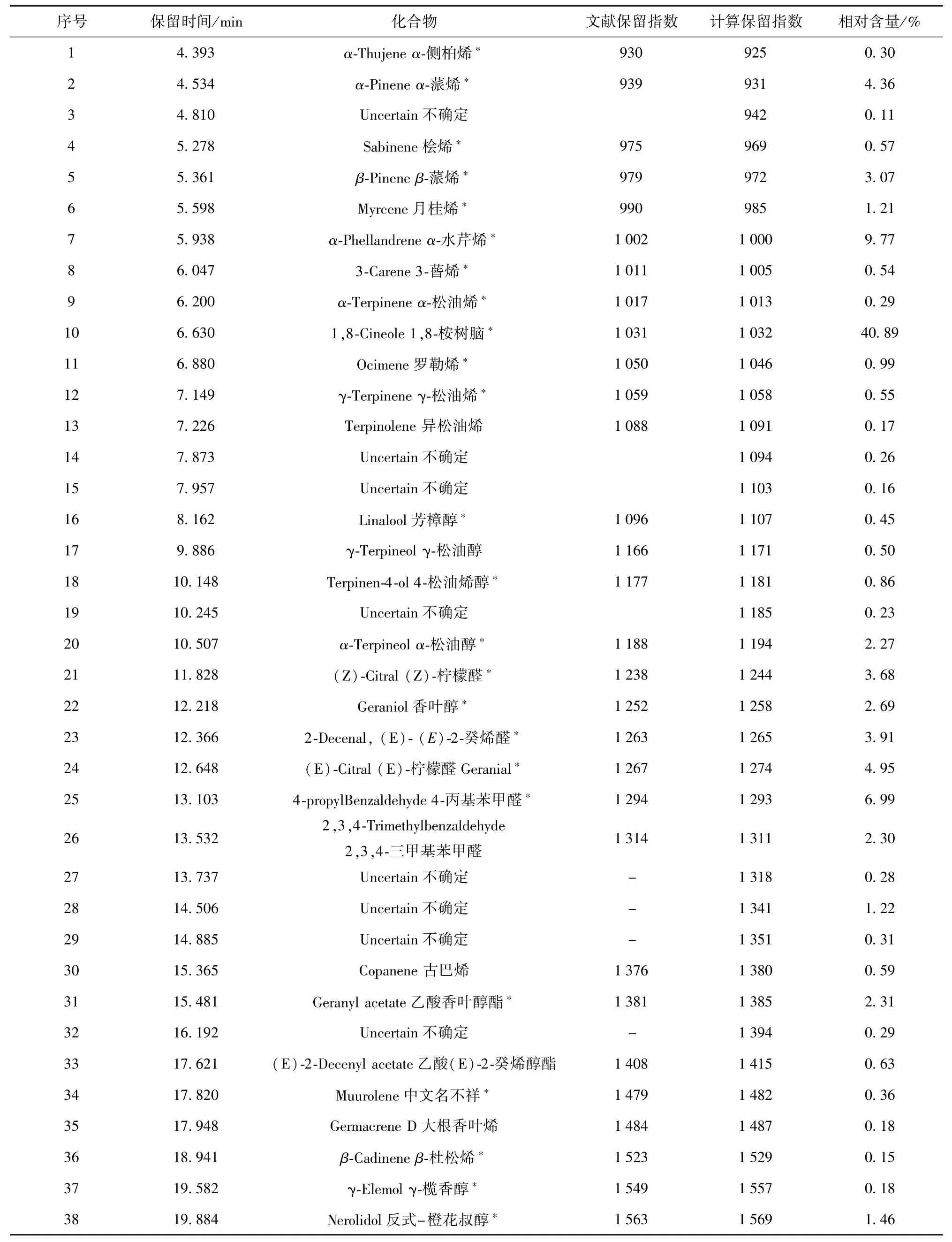
表1 RI法解析草果精油成分Tab.1 Identification results of essential oil components of Amomum tsao-ko

表2 草果精油中1,8-桉树脑的峰面积及数据处理结果Tab.2 Peak areas of 1,8-cineol in Amomum tsao-ko essential oil and results of data treatment

图1 1,8-桉树脑定量分析用标准曲线Fig.1 Standard carve for quantitative analysis of 1,8-cineol
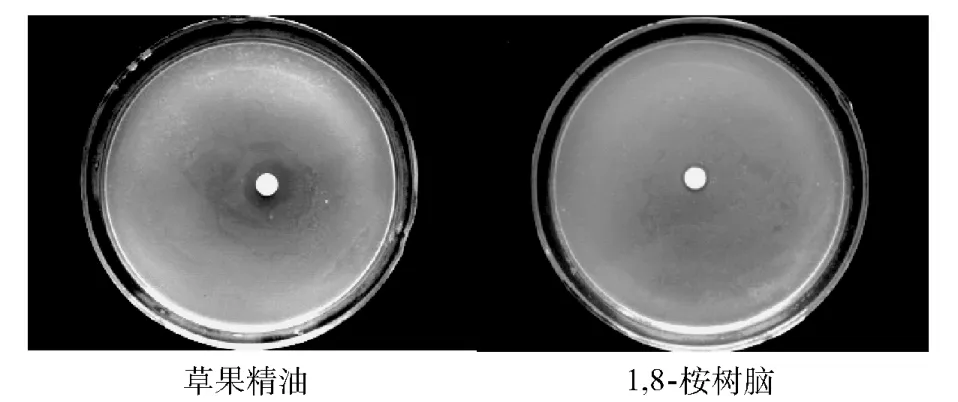
图2 对大肠杆菌的抗菌活性Fig.2 Antibacterial activity against E.Coli
由图2,图3和图4可见,通过肉眼直观地可见草果精油对大肠杆菌、白葡萄球菌以及枯草芽胞杆菌具有明显的抑菌活性,并形成清晰可见的抑菌圈.
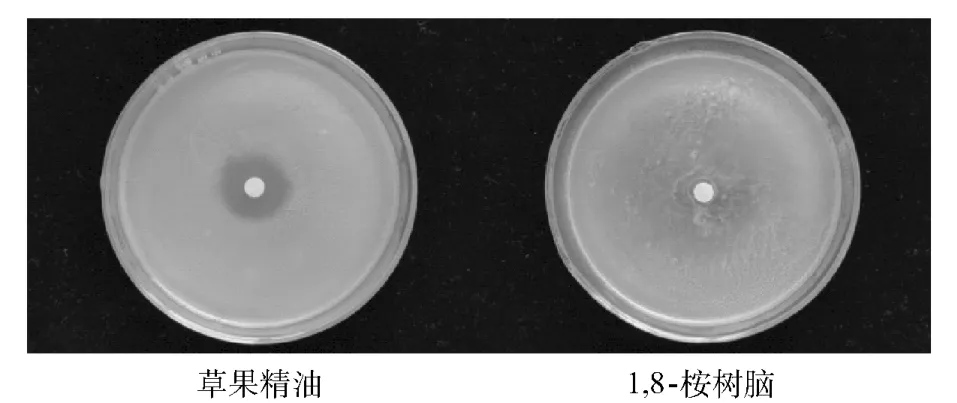
图3 对白葡萄球菌的抑菌活性Fig.3 Antibacterial activity against S.Albus
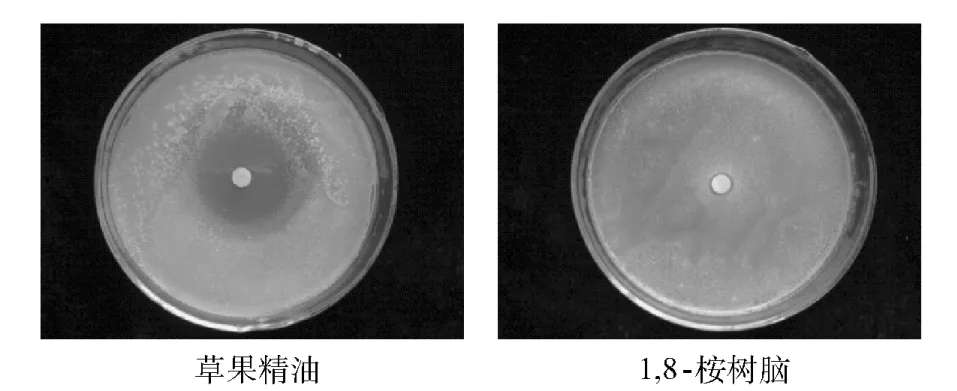
图4 对枯草芽胞杆菌的抗菌活性Fig.4 Antibacterial activity against A.oryzae
从抑菌圈直径大小和抑菌率看抑菌能力由大到小依次是枯草芽孢杆菌(20.5 mm;17.28%±6.38)、白葡萄球菌(17.2 mm;13.33% ±2.07)、大肠杆菌(12.0 mm;7.12% ±1.71).而精油主要成分的1,8-桉树脑对3种菌都没有抑菌活性,也就是精油的抑菌作用并非是其主要成分1,8-桉树脑而为,推断是其他成分的综合作用结果.抑菌圈平均直径,抑菌率以及对抑菌率采用邓肯极差法进行差异性分析等结果如表3.

表3 草果精油的抑菌活性测定结果Tab.3 Assaying results of antibacterial activity of essential oil of Amomum tsao-ko and 1,8-cineole
2.3.2 对霉菌的抗菌性测定结果和讨论
测定了草果精油和1,8-桉树脑对青霉,根霉和米曲霉三种常见霉菌的抗菌活性测定结果如图5,图6和图7.
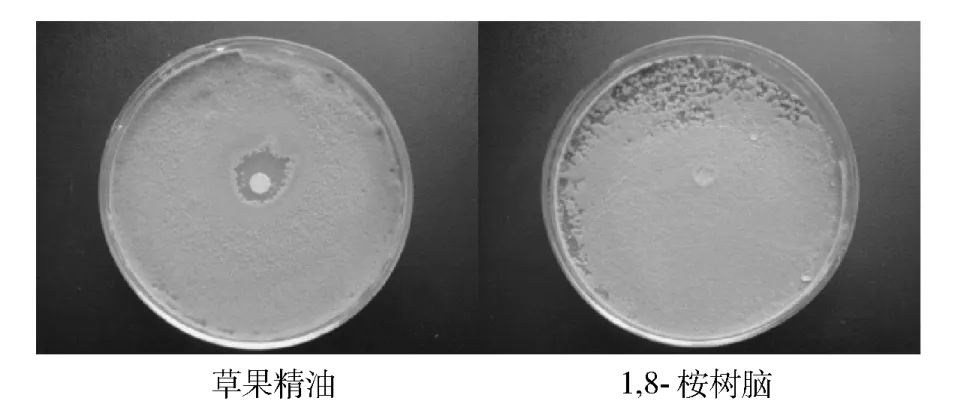
图5 对青霉菌的抗菌活性Fig.5 Antibacterial activity against Penicillium sp.

图6 对根霉的抗菌活性Fig.6 Antibacterial activity against Rhizopus sp.
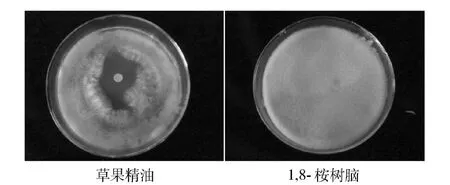
图7 对米曲霉抗菌活性Fig.7 Antibacterial activity against A oryzae.
草果精油对青霉、根霉和米曲霉显示明显的抑菌作用.而1,8-桉树脑没有抑制作用.抑菌圈直径以及抑菌率计算结果如表3.
从抑菌圈和抑菌率看精油对三种霉菌的抑菌能力由大到小依次为米曲霉(23.1 mm)、根霉(16.2 mm)、青霉(13.4 mm);相应的抑菌率由大到小依次为米曲霉(20.36% ±4.33)、根霉(12.12% ±1.41)、青霉(8.76% ±2.53).
3 结 论
本文对采用Clevenger法萃取草果挥发性成分获得的精油进行GC-MS分析后,采用RI法进行解析,与以往报道[20-21]的匹配度对照解析法比较,38个成分中有24个成分一致,占总成分的92.81%.用外标法定量分析主要成分1,8-桉树脑质量分数为48.03%,比用 GC-MS的面积归一化法高7.14%.精油和1,8-桉树脑的抗菌活性测定结果显示,精油具有明显的抗菌活性.从抑菌圈直径和抑菌率看,对3种细菌的抑菌活性由大到小依次为枯草芽孢杆菌,白葡萄球菌,大肠杆菌;对3种霉菌的抑菌活性由大到小依次为米曲霉,根霉,青霉.草果精油的主要成分1,8-桉树脑对上述6种菌几乎没有抗菌活性,明确了草果精油的抗菌活性并不是1,8-桉树脑作用的结果,而是其他成分综合作用的结果.
[1] 朱家柟.拉汉英种子植物名称[M].北京:科学出版社,2001:45.
[2] 范成友.日英汉香料词典[M].北京:化学工业出版社,1999:468.
[3] 肖培根,杨世林.实用中草药原色图谱[M].北京:中国农业出版社,2002:250-251.
[4] 徐昭玺.百种调料香料类药用植物栽培[M].北京:中国农业出版社,2002:243-244.
[5] 杨丽娟,张征,李俊峰,等.云南金平草果精油的微波萃取及化学成分研究[J].中药材,2004,27(11):821 823.
[6] 丁艳霞,谢欣梅,崔秀明.不同方法提取草果挥发性成分[J].河南大学学报,2009,28(4):284-287.
[7] 吴惠勤,黄晓兰,黄芳,等.草果挥发油的气相色谱-质谱指纹图谱[J].质谱学报,2004,25(2):92-95.
[8] 赵怡,邱琴,张国英,等.桂产、滇产草果挥发油化学成分的研究[J].中草药,2004,35(11):1225-1227.
[9] 马洁,张丽霞,彭建明.西双版纳引种栽培草果的化学成分研究[J].中成药,2008,30(8):1192-1194.
[10] 丁艳霞,崔秀明,李雪玲,等.草果挥发油的GC-MS指纹图谱[J].光谱实验室,2006,23(1):81-84.
[11] 朱缨,俞迪佳,吴健.草果挥发油成分的气相色谱-质谱联用分析[J].中国药业,2012,21(21):4-5.
[12] 林敬明,郑玉华,许寅超,等.超临界CO2流体萃取草果挥发油成分分析[J].中药材,2000,23(3):145 148.
[13] 吴燕飞,葛发欢,史庆龙,等.超临界CO2萃取草果挥发油成分研究[J].中药材,1997,20(5):240-241.
[14] 仇厚援,刘小玲,陈文学,等.草果抑菌物质提取分离及GC-MS分析[J].食品工业科技,2012,33(11):104-108,112.
[15] 谢小梅,龙凯,钟裔荣,等.草果的防霉作用的实验研究[J].中国药业,2002,11(5):45-46.
[16] Nguyen X D,Piet A L.The essential oil of amomum tsao-ko crevost et lemarie from Vietnam[J].J Ess Oil Res,1992(4):91-92.
[17] Yang Y,Yang R-W,Cai X-Q,et al.Chemical compo-sition and antimicrobial activity of the essential oil of Amomum tsao-ko[J].J Sci Food Agri,2008,88:2111-2116.
[18] Starkenmann C,Mayenzet F,Brauchli R,et al.Structure elucidation of a pungent compound in black cardamom:Amomum tsao-ko Crevost et Lemarié(Zingiberaceae)[J].Journal of Agricultural and Food Chemistry,2007,55(26):10902-10907.
[19] 陆占国,王鹏君,重松正巳,等.顶空固相微萃取-气质分析草果果实香气成分研究[J].香料香精化妆品,2010(4):17-21.
[20] 孟大威,李伟,王鹏君,等.草果香气成分研究[J].哈尔滨商业大学学报:自然科学版,2012,28(6):703 707.
[21] 陆占国,孟大威,李伟,等.Clevenger法提取草果精油的化学组成及清除NaNO2能力[J].天然产物研究与开发,2013,25(2):207-211.
[22] Robert P A.Identification of essential oil components by gas chromatography/mass spectromethy[M].4th ed.Carol Stream:Allured Business Media,2009:100-546.

