NO在水杨酸诱导葱莲果实上气孔运动中的作用
余君彤, 杨荞嘉, 鄢思斯, 马三梅, 王永飞
(暨南大学生物工程学系,广东 广州 510632)
气孔是植物体与外界环境进行气体交换的通道,它通常由2个保卫细胞围绕而成.保卫细胞对外部环境非常敏感,强光、高温、干旱和一定量的外源水杨酸、脱落酸、乙烯、H2O2、赤霉素和NO等物质均能诱导气孔关闭.植物体的光合作用、呼吸作用、水分代谢以及免疫反应[1]等都与气孔运动密切相关.前人关于气孔运动的研究主要集中在植物的叶片,但目前已经在植物的非光合器官如花冠[2-3]、果实[4-5]、种子[6]、初生根[7]、蜜腺[8-9]等部位的表皮发现有气孔存在.这些发现拓宽了气孔的分布范围,为研究气孔运动提供新材料.
葱莲(Zephyranthes candida)别名葱兰、玉帘、白花菖蒲,石蒜科(Amaryllidaceae)葱莲属(Zephyranthes Herb)的多年生草本植物.地下具鳞茎,线形叶,花单生于花茎顶端,蒴果近球形,3瓣开裂,种子黑色,扁平.我们前期的研究表明葱莲果皮上有气孔分布[10].虽然前人已经对果皮上气孔分布进行大量研究,但关于果实上气孔运动的研究尚未见报道.这些气孔的开关机制如何,NO和水杨酸能否影响这些气孔的开关,对这些问题,目前还没有明确的答案.
本试验用不同浓度的NO供体硝普钠(sodium nitroprusside,SNP)和水杨酸(salicylic acid,SA)分别对葱莲外果皮进行处理,观察气孔孔径的变化,以探讨NO和SA对葱莲外果皮气孔关闭的单独影响,并结合NO清除剂血红蛋白(hemoglobin,Hb)和硝酸还原酶(nitrate reductase,NR)抑制剂叠氮化钠(sodium azide,NaN3)对NO和SA的相互关系进行分析,为深入了解葱莲果实上气孔的功能以及在调控葱莲果实气孔运动过程中NO与SA的相互关系和作用机制奠定基础.
1 材料和方法
1.1 植物材料
实验材料是暨南大学校园内人工栽培的葱莲(Zephyranthes candida(Lindl.)Herb).采集直径为1.4 cm左右的果实,对其外果皮进行研究.
1.2 NO和SA处理
将葱莲的果实先用蒸馏水洗净,撕取外果皮,用毛笔小心刷除黏附的叶肉细胞,放入盛有表皮条缓冲液(10 mmol·L-1Mes/KOH,50 mmol·L-1KCl,100 μmol·L-1CaCl2,pH 6.20)的培养皿中,置于25 ℃和可见光(PAR 300 μmol·m-2·s-1)下处理3 h以促使气孔处于开放状态.每个实验处理观察10个表皮条,重复3次.
(1)单独处理 研究单独的NO和SA对光下气孔运动的影响时,将光下处理3 h的表皮条转移到含有不同浓度 NO(1、10、100 和1000 μmol·L-1)或 SA(1、10、100 和 1 000 μmol·L-1)的 MES 缓冲液内,继续处理3 h,测量气孔孔径.
(2)共处理 研究NO和SA对光下气孔运动的相互关系时,将可见光下处理3 h的表皮条分别转移到以下3种含有不同物质的MES缓冲液内:(Ⅰ)100 μmol·L-1NO;(Ⅱ)100 μmol·L-1SA;(Ⅲ)100 μmol·L-1NO 和 100 μmol·L-1SA.在 25℃可见光下培养3 h后,测量表皮条气孔孔径并拍照记录.
研究清除NO后,SA对葱莲外果皮气孔运动的影响时,将可见光下处理3 h的表皮条分别转移到以下含有不同物质的MES缓冲液内:
(Ⅰ)质量分数1%Hb;
(Ⅱ)100 μmol·L-1NaN3;
(Ⅲ)100 μmol·L-1SA;
(Ⅳ)质量分数1%Hb和100 μmol·L-1SA;
(Ⅴ)100 μmol·L-1NaN3和 100 μmol·L-1SA.
在25℃可见光下培养3 h后,测量表皮条气孔孔径并拍照记录.
1.3 气孔孔径的测定
用Nikon YS100显微镜,在40倍物镜下,每个处理测量80个气孔的孔径,取平均值.
1.4 数据处理
实验数据处理和相关分析用SPSS 13.0和Excel 2003软件完成.
2 结果
2.1 NO对葱莲外果皮上气孔关闭的影响
在1 ~1 000 μmol·L-1浓度范围内,NO 可显著诱导葱莲外果皮的气孔关闭(P<0.05),且具有明显的浓度效应,随着NO浓度的升高,其诱导气孔关闭的作用更加明显(图1).加入NO 3 h后,NO浓度为 1、10、100 和 1 000 μmol·L-1的葱莲的花冠下表皮气孔孔径分别比 0 μmol·L-1时减小 18.7%、23.2%、28.8%和 34.4%.

图1 不同浓度NO对葱莲外果皮上气孔关闭的影响Fig.1 Effect of NO on the stomatal closure on the epicarp of Z.candida with different concentrations
2.2 SA对葱莲外果皮上气孔关闭的影响
图 2 显示,在1 ~1 000 μmol·L-1浓度范围内,SA可显著诱导葱莲外果皮的气孔关闭(P<0.05),且也具有明显的浓度效应,SA浓度越高,气孔孔径越小,诱导气孔关闭的作用越明显.加入SA 3 h后,SA 浓度为 1、10、100 和 1 000 μmol·L-1的葱莲外果皮气孔孔径分别比0 μmol·L-1时减小19.1%、23.3%、30.6%和 42.7%.

图2 不同浓度SA对葱莲外果皮上气孔关闭的影响Fig.2 Effect of SA on the stomatal closure on the epicarp of Z.candida with different concentrations
2.3 NO和SA在诱导葱莲外果皮上气孔关闭中的关系
如图3 所示,处理3 h 后,100 μmol·L-1NO 和100 μmol·L-1SA均显著促进气孔关闭(P<0.05),用这两者共同处理葱莲外果皮时,其诱导气孔关闭的效应进一步增强(P<0.05).单独的100 μmol·L-1NO和SA处理下的气孔孔径分别比对照减小29.7%和31.1%,两者共处理时,气孔孔径比对照减小53.4%.

图3 NO和SA在诱导葱莲外果皮上气孔关闭中的关系Fig.3 Relation of NO and SA on the stomatal closure on the epicarp of Z.candida
2.4 清除NO对SA诱导葱莲外果皮上气孔关闭作用的影响
图4显示,NO的清除剂Hb本身可使气孔孔径比对照略微减小(P>0.05),当 SA和 Hb共处理时,气孔孔径比单独的SA处理时显著增大(P<0.05);同样NR的抑制剂NaN3本身也可使气孔孔径略微减小(P>0.05),在 SA处理的同时加入NaN3也可降低SA诱导气孔关闭的效应.
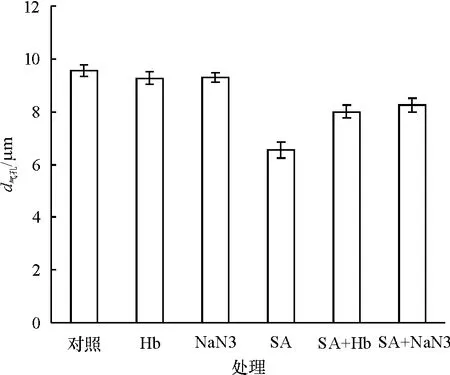
图4 Hb和NaN3对SA诱导葱莲外果皮上气孔关闭的影响Fig.4 Effect of Hb and NaN3on SA-induced stomatal closure on the epicarp of Z.candida
3 讨论
NO和SA是广泛存在于植物体内的生长调节物质.NO是一种具有水溶性和脂溶性的气体小分子,作为植物体内重要的信号分子,能够调节植物体的气孔运动、种子萌发、生长发育、防御反应、基因表达和细胞凋亡等生理过程[11-13].NO常温下不稳定,通常用SNP作为NO的外源供体[12].在植物细胞中主要通过两种途径合成NO,硝酸还原酶(nitrate reductase,NR)途径和一氧化氮合酶(nitric oxide synthase,NOS)途径[14].外源 NO 可以诱导蚕豆、豌豆、紫色鸭跖草、拟南芥、番茄、大麦和小麦的气孔关闭,并且具有浓度效应和时间效应.SA是植物体内普遍存在的一种酚类化合物,在植物体内有多种生理调节作用,如促进乙烯的生物合成,调节植物的光周期,影响黄瓜的性别分化,影响植物的抗病性,诱导气孔关闭等.Chen等[15]的研究表明SA的作用机制可能部分与H2O2有关.王晓黎等[16]发现黄瓜子叶表皮气孔开度对SA的响应表现出浓度效应和时间效应.NO和SA对葱莲果实上气孔运动的影响经过本实验进一步表明,1~1 000 μmol·L-1NO和SA均能促进葱莲果实上的气孔关闭(图1,2).
NO和SA在植物体内的一些生理反应上存在相互关系.NO和SA都能增强植物体的防御反应[17].NO可通过复杂的信号传导激活苯丙氨酸解氨酶合成SA[18];SA能通过改变顺乌头酸酶、过氧化物酶和过氧化氢酶来参与NO的生理效应[17].本实验结果表明,NO和SA共同处理葱莲外果皮时,其诱导气孔关闭的效应明显大于NO或SA的单独处理(P<0.05).NO和SA在诱导葱莲果实上气孔关闭过程中,具有协同效应,NO和SA的信号交叉也可能存在于葱莲果实(图3).
为了进一步了解NO和SA在调控气孔运动过程中的相互关系,我们又测定了NO的清除剂和NR抑制剂对SA调控葱莲外果皮上气孔运动的影响.结果表明,NO的清除剂和NR抑制剂可明显降低SA诱导的气孔关闭效应(图4).NO参与了SA诱导的气孔关闭,并且SA可能是通过激活植物体内的NR途径产生NO.而NO和SA在葱莲果实内诱导气孔关闭的确切机制还有待进一步研究.
[1] MELOTTO M,UNDERWOOD W,KOCZAN J,et al.Plant stomata function in innate immunity against bacterial invasion[J].Cell,2006,126(17):969-980.
[2] KRIZEK B A,PROST V,MACIAS A.AINTEGUMENTA promotes petal identity and acts as a negative regulator of AGAMOUS[J].Plant Cell,2000,12(8):1357-1366.
[3] AZAD A K,SAWA Y,ISHIKAWA T,et al.Temperature-dependent stomatal movement in tulip petals controls water transpiration during flower opening and closing[J].Ann Appl Biol,2007,150(1):81-87.
[4] PESCHEL S,BEYER M,KNOCHE M.Surface characteristics of sweet cherry fruit:stomata-number,distribution,functionality and surface wetting[J].Sci Hortic,2003,97(3-4):265-278.
[5] ZIELI'NSKI J,TOMASZEWSKI D,GUZICKA M,et al.Stomata on the pericarp of species of the genus Rosa L.(Rosaceae)[J].Plant Syst Evol,2010,284(1/2):49-55.
[6] PAIVA E A S,LEMOS-FILHO J P,OLIVEIRA D M T.Imbibition of Swietenia macrophylla(Meliaceae)seeds:the role of stomata[J].Ann Bot,2006,98(1):213-217.
[7] CHRISTODOULAKIS N S, MENTI J,GALATIS B.Structure and development of stomata on the primary root of Ceratonia siliqua L.[J].Ann Bot,2002,89(1):23-29.
[8] DAVIES K L,STPICZYNNSKA M,GREGG A.Nectarsecreting floral stomata in Maxillaria anceps Ames& C.Schweinf.(Orchidaceae)[J].Ann Bot,2005,96(2):217-227.
[9] HORNER H T,HEALY R A,CERVANTES-MARTINEZ T,et al.Floral nectary fine structure and development in Glycine max L.(Fabaceae)[J].Int J Plant Sci,2003,164(5):675-690.
[10] 姜兆玉,余君彤,王永飞,等.气孔在葱莲不同器官分布的初步研究[J].华北农学报,2010,25(增刊):140-143.
[11] 周永斌,殷有,苏宝玲,等.外源一氧化氮供体对几种植物种子的萌发和幼苗生长的影响[J].植物生理学通讯,2005,41(3):316-318.
[12] DELLEDONNE M,XIA Y,DIXON R A,et al.Nitric oxide functions as a signal in plant disease resistance[J].Nature,1998,394(6693):585-588.
[13] DELLEDONNE M,ZEIER J,MAROCCO A,et al.Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response[J].Proc Natl Acad Sci USA,2001,98(23):13454-13459.
[14] PALAVAN-UNSAL N,ARISAN D.Nitric oxide signaling in plants[J].Bot Rev,2009,75(2):203-229.
[15] CHEN Z,RICIGLIANO J W,KLESSIG D F.Purification and characterization of a solute salicylic acid-binding protein from tobacco[J].Proc Natl Acad Sci USA,1993,90(20):9533-9537.
[16] 王晓黎,崔世茂,张志刚,等.水杨酸对黄瓜子叶表皮气孔开度的调节作用[J].西北植物学报,2011,31(2):305-314.
[17] KLESSIG D F,DURNER J,NOAD R,et al.Nitric oxide and salicylic acid signaling in plant defense[J].Proc Natl Acad Sci USA,2000,97(16):8849-8855.
[18] DANGL J.Plants just say NO to pathogens[J].Nature,1998,394(6693):525-527.

