玉米、小麦、水稻原生质体制备条件优化
孙鹤,郎志宏,朱莉,黄大昉
中国农业科学院生物技术研究所,北京 100081
植物中瞬时表达检测是一种快速的、高通量的分析系统,它被广泛地用于分析基因功能,如基因表达、亚细胞定位、蛋白活性及蛋白与蛋白的相互作用等[1-3]。常用的植物瞬时表达系统有洋葱表皮细胞[4]、悬浮细胞[5]、愈伤组织[6]、烟草叶片[7]及原生质体[8-10]等。原生质体具有一致性,是比较均一的去除细胞壁的单细胞群体。原生质体处于相同的分离周期,导入的外源基因表达具有较好的同步性;同时不需进行长时间的组织培养,制备检测过程仅需2 d 时间。原生质体瞬时表达体系为研究基因亚细胞定位和基因表达的调控提供了一种方便而有效的实验系统。因此,原生质体瞬间表达系统至今已广泛应用于各种研究,包括生产有用的代谢产物[11]、多倍体的产生[12]及植物信号机制研究等[13-16]。
1960年,Cocking 首次发表文章报道植物原生质体的分离方法[17]。尽管当时还没有有效的DNA 导入方法,但原生质体已经成为细胞壁再生、细胞分裂、胚的生成、分化及植物病毒研究的有效工具[18-19]。PEG 法[20]、电击法[21]、显微注射法[22]的发展使得原生质体瞬时表达的应用更为广泛。报告基因GUS[23]、LUC[24]、GFP[25]的引入使得原生质体瞬时表达系统变得更为经济与方便。
拟南芥原生质体的制备条件较为完善,Sheen 实验室建立了拟南芥叶片原生质体获得以及转化的标准方法,通过此方法可以从1 g 拟南芥叶片中获得107个原生质体[26]。但通过此方法从1 g 玉米叶片中可获取5×106个原生质体[27],虽然完全可以满足试验需求,但远不如拟南芥原生质体的产量,所以有望通过改良试验条件进一步提高产量。小麦、水稻的原生质体虽已成功用于进行瞬时表达研究[28-31],但还没有建立一个标准的原生质体制备方法。本实验从玉米、小麦、水稻原生质体分离过程中酶浓度、酶解时间和离心力大小等因素着手,分析这几个关键因素对其原生质体产量及活力的影响,为玉米、小麦、水稻原生质体的制备和利用原生质体进行基因表达研究提供理论依据和技术参考。
1 材料与方法
1.1 材料培养
将玉米(Zea mays L.,var.Zong 3)、小麦(Trticwm aestivwm L.,var.Chinese Spring)、水稻(Oryza sativa L.,var.Nipponbare)种子播种于土中(蛭石:泥炭土=1:1),光照培养(光/暗周期为16 h/8 h)。
1.2 原生质体的分离
待叶片长度为10~15 cm 时(约10 d),称取1 g 叶片,切成0.5 mm 细丝。把切好的叶片移入含有40 mL 酶解液(1%、1.5%和2%纤维素酶R-10(Yakult,JAPAN),0.3%、0.5%和0.7%离析酶R-10(Yakult,JAPAN),0.4 mmol/L D-甘露醇,20 mmol/L KCl,20 mmol/L MES (2-(N-吗啉)乙烷磺酸,pH 5.7),55℃水浴锅中加热10 min,冷却到室温后,加入10 mmol/L CaCl2,5 mmol/L β-巯基乙醇,0.1% BSA,0.45μm 过滤)的烧瓶中,28℃黑暗中消化,采取振荡酶解,转速为50 r/min。
1.3 原生质体的纯化
使用过滤网(200目)过滤酶解液,采取不同离心力进行离心(100×g、500×g 和1000×g),离心时间设定为2 min,沉淀原生质体。移除上清液,加入预冷的缓冲液W5(154 mmol/L NaCl;125 mmol/L CaCl2;5 mmol/L KCl;2 mmol/L MES;pH 5.7),轻轻旋转试管洗涤沉淀,离心(100×g、500×g 和1000×g)2 min,弃上清液,加入500μL W5,重悬沉淀,置于冰上30 min。
1.4 试验设计
依据已报道的文献资料[32-36],采取4因素3水平的正交设计方案对酶解液中两种酶的浓度、酶解时间、离心力大小4个因素进行分析,每个因素取3个水平,纤维素酶浓度的选取3个水平分别为1%、1.5%和2%,离析酶浓度为0.3%、0.5%和0.7%;离心力大小为100×g、500×g 和1000×g。根据正交试验极差分析得出原生质体制备的最适条件。
1.5 原生质体的计数
用W5稀释原生质体溶液10倍,取少量上述原生质体悬浮液滴加在0.1 mm 血球计数板上。当原生质体充满计数室后,在普通光学显微镜下观察,并用细胞计数板测定原生质体的浓度:计算4个角上大格及中央大格(共5个大格)内的原生质体个数,然后按公式计算原生质体数,每个样品计数3个重复,最后计算出每克鲜重材料游离得到的原生质体产量(个/g FW)。原生质体产量(个/g FW)=5个大格内总原生质体个数×104×稀释倍数/叶片质量(g FW)。
1.6 原生质体的活性检测
原生质体活力测定用0.01%二乙酸荧光素(FDA)染色,用荧光相差显微镜(Zeiss,Axio Imager A1)统计发绿色荧光的原生质体数和原生质体总数,原生质体活力以一个视野中有活力的原生质体占该视野中原生质体总数的百分数来表示,选取3个有代表性的视野进行统计,取平均值。
原生质体活力=(发绿色荧光的原生质体数/原生质体总数)×100%。
1.7 原生质体转化
原生质体转化采用PEG-Ca2+介导法。将制备好的原生质体100×g 离心2 min,吸去上清,加入MMg 溶液(4 mmol/L MES,0.4 mol/L 甘露醇,15 mmol/L MgCl2)至原生质体的终浓度约为106个/mL。100μL 原生质体中加入质粒载体20μg,混匀后加入110μL 30%的PEG-Ca2+(30%PEG4000,0.2 mol/L 甘露醇,100 mmol/L CaCl2)溶液,混匀后于23℃孵育20 min。之后加入440μL 缓冲液 W5终止反应,200×g 离心2 min,吸去上清,加入260μL 缓冲液 WI(4 mmol/L MES,0.5 mol/L 甘露醇,5 mmol/L KCl),混匀后加入24孔细胞培养板中(5%胎牛血清冲洗10 s),23℃培养12~16 h。
1.8 实验所用载体
本实验所用载体为植物转化载体pUFN,是由玉米泛素蛋白启动子、绿色荧光蛋白(GFP)基因、胭脂碱合成酶终止子构成。
1.9 显微观察
吸取24孔细胞培养板中的原生质体20 L,滴于载玻片中央,利用激光共聚焦显微镜(Zeiss LSM 710 META)观察原生质体中GFP 的表达情况。激发波长为488 nm,发射波长为510 nm。统计发绿色荧光的原生质体个数和原生质体总数,转化率以一个视野中发绿光的原生质体占该视野中原生质体总数的百分数来表示,选取3个有代表性的视野进行统计,取平均值。转化率=(发绿色荧光的原生质体数/原生质体总数)×100%。
2 结果
2.1 玉米原生质体的制备条件
利用正交分析法对影响玉米原生质体产量的几个因素进行分析,利用细胞计数板进行计数(图1A)。将不同条件下制备的原生质体的数量列表分析(表1)。从表1中的极差分析可知,纤维素酶浓度的R 值最大,说明这几个因素中纤维素酶浓度对玉米叶肉原生质体分离影响最大;同时酶解时间的R 值也较大,说明酶解时间也是原生质体产量的重要影响因素。而离心力大小对产量影响不大,离心力过大会导致破碎的原生质体增多,影响原生质体活力,不利于后续融合、转化等实验。所以综合原生质体产量、活力及酶解液中碎片数量等方面考虑,玉米幼叶原生质体的酶解最适条件为纤维素酶1.5%,离析酶0.5%,50 r/min 酶解7 h,100×g 离心2 min 收集,产量为7×106个/g FW。为了检测玉米原生质体活力,采用FDA 对玉米原生质体进行染色(图1B),同时将含有绿色荧光蛋白的载体 pUFN 通过PEG-Ca2+法转化玉米原生质体。在激光共聚焦显微镜下,GFP 荧光在细胞膜、细胞质和细胞核中均有分布(图2)。统计视野下表达GFP 的原生质体个数和原生质体总数,得到玉米原生质体的转化率为76.86%。

图1 用细胞计数板对细胞进行计数(A)和FDA 染色检测原生质体活力(B)Fig.1 Counting the number of cells by haemocytometer (A),and the viability of protoplasts detected by FDA staining (B).
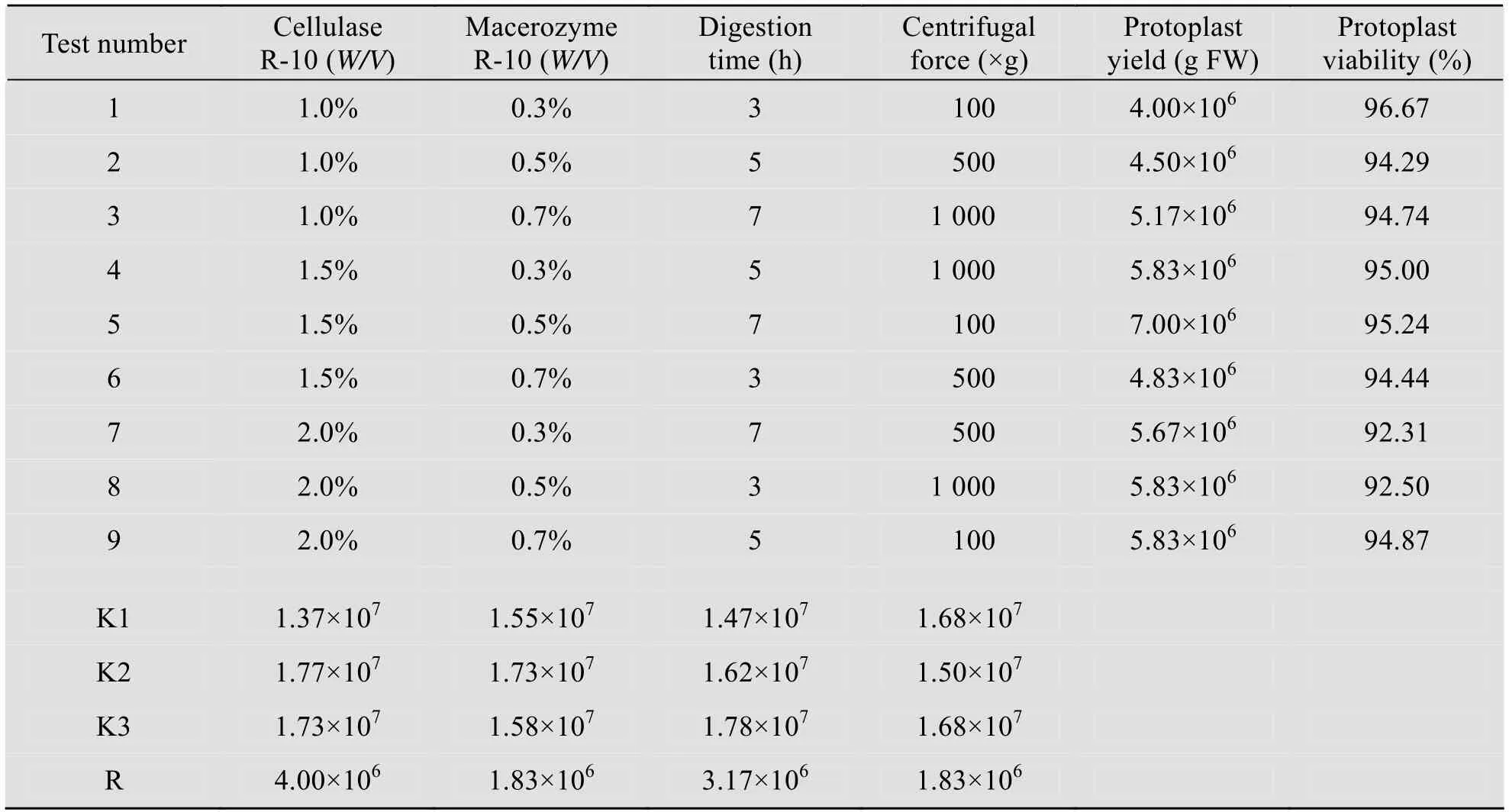
表1 不同条件对分离玉米幼叶原生质体数量的影响Table 1 Effect of different conditions on the yield of protoplast from maize leaves

图2 载体pUFN 瞬时转化玉米原生质体Fig.2 Maize protoplasts transiently transfected with pUFN plasmid.(A) GFP excitation 488 nm.(B) Bright field.(C)A and B merged.Scale bar =50μm.
2.2 小麦原生质体的制备条件
采取与玉米原生质体制备相同的条件,随着酶解时间的延长,原生质体的产量逐渐增加,酶解5 h 时其产量达到最高,酶解7 h 时,原生质体的产量及活力均大幅度下降,酶解液中碎片明显增多,说明原生质体产量下降的原因是原生质体的大量破碎。因此综合原生质体产量、活力及酶解液中碎片数量等方面考虑,小麦幼叶原生质体的酶解最适条件为纤维素酶1.5%,离析酶0.5%,50 r/min 酶解5 h,100×g 离心2 min 收集。细胞计数板计数及FDA 染色图片见图3。根据正交实验结果(表2),采取最佳分离条件进行进一步验证,最适条件下原生质体产量达到6×106个/g FW。为了进一步证明原生质体的活力,我们将含有绿色荧光蛋白的载体pUFN 通过PEG-Ca2+法转化小麦原生质体,利用激光共聚焦显微镜观察GFP 的表达情况,绿色荧光在细胞膜、细胞质和细胞核中均有分布(图4)。经统计,小麦原生质体的转化率为55.79%。
2.3 水稻原生质体的制备条件

图3 用细胞计数板对细胞进行计数(A)和FDA 染色检测原生质体活力(B)Fig.3 Counting the number of cells by haemocytometer (A),and the viability of protoplasts detected by FDA staining (B).

表2 不同条件对分离小麦幼叶原生质体数量的影响Table 2 Effect of different conditions on the yield of protoplast from wheat leaves

图4 载体pUFN 瞬时转化小麦原生质体Fig.4 Wheat protoplasts transiently transfected with pUFN plasmid.(A) GFP excitation 488 nm.(B) Bright field.(C)A and B merged.Scale bar =50μm.

表3 不同条件对分离水稻幼叶原生质体数量的影响Table 3 Effect of different conditions on the yield of protoplast from rice leaves
与玉米小麦不同的是,切好的水稻条状物漂浮在酶解液上面,接触面积较小,酶解不充分,所以我们引入真空抽气方法,大约5 min,直到叶片沉底,这样大大节约了酶解时间,提高了酶解效率。从实验结果分析可知(表3),离心力大小的R 值最大,说明这几个因素中离心力大小对水稻叶肉原生质体分离影响最大。在离心速度为100×g 和500×g 时,取上清液镜检,仍可看到较多数量的原生质体漂浮,说明在低速度离心条件下有较多的原生质体丢失。同时离析酶浓度的R值也较大,说明此因素也是影响原生质体产量的重要因素。所以水稻幼叶原生质体的酶解最适条件为纤维素酶2.0%,离析酶0.7%,50 r/min 酶解7 h,1000×g 离心2 min 收集。细胞计数板计数及FDA 染色图片见图5。根据正交实验结果,采取最佳分离条件进行进一步验证,最适条件下原生质体产量达到6×106个/g FW。为了进一步证明原生质体的活力,我们将含有绿色荧光蛋白的载体pUFN 通过PEG-Ca2+法转化水稻原生质体,利用激光共聚焦显微镜观察GFP 的表达情况(图6)。水稻原生质体的转化率较高,可以达到81.17%。

图5 用细胞计数板对细胞进行计数(A)和FDA 染色检测原生质体活力(B)Fig.5 Counting the number of cells by haemocytometer (A),and the viability of protoplasts detected by FDA staining (B).
3 讨论
从1985年开展瞬时表达研究以来,瞬时表达已经广泛应用于烟草、胡萝卜、豆科、禾谷类作物(如玉米、水稻)及林木等。原生质体瞬时表达系统特别适于利用报告基因来研究基因的亚细胞定位。烟草、拟南芥原生质体系统已经成功地用来研究基因的特性[4],但是对于玉米、水稻、小麦来说,烟草、拟南芥属于异源系统,异源系统中表达蛋白可能产生异常反应,可能会错误的定位[3],所以研究者认为用同源的系统来研究蛋白定位更为科学和准确。

图6 载体pUFN 瞬时转化水稻原生质体Fig.6 Rice protoplasts transiently transfected with pUFN plasmid.(A) GFP excitation 488 nm.(B) Bright field.(C) A and B merged.Scale bar=50μm.
一般来说,植物各个器官,如:根、茎、叶、花、果实、种子及愈伤组织和悬浮细胞等都可作为分离原生质体的材料。种子易贮藏,由种子生长得到植物材料比较简单容易,所以叶片是最易获得的植物材料,而愈伤组织及悬浮细胞等需要长时间的组培过程,且愈伤与悬浮细胞的培养是在暗处,所以不利于研究与叶绿体相关的基因的表达。实验证明新鲜分离的叶肉原生质体具有光合成活性及呼吸功能[37-38],所以常被用来研究光/叶绿体相关过程[31]。
目前,用于植物原生质体分离的酶主要有纤维素酶、果胶酶、离析酶、半纤维素酶、崩溃酶、蜗牛酶等。酶浓度也随酶解材料的不同而略有差异。分离叶片原生质体多采用纤维素酶和离析酶,所以本实验对这两种酶的最适浓度进行了摸索。同时,在其他条件相同的情况下,酶解时间越长,原生质体的产量越高,但破碎的细胞也随之增多,影响后续的实验。所以应控制酶解时间,以求在较短的时间内获得较多的原生质体。
本研究选用10日龄玉米、小麦、水稻幼苗叶片制备原生质体,通过正交试验设计,筛选出较适合玉米、小麦、水稻原生质体分离的条件。玉米与小麦所用的酶浓度相同,都是1.5%纤维素酶和0.5%离析酶,区别在于玉米在解离7 h时,产量达到最大值,为7×106个/g FW;而小麦原生质体的分离所需的时间仅为5 h,即达到产量的最大值6×106个/g FW。说明小麦细胞壁与玉米相比,更容易被酶解。水稻由于叶片较轻,需要真空处理5 min,方能使叶片与酶解液充分接触,保证酶解的有效进行。同时由于叶片厚度及细胞壁成分的影响,水稻原生质体的裂解需要较高浓度的酶:2.0%纤维素酶和0.7%离析酶。解离时间也较长,达7 h,产量为6×106个/g FW。
影响原生质体分离的因素较多,如反应液的渗透压的调节,不适宜的渗透压造成原生质体的胀裂。渗透压的调节一般是通过在酶解液中加入渗透剂。渗透剂维持一定的渗透压,使细胞处于质壁分离状态,不致膨胀破裂,以提高原生质体的产率与活力。不同植物材料游离原生质体时所用的渗透剂种类和浓度不尽相同[39-41]。本实验采用0.4 mol/L 甘露醇作为渗透剂,对玉米、小麦和水稻的分离均较好。本实验在酶解原生质体时,采用的是50 r/min 低速振荡的方法。原因是低速振荡增加了酶解液与进行酶解的材料的接触,同时还增加了氧气的供应,有利于原生质体的释放。
本实验只对影响原生质体分离的主要影响因素进行了初步摸索,原生质体酶解的过程中,还有很多需要考虑的因素,比如酶解液的pH 值、酶的纯度、酶解温度、植物生长的条件等[42]。所以还应做更多详细的实验来进一步提高分离原生质体的数量和质量。
我们对玉米、小麦和水稻原生质体的制备条件进行了初步摸索,为利用原生质体进行研究奠定了基础。为了更好地利用原生质体研究基因的表达、定位等,与原生质体转化效率有关的其他实验条件,比如质粒DNA 的纯度、DNA 与原生质体的比例及原生质体纯度等都需要进行分析。同时DNA 转化方法也需要实验优化,比如拟南芥原生质体转化通常用PEG 转化法,玉米原生质体转化通常用电击法效率更高[16]。本实验采用相同条件的PEG 转化方法对玉米、小麦、水稻原生质体进行转化,转化率各不相同。玉米的转化率为76.86%,小麦的转化率为55.79%,水稻的转化率较高,达到81.17%。2001年,Sheen 等利用PEG 法转化玉米原生质体,转化率为75%[9],本研究的结果与之接近。利用PEG 法转化水稻原生质体,Takai 等的转化率为40%[43],Zhang等的转化率达到53%~75%[44]。据报道,原生质体转化效率与载体大小有关。在水稻原生质体转化中,4.5 kb 的载体转化率为60%~70%,而12 kb的载体转化率在25%~30%[30]。本实验在水稻原生质体中获得了较高的转化率,而小麦的转化率相对较低,可以通过调整转化条件来改善,比如延长载体孵育时间,或者改变PEG 浓度等。
随着原生质体分离方法和基因工程技术的不断完善,原生质体瞬时表达系统将以其独有的优势在植物分子生物学研究中得到更加广泛的应用。
[1]De Sutter V,Vanderhaeghen R,Tilleman S,et al.Exploration of jasmonate signalling via automated and standardized transient expression assays in tobacco cells.Plant J,2005,44(6):1065−1076.
[2]Cheng SH,Sheen J,Gerrish C,et al.Molecular identification of phenylalanine ammonia-lyase as a substrate of a specific constitutively active Arabidopsis CDPK expressed in maize protoplasts.FEBS Lett,2001,503(2/3):185−188.
[3]Marion J,Bach L,Bellec Y,et al.Systematic analysis of protein subcellular localization and interaction using high-throughput transient transformation of Arabidopsis seedlings.Plant J,2008,56(1):169−179.
[4]Kitajima A,Asatsuma S,Okada H,et al.The rice alpha-amylase glycoprotein is targeted from the Golgi apparatus through the secretory pathway to the plastids.Plant Cell,2009,21(9):2844−2858.
[5]Lam SK,Siu CL,Hillmer S,et al.Rice SCAMP1 defines clathrin-coated,trans-Golgi-located tubular-vesicular structures as an early endosome in tobacco BY-2 cells.Plant Cell,2007,19(1):296−319.
[6]Zuraida AR,Rahiniza K,Hafiza MRN,et al.Factors affecting delivery and transient expression of gusA gene in Malaysian indica rice MR 219 callus via biolistic gun system.Afr J Biotechnol,2010,9(51):8810−8818.
[7]Kapila J,DeRycke R,VanMontagu M,et al.An Agrobacterium-mediated transient gene expression system for intact leaves.Plant Sci,1997,122(1):101−108.
[8]Fischer R,Hain R.Tobacco protoplast transformation and use for functional analysis of newly isolated genes and gene constructs.Methods Cell Biol,1995,50:401−410.
[9]Sheen J.Signal transduction in maize and Arabidopsis mesophyll protoplasts.Plant Physiol,2001,127(4):1466−1475.
[10]Liu HJ,Wei CH,Zhong YW,et al.Rice black-streaked dwarf virus minor core protein P8 is a nuclear dimeric protein and represses transcription in tobacco protoplasts.FEBS Lett,2007,581(13):2534−2540.
[11]Aoyagi H.Application of plant protoplasts for the production of useful metabolites.Biochem Eng J,2011,56(1/2):1−8.
[12]Grosser JW,Gmitter FG.Protoplast fusion for production of tetraploids and triploids:applications for scion and rootstock breeding in citrus.Plant Cell Tiss Org,2011,104(3):343−357.
[13]Abel S,Theologis A.Early genes and auxin action.Plant Physiol,1996,111(1):9−17.
[14]Gubler F,Raventos N,Keys M,et al.Target genes and regulatory domains of the GAMYB transcriptional activator in cereal aleurone.Plant J,1999,17(1):1−9.
[15]Uno Y,Furihata T,Abe H,et al.Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions.Proc Natl Acad Sci USA,2000,97(21):11632−11637.
[16]Hwang I,Sheen J.Two-component circuitry in Arabidopsis cytokinin signal transduction.Nature,2001,413(6854):383−389.
[17]Cocking EC.A method for the isolation of plant protoplasts and vacuoles.Nature,1960,187:962−963.
[18]Vasil IK,Vasil V.Totipotency and embryogenesis in plant cell and tissue cultures.In Vitro,1972,8(3):117−127.
[19]Zaitlin M,Beachy RN.The use of protoplasts and separated cells in plant virus research.Adv Virus Res,1974,19:1−35.
[20]Krens.In vitro transformation of plant protoplasts with Ti-plasmid DNA.Nature,1982,296:72−74.
[21]Jones H,Ooms G,Jones MG.Transient gene expression in electroporated Solanum protoplasts.Plant Mol Biol,1989,13(5):503−511.
[22]Hillmer S,Gilroy S.Visualizing enzyme secretion from individual barley (Hordeum vulgare) aleurone protoplasts.Plant Physiol,1993,102(1):279−286.
[23]Jefferson RA,Bevan M,Kavanagh T.The use of the Escherichia coli beta-glucuronidase as a gene fusion marker for studies of gene expression in higher plants.Biochem Soc Trans,1987,15(1):17−18.
[24]Luehrsen KR,de Wet JR,Walbot V.Transient expression analysis in plants using firefly luciferase reporter gene.Methods Enzymol,1992,216:397−414.
[25]Chiu WL,Niwa Y,Zeng W,et al.Engineered GFP as a vital reporter in plants.Curr Biol,1996,6(3):325−330.
[26]Yoo SD,Cho YH,Sheen J.Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis.Nat Protoc,2007,2(7):1565−1572.
[27]Sheen J.Metabolic repression of transcription in higher-plants.Plant Cell,1990,2(10):1027−1038.
[28]Melchiorre M,Robert G,Trippi V,et al.Superoxide dismutase and glutathione reductase overexpression in wheat protoplast:photooxidative stress tolerance and changes in cellular redox state.Plant Growth Regul,2009,57(1):57−68.
[29]Nishimura N,Tanabe S,He DY,et al.Recognition of N-acetylchitooligosaccharide elicitor by rice protoplasts.Plant Physiol Bioch,2001,39(12):1105−1110.
[30]Bart R,Chern M,Park CJ,et al.A novel system for gene silencing using siRNAs in rice leaf and stem-derived protoplasts.Plant Methods,2006,2.
[31]Zhang Y,Su JB,Duan S,et al.A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplastrelated processes.Plant Methods,2011,7.
[32]Prasad VV,Naik GR.Plant protoplast isolation - a practical approach.Biochem Educ,2000,28(1):39−40.
[33]Lung SC,Yanagisawa M,Chuong SD.Protoplast isolation and transient gene expression in the single-cell C4 species,Bienertia sinuspersici.Plant Cell Rep,2011,30(4):473−484.
[34]Wu FH,Shen SC,Lee LY,et al.Tape-Arabidopsis Sandwich-a simpler Arabidopsis protoplast isolation method.Plant Methods,2009,5:16.
[35]Miller PD.Maize protoplast-based transient assay system for analysis of gene functionality and controlling sequences.In Vitro Cell Dev-An,2012,48:24−24.
[36]Chen SB,Tao LZ,Zeng LR,et al.A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice.Mol Plant Pathol,2006,7(5):417−427.
[37]Edwards GE,Lee SS,Chen TM,et al.Carboxylation reactions and photosynthesis of carbon compounds in isolated mesophyll and bundle sheath cells of Digitaria sanguinalis (L.)Scop.Biochem Biophys Res Commun,1970,39(3):389−395.
[38]Podibelkowska M,Zarska-Maciejewska B,Kacperska-Palacz A.Morphology of protoplast as affected by an inhibition of respiration.Protoplasma,1975,83(3):201−208.
[39]Conde P,Santos C.An efficient protocol for Ulmus minor Mill.protoplast isolation and culture in agarose droplets.Plant Cell Tiss Org,2006,86(3):359−366.
[40]Umate P,Rao KV,Kiranmayee K,et al.Plant regeneration of mulberry (Morus indica) from mesophyll-derived protoplasts.Plant Cell Tiss Org,2005,82(3):289−293.
[41]Assani A,Haicour R,Wenzel G,et al.Influence of donor material and genotype on protoplast regeneration in banana and plantain cultivars (Musa spp.).Plant Sci,2002,162(3):355−362.
[42]Masson J,Paszkowski J.The culture response of Arabidopsis thaliana protoplasts is determined by the growth conditions of donor plants.Plant J,1992,2:829−833.
[43]Takai R,Kaneda T,Isogai A,et al.A new method of defense response analysis using a transient expression system in rice protoplasts.Biosci Biotech Bioch,2007,71(2):590−593.
[44]Zhang Y,Su J,Duan S,et al.A highly efficient rice green tissue protoplast system for transient gene expression and studying light/chloroplast-related processes.Plant Methods,2011,7(1):30.

