引起新生儿坏死性小肠结肠炎相关因素的分析
吕爱君 林泽军
(汕头市潮阳区人民医院儿科,广东 汕头 515100)
引起新生儿坏死性小肠结肠炎相关因素的分析
吕爱君 林泽军
(汕头市潮阳区人民医院儿科,广东 汕头 515100)
目的 探讨新生儿坏死性小肠结肠炎(NEC)的相关危险因素。方法 将 75 例患儿按出生胎龄分为足月儿和早产儿组,回顾性分析研究两组患儿的围产期因素及危险因素。结果 两组患儿的发病与母亲围产期相关因素以宫内窘迫、胎膜早破、多胎妊娠发生率较高。新生儿以在产儿、低出生体质量儿、窒息缺氧、感染、喂养不当均为 NEC 的危险因素。结论 重视围产期保健,减少早产儿发生率,防止窒息及控制感染,合理喂养是预防 NEC 的关键;对可疑 NEC 或确诊 NEC 时,要密切观察病情,定期监测实验室指标,监控疾病的发展,对有可能出现的并发症积极干预,必要时予外科手术治疗,出院后定期随访。
不同胎龄;新生儿;坏死性小肠结肠炎;相关因素
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是最常见的新生儿急腹症,也是新生儿败血症和肠穿孔的主要原因。其发病机制十分复杂,现认为多与肠道的屏障功能不足与全身免疫功能低下有关。临床上以腹胀、便血、呕吐及腹泻为主要临床表现。近年来随着新生儿重症监护室(NICU)的发展和临床上对NEC的重视,其发病率及病死率有所下降,但仍是新生儿尤其是早产儿早期死亡的主要原因,国内本病的病死率为10%~50%[1]。现将我院2011年1~12月收治的75例NEC患儿病史资料进行分析,探讨NEC的主要危险因素。
1 资料与方法
1.1 一般资料
2011年1月~12月我院收治的NEC患儿75例,所有患儿均符合《实用新生儿学》NEC的诊断标准[2]。男52例,女23例,男女比例为2.26:1。胎龄<34周28例(37.3%),34~37周15例(20.0%),>37周32例(42.7%),平均(34.9±3.8)周。起病时间最短1d,最长54d,平均12.5d;发病时体质量<2.5kg50例,≥2.5kg25例。发病日龄<37周(16±12.93)d,≥37周(8.25±7.25)d;两组之间的NEC患儿的发病日龄、体质量有显著性差异(P<0.05)。分娩方式剖腹产35例,顺产40例;人工喂养39例,母乳喂养15例,混合喂养8例,未开奶13例。本组发病时伴随反应差、体温不稳、代谢性酸中毒、呼吸暂停、呕吐、腹胀、腹泻、便血等临床表现以及血常规及培养、腹部X线、C反应蛋白、降钙素原、血糖、大便潜血及培养等相关检查结果的改变在足月儿与早产儿之间无显著差异(P>0.05)。
1.2 方法
回顾性统计NEC患儿性别、母亲孕期健康状况、胎龄、出生体质量、脐带异常、胎盘和羊水情况、窒息(Apgar评分)、喂养方式、并发症、治疗及转归等。分析NEC发病的高危因素,及其在早产儿于足产儿之间的比较。
1.3 统计学分析
所有数据采用SPSS13.0进行统计学分析,计数资料采用χ2检验进行统计学处理,两组患儿相关因素的比较详见表1。
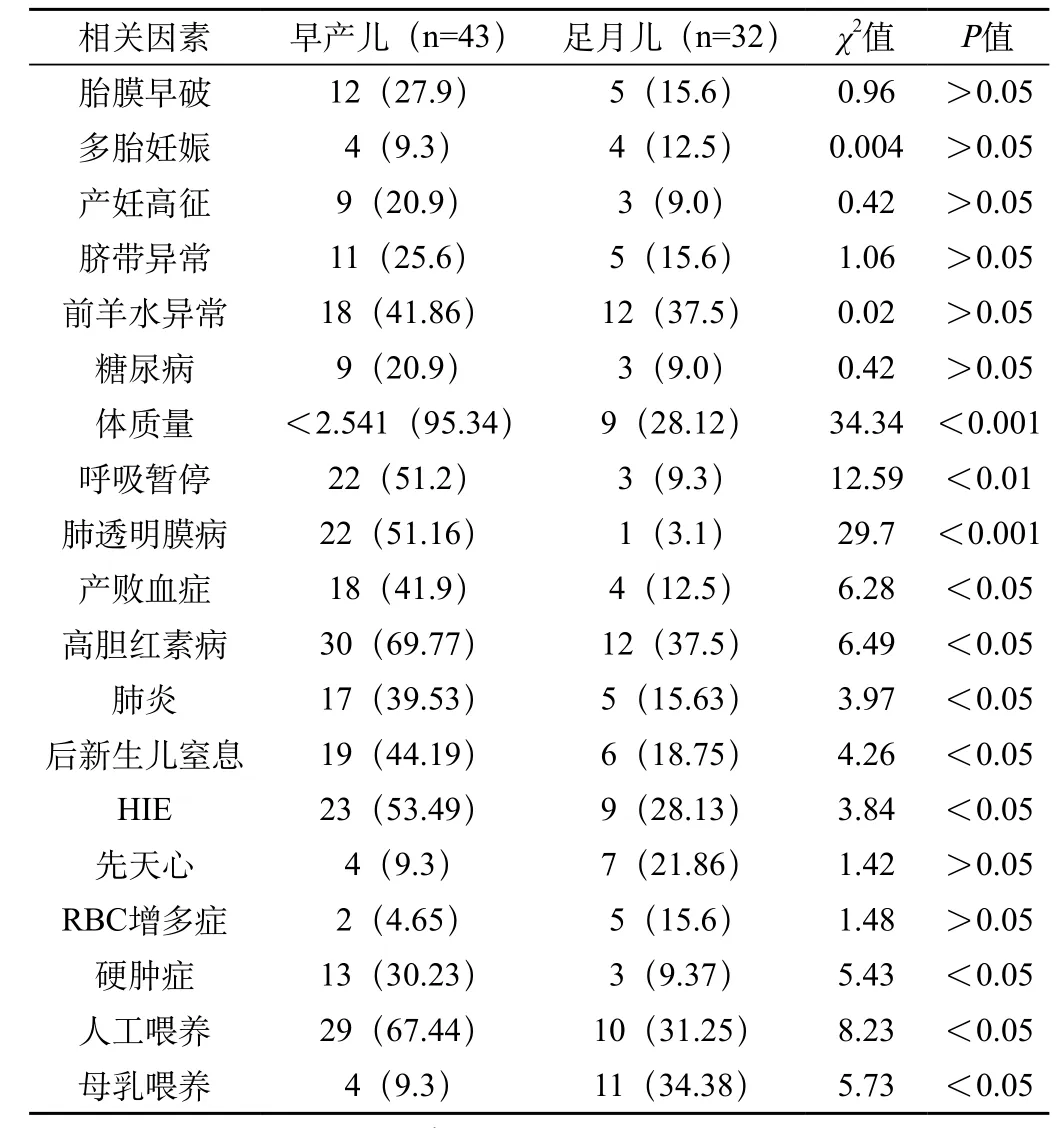
表1 早产儿与足月儿NEC相关因素的比较
2 结 果
2.1 主要危险因素的分布
本观察病例中,产前合并胎膜早破17例(22.67%)、妊高征和糖尿病各12例(32%)、脐带异常16例(21.33%)、羊水异常30例(40%)、多胎8例(10.67%),总构成比约占82.6%;而产后主要危险因素中肺透明膜病23例(30.67%)、肺炎22例(16%)、败血症22例(29.33%)、窒息25例(33.33%)、HIE32例(42.67%)、高胆红素症42例(56%)、硬肿症16例(21.33%)、人工喂养39例(52%)、呼吸暂停25例(33.33%)、先天性心脏病11例(14.67%)、RBC增多症7例(9.3%),总构成比约占95.2%。
2.2 治疗与转归
所有病例均予以绝对禁食;胃肠减压;保暖;补充液体和静脉营养保证热能及维持水、电解质平衡;加强支持治疗;加强护理;根据感染情况选择敏感抗生素;合并贫血予输血;合并呼吸衰竭予机械通气;发生气腹、腹膜炎及保守治疗病情继续恶化采取外科手术治疗。75例患儿治愈54例(72%)、好转7例(9.3%)、死亡(包括家长放弃治疗难免死亡病例)14例(18.67%)。
3 讨 论
新生儿坏死性小肠结肠炎(NEC)是新生儿重症监护室(NICU)的常见胃肠道急症,理论上NEC90%发生于早产儿与低体质量儿,是早产儿死亡的重要原因,但国内对此报道不一,本文是两者差不多各半。关于NEC病因目前尚不完全清楚,引起NEC的始动因素可能是围生期缺氧或感染,尤其是早产儿消化道功能发育不成熟,肠道菌群定植延迟,肠道防御功能缺乏,喂养不当引起肠道菌群过度增殖,细菌到达受损的肠上皮,诱发炎症反应,触发炎症连锁反应,引起肠道血管收缩,导致缺血和继发性灌注肠道损伤[3]。母体妊娠期的疾病状态本身就是新生儿疾病的高危因素,本资料显示产前危险因素总构成比约占82.6%,肯定了产前危险因素对新生儿NEC仍有重要影响;而且在早产儿和足月儿之间比较无显著差异(P>0.05)。而NEC产后危险因素占95.2%,虽然本组显示了在影响血液循环从而导致胃肠道微循环障碍的疾病如先天性心脏病、RBC增多症以足月儿多见;但合并有肺透明膜病、呼吸暂停、败血症、硬肿症等并发症早产儿的发生率要比足月儿明显增高;而且两者之间的比较有着显著性差异(P<0.05),从而说明了早产儿更易发生NEC。
早产儿易发生NEC可能与新生儿肠道发育不成熟、炎症介质过度表达和肠道感染等各种危险因素关系密切。①新生儿出生时的成熟度:新生儿小肠肠道表面积在妊娠期最后3个月发生显著的变化,足产儿生后完成胃肠--肛门之间的跨越蠕动时间比早产儿要早2~4倍[4];新生儿出生后,肠内很快出现细菌,由于低体质量和早产儿本身肠壁的神经细胞和肌肉发育更显不成熟,小肠蠕动规律性较差,食物发酵后容易造成细菌过度生长和产生胀气较易引起NEC;另一方面缺乏消化脂肪和酪蛋白的能力,分泌型IgA缺乏,有利于强力内毒素损伤性细菌的生长,还有胰蛋白酶分泌增多,使肠黏膜上具有保护作用的粘蛋白被胰蛋白酶分解,肠黏膜就更易受细菌和蛋白酶的损伤,造成NEC;故胎龄越小发生NEC的危险性越大。②感染也是NEC发病的重要因素;本资料中出现各种并发症早产儿比足月儿明显多发,某些致病菌产生的毒素直接损伤肠道黏膜或通过炎症介质释放引起血管收缩,加重肠道黏膜损伤[5],同时广泛使用了抗生素导致了肠道内菌群失调,病菌过度增殖也可直接损伤肠道黏膜引起NEC。③新生儿窒息、肺透明膜病、呼吸暂停、休克、低血压等导致缺氧情况下,引起机体防御性放射,肠系膜血管强烈收缩,血流重新分配,保证心,脑重要器官的血流供应,减少肠管血流量,此时肠壁血流可减少到正常的35%~50%,因而导致肠黏膜缺血损伤。此外,在应激反应时,血管运动肠多肽、肾上腺素等使肠道黏膜、黏膜下层血流减慢,毛细血管阻力增加,发生动静脉短路,也可促成肠黏膜缺血坏死,造成NEC。④喂养方式:在很多NICU无法提供母乳喂养,迫使新生儿接受人工喂养,这样就增加攻击早产儿尚未成熟的胃肠黏膜机会,特别是窒息缺氧后的早产儿胃肠黏膜,当经口、胃或肠摄入的配方奶渗透压过高(>460mOsm/L)时以及喂养高渗性药物溶液(VitE、茶碱等),大量液体由血管转入肠腔,影响肠血流灌注而损伤肠黏膜致坏死,而早产儿则在渗透压>400mOsm/L时就可直接损伤肠黏膜;这也说明了早产儿在喂养不当时更易发生NEC;同时有报道快速超量喂养可使蛋白和乳糖吸收不良,细菌发酵产生大量气体,肠腔积气,压力增加,使肠壁血流量减少导致肠黏膜发生缺血性损伤坏死导致NEC[6]。⑤新生儿红细胞压积较高,早产儿、低体质量而更易发生血液浓缩,血粘稠度增高致心排出量减少,使肠黏膜循环障碍造成黏膜损伤。
综上所述,新生儿坏死性小肠结肠炎是尚不成熟的胃肠道对多种有害因素所产生的最后相同发应。临床上应加强围生期保健,减少早产儿和低体质量儿的出生,防止窒息的发生,积极控制感染,合理喂养是预防NEC的关键。
[1]余成 .新 生 儿 坏 死 性 小 肠 炎22 例 误 诊 分 析 [J].海 南 医 学,2012, 21(4):128-130.
[2]金汉珍,黄 德 珉,官希吉.实用新生儿[M].3版.北 京:人 民 卫 生出版社,2003:508-512.
[3]易小莲,张丙宏,严彩霞,等.新生儿坏死性小肠结肠炎发病机制研究进展[J].中国新生儿科杂志,2011,26(2):130-132.
[4]NeuJ,Castrointestion maturation and implications for infant feeding[J]..Early Hum Dev,2007,83(12):767-775.
[5]Fontaine C,Cevallos L,Leke A,et al.Assessmento ferythropoietin treatment in preterm newborns older than 30 weeks of gestation[J].Aech Pediatr,2009,16(4):331-336.
[6]李 德 渊,李 晋 辉 .新生 儿 坏 死 性 小 肠 结 肠 炎研 究 进 展 [J].四川医学,2007,28(5):481-483.
R725.7
:B
:1671-8194(2013)10-0161-03

