一株地衣芽孢杆菌合成纳米金的研究
杨宁,郝林
(山西农业大学 食品科学与工程学院,山西 太谷 030801)
一株地衣芽孢杆菌合成纳米金的研究
杨宁,郝林
(山西农业大学 食品科学与工程学院,山西 太谷 030801)
以山西老陈醋醋醅中分离的一株地衣芽孢杆菌菌体(Bacilluslicheniformis)作为还原剂,以氯金酸(HAuCl4)为原料,采用生物法合成纳米金粒子。研究结果显示,通过紫外可见分光光度法、X射线衍射和透射电子显微镜镜进行了表征后,分析得到合成的纳米金的紫外吸收峰值为545nm,其粒径为15(±28%)nm,其结晶呈球形,为面心立方结构。X射线衍射仪表征图谱与已报道的纳米金图谱一致。
纳米金;地衣芽孢杆菌;生物合成
食品检测分析一般采用化学分析法(CA)、薄层层析法(TLC)、气相色谱法(GC)、高效液相色谱法(HPLC)等,但前处理繁琐,样品损失大,操作要求高、仪器昂贵,不适合现场快速测定。以纳米金为标记物的免疫分析法有简单快速、灵敏度高、特异性强、样品量少等优点,适合现场检测,且金免疫层析技术正在向定量、半定量检测和多元检测方向发展,具有良好的发展前景。
传统的制备纳米金的方法主要是物理和化学方法。物理方法是指通过各种分散技术把金直接转变为纳米粒子,化学方法是指由金的化合物通过还原反应得到纳米粒子。物理和化学方法需要严格的条件,耗能高,使用的试剂昂贵,还污染环境[1]。随着绿色化学概念的普及,纳米金的合成也向无毒、环境友好的方向发展,安全、环保的生物还原法应运而生。
采用生物材料或生物体系天然合成纳米微粒是解决生态友好及可靠性问题的一种较好的方法。许多学者通过往微生物培养液的上清液或菌体浸泡液中加入一定浓度的氯金酸溶液,制备纳米金粒子。国外研究者正在不断探索和完善生物法来合成纳米材料,国内也有人开始研究,但相关成果报道较少,仅有东南大学的He S Y等成功地用红假单胞菌的上清液合成了纳米金粒子[2]。
采用前期从山西老陈醋醋醅中分离的一株地衣芽孢杆菌,合成了纳米金粒子,并用紫外可见分光光度计、透射电镜(SEM)和 X射线衍射仪(XRD)对其进行了表征,研究了合成纳米金的粒径和形貌特征。
1 材料和方法
1.1 材料
1.1.1 试剂
氯金酸(购自sigma)、牛肉膏、蛋白胨、氯化钠、琼脂、磷酸盐缓冲液(pH7.0)。
1.1.2 菌种
地衣芽孢杆菌(Bacilluslicheniformis),山西农业大学食品科学与工程学院微生物实验室从山西老陈醋醋醅中分离得到的。
1.1.3 主要仪器设备
高速电动离心机:常州市华普达教学仪器有限公司
超声波细胞破碎仪XO-900D:南京先欧仪器制造有限公司
高速冷冻离心机:维尔康湘鹰型号:TGL-22MC
紫外可见分光光度计:日本岛津 UV-visible2400系列
透射电镜:Jeol JEM-1400(山西农业大学信息科学与工程学院分析测试中心)
X射线衍射仪(XRD):德国布鲁克(D8ADVANCE)(中国科学院山西煤炭化学研究所)
1.2 方法
1.2.1 地衣芽孢杆菌的培养
将从山西老陈醋醋醅中分离得到的地衣芽孢杆菌接入牛肉膏蛋白胨斜面培养基中,37℃,培养16h。活化结束后将菌种转入牛肉膏蛋白胨液体培养基中,摇瓶培养,180r·min-1,37℃,16h。
1.2.2 地衣芽孢杆菌菌体的制备
将含有菌体的培养液离心,弃去上清液,取沉淀菌体4g。
将菌体用磷酸盐缓冲液(pH 7.0)清洗3次,洗掉菌体表面残留的发酵液中的干扰物质。取其中2g做细菌加热灭活处理,作对照。
1.2.3 纳米金的制备
将1.2.2洗净的湿菌体和对照分别放入500 mL三角瓶中,加入100mL浓度为1mM的氯金酸溶液,放入摇床中,37℃,200r·min-1,孵育24 h。
1.2.4 样品的超声波制备
将三角瓶中的溶液离心后,取沉淀菌体,用磷酸盐缓冲液(pH 7.0)清洗2次,将其置入10mL的磷酸盐缓冲液中。将制备好的样品放入超声波细胞破碎仪中进行细胞破碎。
操作方法:破碎3次,每次15s,间隔为45s。超声波破碎后的样品放入高速冷冻离心机中,4℃,15 000r·min-1离心30min。弃去细胞碎片,取上清液,备用。对照处理同上[3]。
1.2.5 纳米金的紫外吸收检测
精密量取1.2.4的试样和对照1mL于10 mL量瓶中,以双蒸水稀释至刻度,摇匀,用紫外可见分光光度计在300~800nm内进行紫外扫描,检测是否有合成纳米金。
1.2.6 透射电镜观察[4]
将1.2.4制备的溶液,滴到敷有Formva膜的400目铜网上,空气中干燥后,置透射电子显微镜(TEM)下观察其大小和形状。
1.2.7 X射线衍射表征
将1.2.4制备的纳米金溶液离心,取沉淀。用双蒸水洗掉残余的细胞物质,离心取沉淀,反复3次。将纯化的沉淀分散于双蒸水中,真空冷冻干燥。纯化并干燥后的纳米金用X射线衍射仪(XRD)进行表征。衍射源为铜靶(Cu,Kα=1.540 56A)。电压40kV,电流300mA,扫描速度为每分钟5。
2 结果与分析
2.1 溶液颜色的变化
氯金酸溶液中加入地衣芽孢杆菌的活细胞后,溶液颜色变为红色。加入灭活的地衣芽孢杆菌后共同孵育24h,颜色始终未变。氯金酸溶液37℃放置24h,溶液颜色无变化。初步判定,在地衣芽孢杆菌活细胞的作用下,氯金酸溶液中的金离子被还原为纳米金粒子。
2.2 紫外可见分光光度计检测结果
由图1可见,氯金酸溶液中加入地衣芽孢杆菌的活细胞后,溶液在545nm处有吸收峰。文献表明[5,6],据粒径不同,纳米金可选择性地吸收和散射部分波长的光,其中以吸收为主,散射只占很小一部分。吸收的这部分光主要位于绿色光区域,波长范围在520nm左右。据补色原理,纳米金溶液因吸收绿色光,而呈红色。所以,根据颜色变化结合紫外可见吸收光谱图,证明在地衣芽孢杆菌活细胞的作用下,合成了纳米金粒子。对照进行紫外检测没有出现吸收峰,说明灭活的地衣芽孢杆菌不能把将[AuCl4]-还原为单质Au。

图1 纳米金的紫外可见吸收光谱图Fig.1 UV-vis spectra of the gold nanoparticles
2.3 透射电镜(TEM)表征
采用透射电镜(TEM)表征合成的纳米金溶液。如图2所示,所有合成的纳米金粒子为近似球形,大小较均一。合成的纳米金粒子的粒径为15 nm(±28%)。
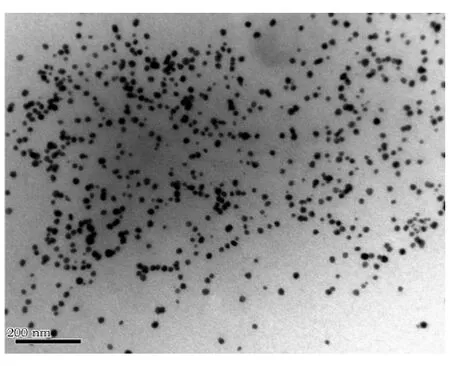
图2 合成纳米金的TEM照片Fig.2 TEM images of the gold nanoparticles
2.4 纳米金的XRD表征
表征得到的纳米金的X射线衍射(XRD)图谱结果见图3。与JCPDS标准卡对照一致,可以看出,2θ在38.3°、44.4°、64.76°、77.68°和81.9°处,出现的5个衍射峰均为金的特征衍射峰,分别与面心立方(FCC)结构 Au(111)、(200)、(220)、(311)和(222)晶面相对应,由此确定产物为单质金。经比较X射线衍射图谱与文献[7]的研究一致。

图3 纳米金的X-射线图谱Fig.3 XRD pattern of gold nanoparticles
图中出现5个明显的峰值,是因受到电子入射束辐照的样品区域内存在大量取向复杂的细小晶体颗粒,属于多晶结构。已研究出来的纳米金大多数呈多晶结构,也有少数单晶结构。
2.5 纳米金制备的机理
目前,已有大量关于生物法合成纳米金粒子的报道,但其反应机理还没有定论。现有资料多为一些推测性的研究成果,其中,对机理的推测不尽相同。多数学者认为NADH及其所依赖的还原酶在金离子的还原反应中起重要作用。NADH广泛存在于微生物的活细胞内,是氧化还原反应电子传递系统中的重要物质。微生物产生并分泌出还原酶,该酶直接参与纳米金粒子的合成过程。NADH为电子供体,还原酶为电子载体,金离子得到电子被还原为金属态金[8~10]。
参与地衣芽孢杆菌合成纳米粒子过程的酶可能为存在于该菌体内的还原酶,将金离子还原为金属态的金。NADH及NADH所依赖的还原酶是合成过程的重要因素。地衣芽孢杆菌可以分泌辅因子NADH及NADH所依赖的酶,尤其是还原酶。这些辅因子在金离子还原成金属态金粒子形成的过程中起重要作用。
3 结论与讨论
研究表明,采用山西老陈醋醋醅中分离得到的地衣芽孢杆菌的活菌体可有效地合成纳米金粒子。经紫外可见分光光度法和TEM表征合成的纳米金的粒径为15nm(±28%),形态为近似球形。XRD表征图谱与已报道的纳米金图谱一致。
目前,纳米技术已与众多学科交叉,渗透到食品领域,引起食品加工的巨大变革,给食品工业的发展带来了新机遇。纳米技术在食品领域的研究和应用主要包括纳米食品加工、纳米包装材料、纳米机械和纳米检测技术等方面。采用生物法合成纳米材料更安全,拓展纳米材料在食品行业的应用很必要。
[1]Castro-longoria E,Alfredo R Vilchis-nestor,Avalos-borja M.Biosynthesis of silver,gold and bimetallic nanoparticles using the filamentous fungus Neurospora crassa[J].Colloids and Surfaces B:Biointerfaces,2011,8(31):42-48.
[2]He S Y,Guo Z R,Zhang Y,et al.Biosynthesis of gold nanoparticles using the bacteria Rhodopseudomonas capsulata[J].Materials Letters,2007,61(18):3984-3987.
[3]K.Kalimuthu,R.Suresh Babu,D.Venkataraman,et al.Biosynthesis of silver nanocrystals byBacilluslicheniformis[J].Colloids and Surfaces B Biointerfaces,2008,25(65):150-153.
[4]马守栋,李明春,叶勇,等.纳米银的制备与表征[J].中国药学杂志,2011,46(13):1007-1010.
[5]Van De Hulst H C.Light scattering by small particles[M].New York:John Wiley &Sons,Dover Publications,1957:243-249.
[6]Enüstün B V,Turkevich J.Coagulation of colloidal gold[J].J Am Chem Soc,1963,85(21):3317-3328.
[7]Zhonghao Li,Alwin F,Andreas T.Gold microcrystal synthesis via reduction of HAuCl4by cellulose in the ionic liquid 1-butyl-3-methyl imidazolium chloride[J].J Mater Chem,2008,18(9):1008-1014.
[8]Husseiny M I,El-aziz.Biosynthesis of gold nanoparticles using Pseudomonas aeruginosa[J].Spectrochimica acta part A,2007,67(3-4):1003-1006.
[9]He S,Guo Z,Zhang Y et al.Biosynthesis of gold nanoparticles using the bacteria rhodopseudomonas capsulata[J].Materials Letters,2007,61(18):3984-3987.
[10]Gericke M A.Biosynthesis of metal nanoparticles[J].Hydrometallurgy,2006,83(1-4):132-140.
Biosynthesis of Gold Nanoparticles UsingBacilluslicheniformis
Yang Ning,Hao Lin
(CollegeofFoodScienceandEngineering,ShanxiAgriculturalUniversity,TaiguShanxi030801,China)
The bacteriumBacilluslicheniformiswas isolated from the fermentative crude grains of Shanxi mature vinegar and was used as the reducing agent,HAuCl4as raw material,to synthesize the gold nanoparticles.The characteristics of synthesized gold nanoparticles were analyzed with UV-vis spectroscopy,scanning electron microscopy(SEM)and X-ray diffraction(XRD).The absorbance peak of nanoparticles was observed at 545nm in UV-vis spectroscopy and the grain diameters were 15(±28%)nm.The shape of gold nanoparticles was spherical and face centered cubic structure(FCC).The X-ray diffraction(XRD)patterns displayed in this study were consistent with earlier reports.
Gold nanoparticles;Bacilluslicheniformis;Biosynthesis
S38
A
1671-8151(2013)03-0214-04
2013-02-22
2013-03-10
杨宁(1980-),女(汉),山西太谷人,讲师,在读博士,研究方向:生物工程。
郝林,教授,博士生导师。Tel: 18234465516;E-mail:haolinsxnd@126.com
山西省自然科学基金(2011011032-1)

