番茄早疫病生防放线菌WL07的诱变选育
王艳红, 吴志军, 李丽阳, 于立权, 葛文中
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
由茄链格孢菌[Alternariasolani(Ellis et Martin)Sorauer]引起的番茄早疫病是危害番茄产量的严重病害[1-2],生产上主要以化学药剂进行防治,但易造成环境污染及食品安全等问题[3-4],因此,探索防治番茄早疫病的新方法或新途径已迫在眉睫。近年来,放线菌作为生物活性物质的重要来源已受到广大学者的关注[5]。生防放线菌WL07是本实验室筛选到的对番茄早疫病有较好拮抗效果的优良菌株[6-7],为进一步提高该菌的抑菌活性,采用自然选育、紫外线和硫酸二乙酯诱变对WL07菌株进行改良,为今后番茄早疫病的生物防治及该菌株的工业化开发奠定基础。
1 材料与方法
1.1 供试菌株与培养基
1.1.1 供试菌株
放线菌WL07及番茄早疫病菌(Alternariasolani)均为本实验室保存菌种。
1.1.2 培养基
高氏一号合成培养基和马铃薯葡萄糖琼脂培养基(PDA)。摇瓶 培 养 基:蔗 糖 28.1g/L,酵 母 膏2.0g/L,(NH4)2SO410.0g/L,CaCO31.0g/L,Fe-SO40.1g/L,pH7.2(灭菌前),0.1MPa灭菌20min,备用。
1.2 方法
1.2.1 菌株的自然选育
菌株WL07的自然选育及采用平板计数法对菌体浓度进行测定均参照文献[8]进行。
1.2.2 筛选方法
将编号转接的试管,挑取一耳环接入发酵培养基中进行复筛,以番茄早疫病菌为检定菌,采用管碟法[9]进行抑菌活性的测定,十字交叉法测量抑菌圈直径的大小,选择抑菌圈直径较大的菌株保存,备用。
1.2.3 紫外线诱变
经自然选育获得的菌株制成孢子悬浮液,将其置于9cm的无菌培养皿中,因存在光复活作用[10],故在红光下,以钝化光复活酶,采用事先预热的功率为15W,波长260nm的紫外灯在约30cm处开皿照射30、60、90、120s。诱变结束后,分别吸取50μL处理的样品用三角涂布棒涂匀于事先倒好的平板中,纱布包好培养皿,倒置于28℃恒温培养箱中培养至菌落长出,分别测定致死率及正变率,确定最佳诱变时间。致死率及正变率公式如下:

1.2.4 硫酸二乙酯(DES)诱变
经紫外诱变获得的菌株制成孢子悬浮液,吸取50μL的样品用三角涂布棒涂匀于事先倒好的DES浓度为0.5%、1%和2%的平板中,以不含DES的为对照,28℃恒温培养箱中培养至菌落长出,分别测定致死率及正变率。
1.2.5 突变株的筛选
将经硫酸二乙酯(DES)诱变长出的菌落挑选出100个单孢菌株,分别接种于斜面培养基上,放入28℃恒温培养箱内培养5d,然后对突变株进行摇瓶发酵,生物测定,并编号,确定高产的突变株,保存。
1.2.6 突变株的传代培养与稳定性
将筛选出的突变菌株分别转接于斜面培养基上传代5代,对每一代菌株摇瓶发酵,进行生物测定,重复3次,观察突变株的稳定性,最后确定高产稳产的突变株。
2 结果与分析
2.1 菌株的自然选育
产生菌经自然选育,菌落形态大部分为馒头形,如图1所示,挑取单个菌落100个,分别转接在高氏一号斜面培养基上,28℃恒温培养5d,然后对每个菌株进行生物测定,筛选出6株活性较高的菌株,编号 为S.tz-a、S.tz-b、S.tz-c、S.tz-d、S.tz-e、S.tz-f,抗菌效能均比出发菌株高(以抑菌圈直径表示),出发菌株抑菌圈直径为16.1mm(3次重复的平均值),因此将这6株菌株作为紫外线诱变的出发菌株,以期获得生物效价更高的菌株。

图1 自然选育的菌落形态Fig.1 Colonial morphology of natural breeding
2.2 紫外线诱变
自然选育的6株菌株,经紫外线处理后,除了出现与自然选育相同的菌落形态外,还出现5种不同的菌落形态,如图2所示。各菌株的孢子致死率及正变率大致呈相同趋势,结果如表1所示,趋势曲线如图3所示。

表1 紫外线诱变结果1)Table 1 The results of UV mutagenesis

图2 紫外诱变后的菌落形态Fig.2 Colonial morphology after UV mutagenesis

图3 不同紫外线照射时间下致死率与正突变率的关系Fig.3 The relationships between lethality and positive mutation rate under different mutation time
从表1可以看出,紫外线照射30s时,致死率约15%,菌落形态特征基本与自然选育后的相似,无特殊菌落形态出现;照射60s时,致死率约75%,正变率约22%;照射90s时,致死率约93%,正变率约39%;照射120s时孢子的致死率在99%左右,但正变率较低,不到5%,因此综合考虑,确定最佳诱变剂量为90s。分别将这6种形态的菌落进行转接培养,摇瓶发酵,生物测定。结果表明,紫外线诱变后,高效价的菌株仍然是馒头形,但其出现频率不高,多以褶皱形、草帽形为主,但考虑到馒头型菌落生长速率快,产孢能力强等因素,在选育良种时选取此种类型菌落。经摇瓶发酵,生物测定,又挑选出6株活性较强的菌株,编号S.tz-A、S.tz-B、S.tz-C、S.tz-D、S.tz-E、S.tz-F,用来作为硫酸二乙酯诱变的菌株。
2.3 硫酸二乙酯(DES)诱变
菌种选育中,物理诱变和化学诱变可以综合使用[11]。一般认为,单因子诱变处理效果不及复合诱变处理[12]。经紫外诱变筛选的6株菌S.tz-A、S.tz-B、S.tz-C、S.tz-D、S.tz-E、S.tz-F 分 别 制 成孢子悬浮液,吸取50μL的样品用三角涂布棒涂匀于事先倒好的DES浓度为0.5%、1%和2%的平板中,以不含DES的为对照,28℃恒温培养箱中培养至菌落长出,分别测定致死率及正变率,结果如表2所示,在0.5%DES浓度下,致死率在22%~25%之间,正变率在10%以下,较低;在1%DES浓度下,6株菌S.tz-A、S.tz-B、S.tz-C、S.tz-D、S.tz-E、S.tz-F的致死率在70%~75%之间,正变率在37%左右;在2%DES浓度下,致死率虽然明显提高至90%以上,但致死率高不一定效果好[13],正变率下降约50%左右,出现负效应较明显,因此,选择1%DES浓度下抑菌圈直径大于26mm的菌株作为备用菌株,将其编号S.tz-10、S.tz-22、S.tz-36、S.tz-45。
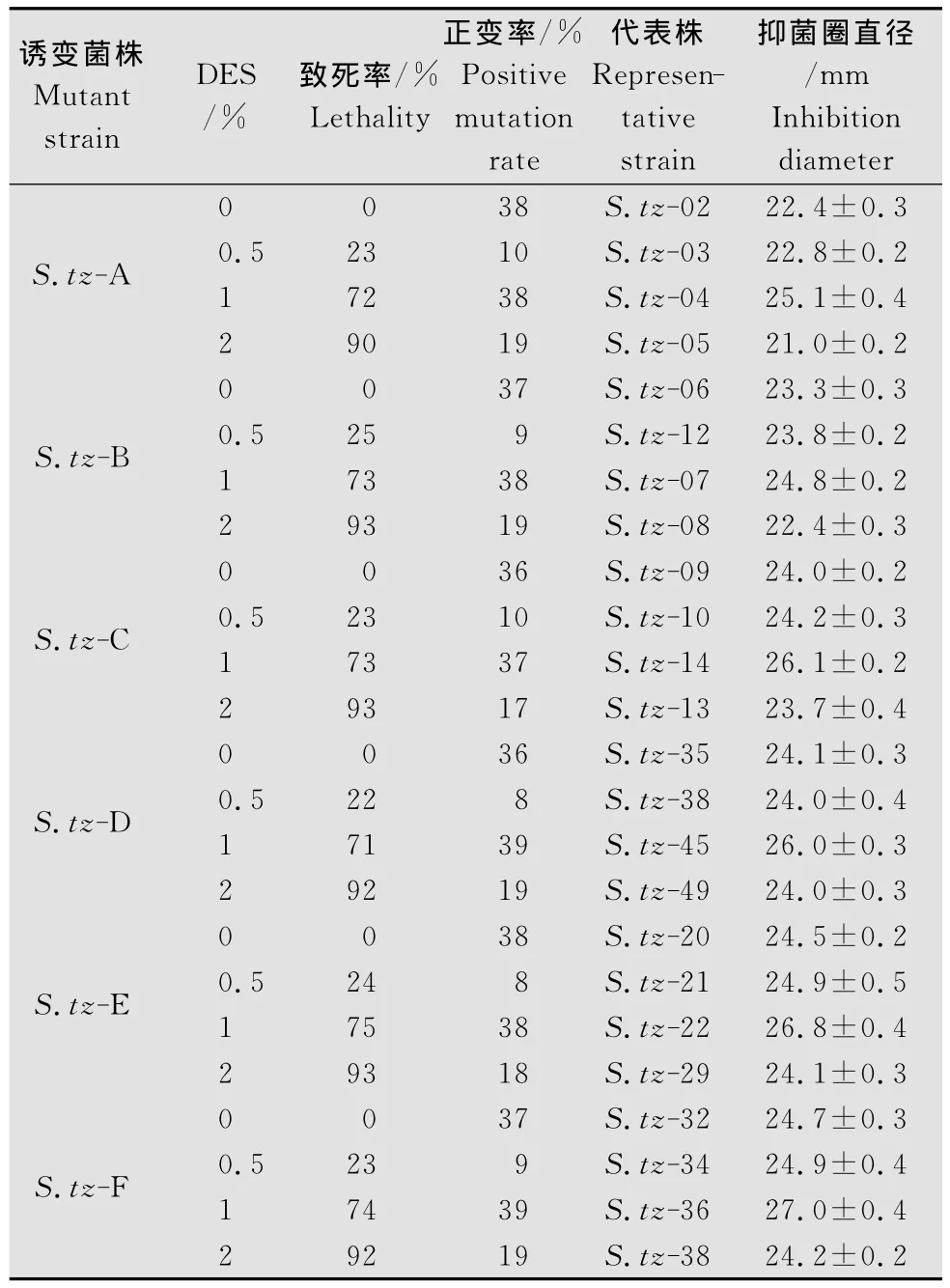
表2 不同浓度硫酸二乙酯(DES)诱变结果Table 2 The mutagenesis results of different DES concentrations
2.4 传代稳定性
经过诱变后的菌株,生物活性高的不一定是高产稳产 的[14]。菌 株S.tz-10、S.tz-22、S.tz-36、S.tz-45是经过紫外诱变和硫酸二乙酯诱变的,将这4株菌进行传代培养5代,摇瓶发酵后生物测定稳定性,以抑菌圈直径大小表示,结果见表3,发现诱变后抑菌圈直径最大的菌株S.tz-36在连续培养5代后其抑菌活性降低,而效价第二高的菌株S.tz-22在连续培养5代后其稳定性较好,基本保持不变,抑菌圈直径为26.8mm,是出发菌株的1.66倍,所以选择菌株S.tz-22作为本试验的高产稳产菌株,用以保存备用。
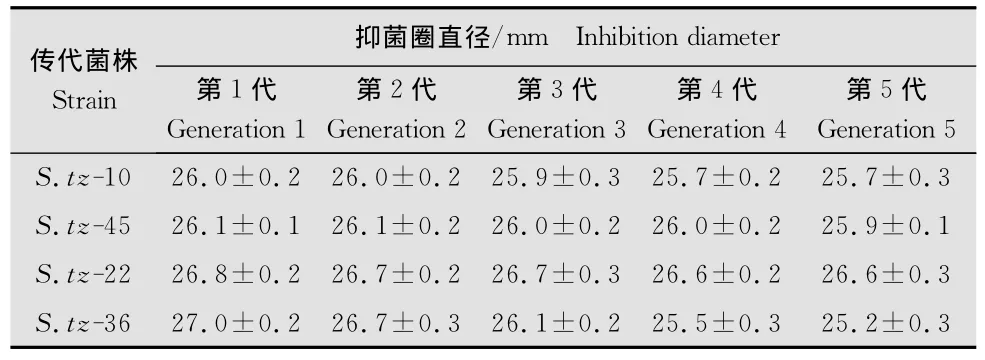
表3 稳定性结果1)Table 3 The results of stability
3 结论与讨论
放线菌是一类与人们生产和生活关系极为密切的微生物,目前从微生物中发现的大约8 000多种生物活性物质中,近70%是由放线菌产生的,具有巨大经济价值及重要医学意义,如抗肿瘤的博莱霉素、丝裂霉素,抗结核的卡那霉素。放线菌产生的次级代谢产物因其具有无污染、不易产生抗药性等特点而制备的微生物农药,已成为新农药研发的主体及未来农药的发展趋势[15-16],如有效防治水稻纹枯病的井冈霉素。因此,生物农药备受人们的关注,生防菌剂的开发业已成为研究的热点。
目前,防治番茄早疫病这种世界性病害的有效药剂为二甲酰亚胺类杀菌剂异菌脲,具有保护和一定的治疗作用,但长期使用该药剂产生抗药性[17]。生物防治上,国内外已报道了一些细菌、放线菌对番茄早疫病的拮抗、抑制及防治等作用。国内研究者周防震和彭振坤[18]筛选到酵母菌;高芬等[19]筛选出拮抗细菌;李永丽[20]、任璐等[21]筛选到内生细菌;杨冬静等[22]筛选到枯草芽胞杆菌(Bacillus subtilis)NJ_18菌株,均对番茄早疫病有拮抗作用。而国外研究者并没有专门以番茄早疫病菌为防治对象进行拮抗微生物的筛选研究,主要将拮抗菌引入果实表面防治采后病害,获得了一些有较好防效的拮抗菌株。在本研究中,主要以对番茄早疫病菌具有拮抗作用的生防放线菌WL07为研究对象,采用自然选育、紫外线和硫酸二乙酯诱变进行菌种选育,提高了诱变率,达到了成功选育高产菌株的目的,结果表明S.tz-22抑菌圈直径为26.8mm,是出发菌株的1.66倍,该菌株具有较好开发前景。
综上所述,应用诱变育种技术,对微生物菌株进行菌种选育,得到目的菌株S.tz-22,但该菌株距离工业化水平还有一定的差距,因此在后续研究中,可以尝试运用激光、生物诱变剂等新的诱变因子,或者在技术选择上应用基因工程手段对其进行育种。筛选的方法上,建立可靠的模型,理性筛选,提高筛出率,加快菌株的育种进程,以期为其工业化应用奠定基础。有关该菌株抗菌活性成分的结构、作用机制及后期的制剂工艺等方面还有待进一步研究。
[1]Noor K,Aradhana M,Chandra S N.PaenibacilluslentimorbusB-30488controls early blight disease in tomato by inducing host resistance associated gene expression and inhibitingAlternariasolani[J].Biological Control,2012,62(2):65-74.
[2]任璐,刘慧平,韩巨才.番茄早疫病菌Hog1MAPK同源基因AsHog1的表达特性及其与抗药性的关联性[J].菌物学报,2010,29(4):542-547.
[3]马桂珍,王淑芳,暴增海,等.海洋细菌L1-9菌株对小麦的促生防病作用研究[J].中国生物防治学报,2011,27(2):228-232.
[4]Ajinath S D,Radha P,Sunil C D,et al.Evaluating novel microbe amended composts as biocontrol agents in tomato[J].Crop Protection,2011,30(4):436-442.
[5]SubramaniaMG,Suresh P,Mamta S,et al.Evaluation of actinomycete isolates obtained fromherbal vermicompost for the biological control ofFusariumwilt of chickpea[J].Crop Protection,2011,30(8):1070-1078.
[6]王艳红,曹宁,于海威,等.拮抗番茄早疫病原菌的放线菌WL07发酵产物理化性质研究[J].黑龙江八一农垦大学学报,2008,20(3):1-4.
[7]王艳红,吴志军,葛文中.响应面法优化番茄早疫病拮抗菌WL07发酵条件[J].黑龙江八一农垦大学学报,2011,23(6):36-40,43.
[8]沈萍,范秀荣,李广武.微生物学实验[M].北京:高等教育出版社,2005.
[9]方中达.植病研究法[M].北京:中国农业出版社,1998.
[10]Shailendra P S,Donat-P H,Rajeshwar P S.Cyanobacteria and ultraviolet radiation(UVR)stress:Mitigation strategies[J].Ageing Research Reviews,2010,9(2):79-90.
[11]Antonieta T,Margaret V,Juan G,et al.Chemical screening:A simple approach to visualizing Streptomyces diversity for drug discovery and further research[J].Research in Microbiology,2006,157(3):191-197.
[12]钟娟,周金燕,谭红.抗真菌多肽—捷安肽素高产菌的选育[J].应用与环境生物学报,2004,10(1):104-107.
[13]朱昌雄,李永慧,谢德龄.中生菌素高产菌株的选育[J].中国生物防治,1996,12(1):15-19.
[14]陈希杨,朱湘成,杨冬,等.培养条件优化和菌种选育提高雷帕霉素发酵水平[J].化学工程,2011,39(1):81-84.
[15]曾庆飞,黄惠琴,朱军,等.根结线虫拮抗放线菌的筛选及菌株HALO002的鉴定与活性物质分析[J].植物保护,2011,37(6):159-163.
[16]周启,王道本.农用抗生素和微生物杀虫剂[M].北京:农业出版社,1995.
[17]任璐,韩巨才,刘慧平.番茄早疫病菌对异菌脲的敏感基线及其抗性突变体的生物学特性[J].农药学学报,2010,12(2):155-160.
[18]周防震,彭振坤.番茄早疫病拮抗菌酵母的筛选[J].湖北民族学院学报(自然科学版),2003,21(4):1-4.
[19]高芬,马利平,乔雄梧,对番茄早疫病拮抗菌的筛选[J].山西农业科学,2001,29(3):64-66.
[20]李永丽,周洲,李凡,等.番茄早疫病拮抗内生细菌的分离及防病作用[J].北方园艺,2011(1):35-36.
[21]任璐,韩巨才,刘慧平,等.植物内生细菌yc8对番茄早疫病菌抑菌作用研究[J].山西农业大学学报(自然科学版),2008,28(1):34-36.
[22]杨冬静,王建新,周明国.BacillussubtilisNJ_18菌株对番茄早疫病菌的拮抗作用研究[J].微生物学通报,2009,36(8):1166-1169.

