皮肤瘢痕癌中CDK4、CDK6蛋白的表达及意义*
林宇静,郭瑞珍
(1.遵义医学院珠海校区病理教研室,2.中山大学附属第五医院病理科;广东珠海 519041)
皮肤瘢痕癌,是皮肤病理性瘢痕被覆上皮发生癌变而形成的一种恶性肿瘤,组织学类型多为鳞状细胞癌。针对肿瘤是一类细胞周期性疾病[1],在细胞周期调控网络中CDKs蛋白激酶处于中心地位,在G1期和G1/S期转化期,CDK4和CDK6是主要的细胞周期调控子的理论。针对目前国内对瘢痕癌的相关性研究较少,以及目前这两种细胞因子在瘢痕癌中的表达情况及其与瘢痕癌发生发展的相关性未见有报道的现状。我们采用免疫组化法检测正常皮肤表皮、皮肤病理性瘢痕被覆上皮和瘢痕癌组织中CDK4、CDK6蛋白,探讨两种蛋白与瘢痕癌发生、发展的相关性。
1 材料与方法
1.1 材料
1.1.1 标本来源 标本取自遵义医学院病理教研室和中山大学附属第五医院病理科2005~2011年石蜡包埋的标本,经病理检查证实为瘢痕癌、皮肤病理性瘢痕和正常皮肤组织3组,每组15例。
1.1.2 试剂 CDK4、CDK6单克隆抗体及SP试剂盒购自武汉博士德公司。
1.2 方法 采用免疫组织化学(S-P)法 。主要步骤参照说明书进行,DAB显色。
1.3 结果判定 CDK4、CDK6阳性表达信号呈棕黄色,颗粒状,阳性信号位于细胞核及细胞质,以细胞质为主。采用半定量积分法判断结果,按照阳性细胞所占百分比与着色强度进行评分:①根据阳性细胞所占百分比评分:阳性细胞数≤5% 为0分,6% ~25%为1分,26% ~50% 为2分,51% ~75% 为3分,>75%则为4分。②根据着色强度进行评分:无显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。取①②项评分的乘积作为染色结果的评判标准:0分为阴性(一),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++)表达。用图像分析系统检测阳性染色的表达水平(阳性面积)和表达强度(光密度)。
1.4 统计分析 统计采用SPSS 13.0for windows统计软件,数据以均数±标准差(s)表示,两两比较采用最小显著差异法(LSD),相关性分析采用Pearson相关分析。α=0.05为检验水准,P﹤0.05为差异有统计学意义。对结果进行Kruskal-Wallis检验和相关分析,以P﹤0.01为有统计学意义。
2 结果
2.1 CDK4蛋白在各组中的表达 CDK4蛋白在皮肤瘢痕癌组中呈强阳性表达,在皮肤病理性瘢痕组中呈弱阳性表达,在正常皮肤组中呈阴性或弱阳性表达,瘢痕癌组与正常皮肤组及皮肤病理性瘢痕组比较有显著性差异(P<0.01)(见图1,表1)。
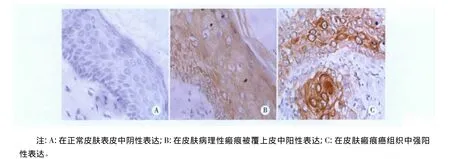
图1 CDK4蛋白在不同皮肤组织中的表达(IHC×400)
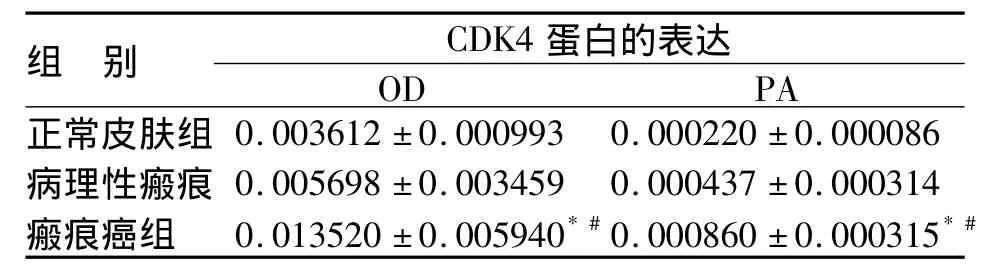
表1 CDK4蛋白在各组的表达(n=15)
2.2 CDK6蛋白在各组中的表达 CDK6蛋白在皮肤瘢痕癌组中呈强阳性表达,在皮肤病理性瘢痕组中呈弱阳性表达,在正常皮肤组中呈阴性或弱阳性表达,瘢痕癌组与正常皮肤组及皮肤瘢痕组比较有显著性差异(P<0.01)(见图2,表2)。
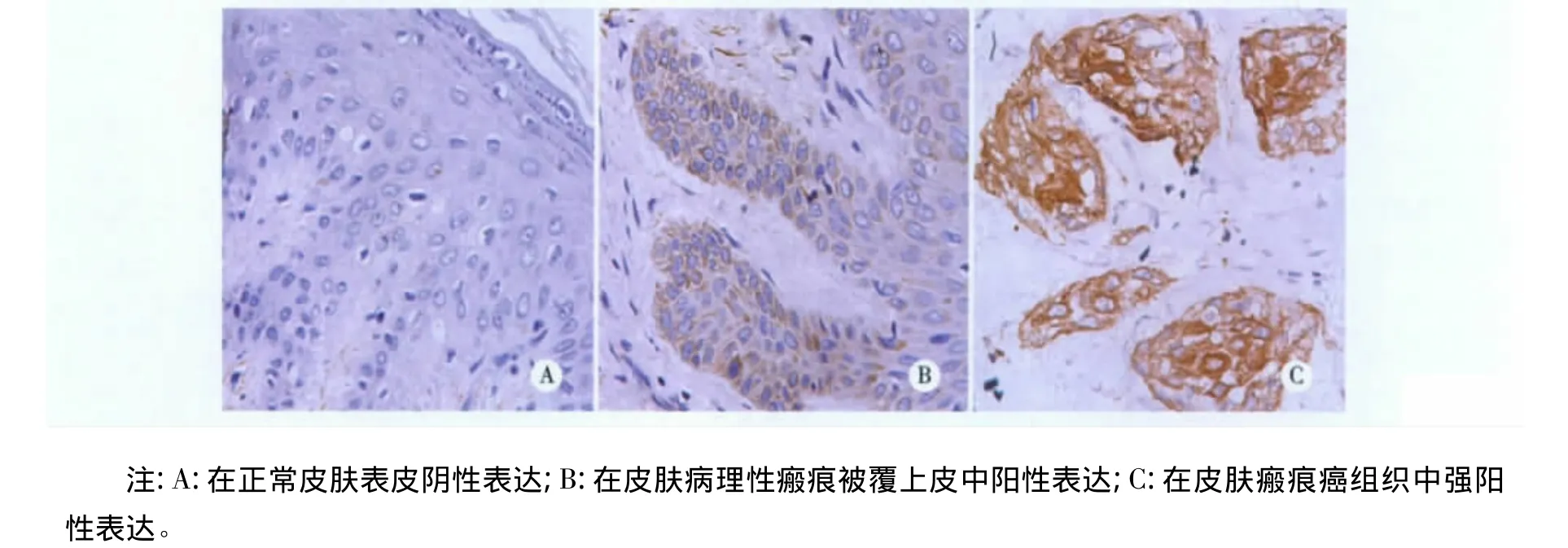
图2 CDK6蛋白在不同皮肤组织中的表达(IHC×400)
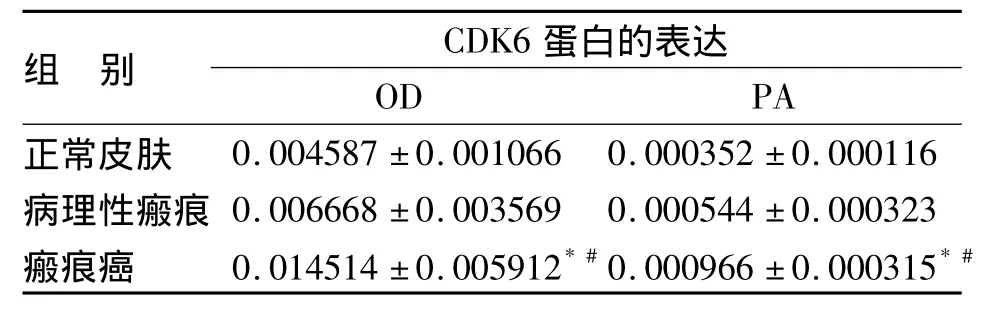
表2 CDK6蛋白在各组的表达(n=15)
3 讨论
肿瘤是在环境因素和遗传因素共同作用下,引起多种癌基因和抑癌基因的失衡,最终细胞周期发生紊乱、细胞失控性生长所致的一类疾病,因此认为肿瘤是一类细胞周期性疾病。细胞周期中有一个G1-S期检查点,这一检查点是由Rb-E2F途径所介导的,并受到依赖cyclinD1的CDK4、CDK6和依赖cyclinE的CDK2蛋白的共同调控[2]。所以在G1期和G1/S期转化期,CDK2、CDK4和CDK6是主要的细胞周期调控子。CDK4蛋白是CDKs蛋白家族中的核心成员,其含量及活化程度在细胞增殖周期由G1期向S过渡过程中起限速作用[3~5]。在对小鼠的实验研究中证明,CDK4缺失的小鼠其肿瘤的发生率减少,在人体肿瘤的研究中发现,前列腺癌中CDK4有明显的扩增和异常表达[6],在膀胱移行细胞癌、鼻咽癌、皮肤鳞状细胞癌、食管癌、乳腺癌、胰腺癌、恶性淋巴瘤、脂肪肉瘤、黑色素瘤等肿瘤中有CDK4的过表达,表明CDK4在肿瘤的发生、发展及淋巴结转移过程中起了重要作用,与肿瘤侵袭与预后有关。另有研究表明CDK6参与多种肿瘤细胞的分化[7],在前列腺癌、骨髓瘤、肝癌、卵巢癌、黑色素瘤、Kaposi肉瘤等肿瘤中有过表达,表明CDK6参与肿瘤的发生、发展。姜可伟等研究发现胃癌组织中存在CDK6的过表达,CDK6的过表达与胃癌的组织学分型、淋巴结转移、临床分期和预后有关。另有学者发现cyclinD1和CDK4的高表达与淋巴管转移和浸润的深度有相关性[8],在某些淋巴瘤中有 CDK6的过表达也有CDK4的突变。以上研究提示CDK6与CDK4之间可能存在着某种相关性,在肿瘤的发生中发挥着协同作用。CDKs多年来主要作为一个治疗干预的靶点。抗癌生物活性肽使胃癌组织中的CDK4蛋白表达明显低于对照组(P﹤0.01),表明癌生物活性肽抑制肿瘤细胞生长,与CDK4表达低相关,其抗肿瘤机制可能通过下调CDK4和上调CDK2的表达实现[10],提示CDK4有可能作为很好的治疗癌症的靶点。多因素分析的结果显示,CDK6蛋白水平是患者预后的独立相关因素,提示CDK6有可能成为预测肿瘤预后的指标和辅助治疗的新靶点。同时有研究发现CDK6缺失并不影响正常细胞增殖,提示CDK6可以作为很好的治疗癌症的靶点。
研究结果显示,在正常皮肤表皮、皮肤病理性瘢痕上皮和瘢痕癌组织中,CDK4、CDK6蛋白的阳性表达呈上升趋势。瘢痕癌组中CDK4、CDK6阳性表达均显著高于正常皮肤组及皮肤病理性瘢痕组(P﹤0.01)。这提示两个可能,与正常皮肤组和病理性瘢痕组比较,CDK4、CDK6在瘢痕癌组织中的高表达,与瘢痕癌的发生发展有相关性;与正常皮肤组比较,CDK4、CDK6在瘢痕组表达上调,提示在病理性瘢痕上皮的增生修复过程中发挥了作用。我们注意到,CDK4、CDK6在瘢痕癌组中表达大多数为中度阳性-强阳性,而在正常皮肤组中表达仅限于上皮的基底细胞且阳性细胞数﹤10%,CDK4在皮肤病理性瘢痕组中有6例表达,其中4例仅限于上皮的基底细胞且阳性细胞数﹤10%(即为弱阳性),另外2例全层上皮细胞着色浅(即为中度阳性),CDK6在皮肤瘢痕组中有5例表达,但仅限于上皮的基底细胞且阳性细胞数<10%(即为弱阳性),显示上皮细胞经历周期的转换。在正常皮肤组中少数基底细胞CDK4、CDK6弱阳性表达,显示部分基底细胞增生活跃,在皮肤瘢痕组中CDK4、CDK6阳性率稍有增高且与皮肤瘢痕癌组阳性表达有显著差异(P<0.01),表明细胞周期正性调控因子CDK4、CDK6蛋白高表达所致的G1期调控异常涉及了皮肤瘢痕癌的发生、发展过程。在皮肤瘢痕和瘢痕癌组中检测CDK4、CDK6蛋白,可作为临床早期诊断和科学评价肿瘤预后,指导临床治疗的指标。此外,通过反义核酸技术在转录和翻译水平上阻断异常增殖细胞中CDK4、CDK6的异常表达,引起细胞的表型逆转或凋亡,二者将可能为瘢痕癌基因治疗研究提供新途径。
[1]Bosco E E,Knudsen E S.R B in breast cancer:at the crossroads of tumorigenesis and treatment[J].Cell Cycle,2007,6(6):667 -671.
[2]Pommier Y,Kohn K W.Cell cycle and checkpoints in oncology:New therapeutic targets[J].Med Sci,2003,19(2):173-186.
[3]Cheok C K,Dey A,Lane D P.Cyclin - dependent kinase inhibitors sensitize tumor cells to nutlin-induced apoptosis:a potent drug combination[J].Mol Cancer Res,2007,5(11):1135 -1145.
[4]Grimmler M,Wang Y,Mund T,et al.Cdk -inhibitoty activety and stability of p27Kipl are directly regulated by oncogenic tyrosine kinases[J].Cell,2007,128(2):269 -280.
[5]Li W,Kotoshiba S,Berthet C,et al.Rb/Cdk2/Cdk4 triple mutant mice elicit an alternative mechanism for regulation of the G1/S transition[J].Proc Natl Acad Sci U S A,2009,106(2):486 -491.
[6]Kim J,Park H,Im J Y,et al.Sodium butyrate regulates androgen receptor expression and cell cycle arrest in human prostate cancer cells[J].Anticancer Res,2007,27(5A):3285-3292.
[7]朱红琴.周期蛋白依赖性激酶6与肿瘤和细胞分化[J].生命的化学,2009,28(1):52 -54.
[8]kishimoto I,Mitomi H,Ohkura Y,et al.Abnormal expression of p16(INK4a),cyclin D1,cyclin - dependent kinase 4 and retinoblastoma protein in gastric carcinomas[J].J Surg Oncol,2008,98(1):60 - 66.
[9]Gruber F,kastelan M,Braiac I,et al.Molecular and genetic mechanisms in melanoma[J].Coll Antropol,2008,32(2):147-152.
[10]温再和,崔宏伟.抗癌生物活性肽对人胃癌BCC-823细胞周期相关蛋白CDC2、CDK4表达的影响[J].内蒙古医学院学报,2011,33(2):89 -92.

