TEMPO-NaBr-NaClO体系对细菌纤维素的氧化过程研究
廖世波 奚廷斐,2,* 赖 琛 廖世玉 黄 涛 王甩艳
1(温州医科大学信息与工程学院,温州 325035)
2(北京大学深圳研究院生物医学工程研究中心,深圳518057)
3(安徽大学生命科学学院,合肥230601)
4(温州医科大学检验医学院与生命科学学院,温州325035)
引言
纤维素是自然界分布最广、含量最多的可再生高分子材料,其来源包括植物(陆生植物木材、棉、麻等和水生植物海藻等)和微生物。其中,微生物纤维素(细菌纤维素)因具有高纯度、高机械强度、高持水性和高规则的织态结构等特点,成为近年来国内外生物材料研究的热点。
细菌纤维素独特的三维纳米网状结构与天然的细胞外基质结构极为相似,加之其良好的生物相容性,使其在生物医用材料尤其是组织工程支架领域具有广阔的应用前景。细菌纤维素在创伤敷料、皮肤替代品和人工血管等方面被广泛研究和应用[1]。细菌纤维素可以在某些细菌或真菌分泌的纤维素酶的作用下分解降解,由于人体缺乏纤维素酶,导致其不易在人体组织中降解吸收[2]。而一些学者认为,理想的支架材料必须具有良好的可生物降解性,以利于种子细胞增殖,进而分泌自身细胞外基质,并最终替代植入物[3]。可以通过表面改性等途径来改善细菌纤维素的降解能力,如有研究表明,氧化后细菌纤维素的降解性明显增大[4-6],但通常的过度氧化方法使纤维素的纳米微观结构遭到破坏,其优异的机械性能也随之丧失[7]。
2,2,6,6-四 甲 基 哌 啶-1-氧 化 物 自 由 基(TEMPO)是一种哌啶类氮氧自由基。TEMPO作为催化剂加入到NaClO和NaBr水溶液中,可形成共氧化体系TEMPO/NaBr/NaClO。研究表明,该体系对纤维素C6位伯醇羟基具有良好的选择性,而对C2,C3位仲醇羟基无作用[8-9]。在目前公开报道的文献中,所用纤维素的原料来源主要集中在植物纤维[9-11]或再生纤维素纤维[12]。Isogai等最先尝试用上述体系,对包括细菌纤维素在内的天然纤维素及相对应的再生纤维素进行氧化,得出天然纤维素(包括细菌纤维素)很难被氧化的结论[13]。Nge等在研究BC体外矿化性能时,用上述体系氧化制备了羧基含量为0.25 mol/kg的 BC膜[14];Ifuku等将TEMPO介导的氧化型BC膜作为银纳米粒子的合成模版,制备的BC膜的羧基含量达0.84 mol/kg,相当于在每7个葡萄糖重复单元上引入了1个羧基[15]。在上述研究中,均直接以 BC膜作为反应物。在随后的研究中,Nge等[16]和Okita等用BC分散浆料经TEMPO/NaBr/NaClO体系氧化,分别制得了羧基含量为0.74 mol/kg和1.05 mol/kg的氧化型BC[17],但均未对最佳氧化条件进行探索。最近,Luo等用上述体系在BC膜表面引入功能性醛基,结果表明氧化后BC膜优异的机械性能得以保留,故认为TEMPO氧化型BC在组织工程支架中具有潜在的应用价值[18]。笔者也用上述体系对BC分散浆料进行氧化,并对产物的微观形态、表面成分、润湿性和表面自由能等进行了研究和报道[19]。现将TEMPO/NaBr/NaClO体系对BC分散浆料的氧化规律研究结果报道如下,以期为类似的研究提供参考。
1 材料与方法
1.1 材料
细菌纤维素湿膜(海南光宇生物科技有限公司,中国)粉碎打浆后过滤,用蒸馏水反复洗涤3次后放于超低温保存箱(DW-86L386,海尔集团,中国),最后置于冻干机(Alpha 1-4 LSC,Christ公司,德国)中干燥,即得纯细菌纤维素;NaClO溶液(有效氯≥10%,AR级,天津富宇精细化工有限公司,中国),加双蒸水配置成0.6 mol/L NaClO溶液,避光低温保存备用;TEMPO(AR级,Sigma公司,美国);NaBr(AR级),NaOH(AR 级),盐酸(AR 级),无水乙醇(AR级),均购自天津大茂化学试剂厂。
1.2 方法
1.2.1 细菌纤维素的选择性催化氧化
采用TEMPO/NaBr/NaClO体系,对细菌纤维素进行表面羟基的氧化。
取干燥的细菌纤维素(bacterial cellulose,BC)1.00 g,加水100 mL混合打浆;称取TEMPO 0.016 g,NaBr 0.10 g,加水20 mL混合搅拌至完全溶解。将上述两种体系混合后,置于磁力搅拌器上搅拌。
取0.6 mol/L NaClO 8 mL,以滴加的方式在1 min内全部加入到上述混合体系中。从滴加第一滴开始计时,反应8 h(滴加完毕后,体系pH达最大时,另计时为0 min,并同时记下此时的体系pH值,以后每隔1 min记一次体系pH值,直至体系pH小于10.50加入0.5 mol/L NaOH溶液之前为止)。在反应过程中,用0.5 mol/L NaOH保持体系pH在10.50~11.00之间,记下消耗的NaOH总体积。反应完毕时,向体系中加5 mL无水乙醇终止反应,然后用0.5 mol/L HCL调体系pH至7.00。将体系高速离心后留取沉淀物用蒸馏水反复洗涤3次,置于低温保存箱,最后冷冻干燥,即得BC氧化产物。
考察了以下因素对反应的影响:
1)氧化剂 NaClO的量。其他条件不变,0.6 mol/L NaClO取1~10 mL(每次递增1 mL),分别制样。
2)反应时间。其他条件不变,反应时间设1、2、4、6、8、10、12、14、16、18、20、24、28、32、36、40、44、48 h,分别制样。
3)催化剂 TEMPO的量。其他条件不变,TEMPO用量分0.003、0.006、0.009 g 3个等级,每个 TEMPO 等级的反应时间又分 0.5、1、1.5、2、3、5 h,分别制样。
1.2.2 氧化细菌纤维素羧基含量的表征1.2.2.1 反应耗碱量
在反应过程中,随着羧基的生成,体系pH会逐渐下降;通过加入0.5 mol/L NaOH溶液,保持体系pH在10.50~11.00之间。虽然可能有少部分NaOH参与到副反应中去,但绝大多数用于与产物羧基发生中和反应,故NaOH溶液的消耗量与反应生成的羧基量大体成正比例关系[12]。因此,可用消耗的NaOH溶液量来反映产物的羧基含量。
1.2.2.2 电导滴定法测产物羧基含量
取0.20 g干燥的氧化后BC加水70 mL,加入0.01 mol/L NaCl 5 mL,用高速分散机(T25 DS25,德国IKA)分散成匀浆后加0.1 mol/L HCl,调体系pH至2.5~3.0之间。
以0.04 mol/L NaOH标准溶液作为滴定液,用电导滴定仪(ZDJ-5,上海精密科学仪器有限公司),对上述匀浆体系进行自动电导滴定;根据软件记录的电导值和电导滴定曲线,可得BC氧化产物的羧基含量。
2 结果
2.1 氧化剂(NaClO)量对反应的影响
2.1.1 氧化剂的量对反应初始阶段的影响
氧化剂NaClO量不同时,从其滴加完毕、体系pH达最大时开始计时,各体系pH随时间的变化关系如图1(a)所示,对其中各点的斜率取绝对值,得图1(b)。
由图1(a)可以看出,在反应的初始阶段,NaClO量不同的各体系pH均随着反应的进行逐渐降低。对图1(a)中各点的斜率取绝对值即为相应时间点pH的变化速率,记为ΔpH。由图1(b)可以看出,为0.6 mol/L NaClO用量在3~10 mL之间时,在记录范围内任一时间点,ΔpH随着NaClO用量的增大而减小;各体系ΔpH均在最初几分钟内逐渐增大,其中NaClO用量在6~10 mL之间时,ΔpH增大到一个极值后又逐渐减小。
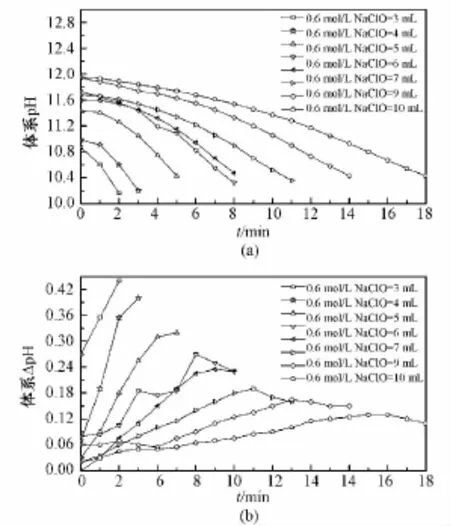
图1 NaClO量对反应体系初始阶段的影响。(a)体系pH随反应时间的变化;(b)图(a)中各点切线斜率的绝对值对反应时间作图Fig.1 Effect of the NaClO charge on the initial stage of the reaction system.(a)The pH of solution changing with the oxidation time in different system.(b)The absolute value of the slope of the tangent at every point in figure(a)varying with the oxidation time.
各体系出现最大ΔpH的时间点及相应时刻的pH值如表1所示。可以看出,NaClO的用量在6~10 mL之间时,体系最大ΔpH随着NaClO量的增大而逐渐减小,ΔpH达到最大值所需的时间也逐渐延长。各体系出现最大ΔpH相应时刻的pH值均在10.50~11.00之间,均值为10.77。
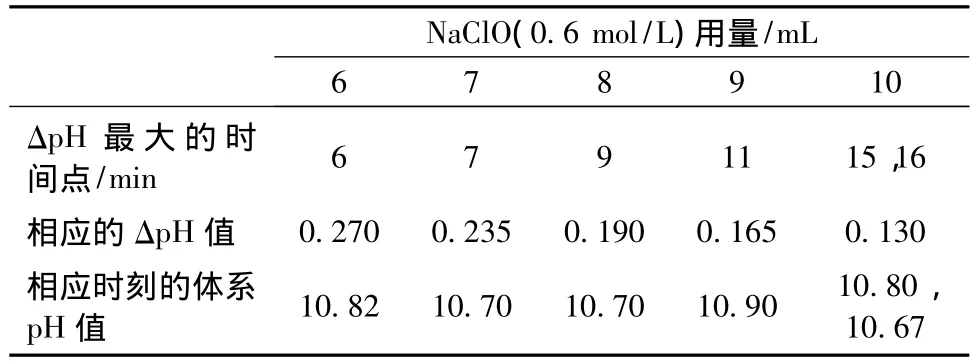
表1 NaClO量对ΔpH最大值及其出现时间的影响Tab.1 Effect of the NaClO dosage on the maximum ΔpH and its appearing time
2.1.2 氧化剂的量对整个反应过程的影响
BC=1.00 g,TEMPO=0.016 g,NaBr=0.10 g,反应8 h,0.6 mol/L NaClO的用量与反应所消耗的0.5 mol/L NaOH量之间的关系如图2所示。由图可以看出,NaClO的用量在2~10 mL之间时,反应所消耗的NaOH量与NaClO的用量呈正相关,且二者呈良好的线性关系,直线拟合结果为y=0.627 5x+0.635 0,r=0.995 2。
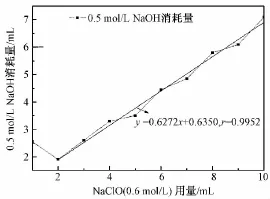
图2 NaClO量对反应体系消耗NaOH量的影响Fig.2 Effect of the NaClO dosage on NaOH consumption
2.1.3 氧化剂的量对反应产物的影响
BC=1.00 g,TEMPO=0.016 g,NaBr=0.10 g,反应8 h,0.6 mol/L NaClO的用量与产物羧基含量之间的关系如图3所示。可以看出,当其他反应条件一定、NaClO用量在1~10 mL之间时,反应产物羧基的含量随NaClO用量的增加而增大;当NaClO用量在1~8 mL之间时,二者之间呈良好的线性关系,直线拟合结果为 y=0.111 9x+0.175 5,r=0.997 5。
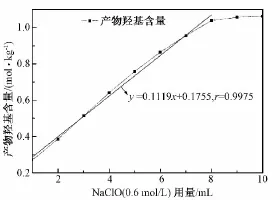
图3 NaClO量对反应产物羧基含量的影响Fig.3 Effect of the NaClO dosage on carboxyl content of the product
2.2 反应时间对反应的影响
2.2.1 反应时间对反应过程的影响
BC=1.00 g,TEMPO=0.016 g,NaBr=0.10 g,0.6 mol/L NaClO 8 mL,反应时间与反应所消耗的0.5 mol/L NaOH量之间的关系如图4所示。可以看出,在试验时间范围内(0~48 h),NaOH的消耗量总体上随着反应时间的增加而增大,其中在0~8 h之间时,NaOH的消耗量随着反应时间的延长而急剧增大;在8~18 h之间时,NaOH的消耗量不再增大,保持相对稳定,在约5.95 mL的水平;在18~48 h之间时,NaOH的消耗量又随着反应时间的延长而逐渐增大,且二者呈现良好的线性关系,直线拟合结果为 y=0.143 1x+3.572 1,r=0.985 5。
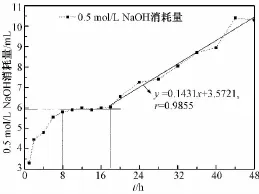
图4 反应时间对反应体系NaOH消耗量的影响Fig.4 Effect of the oxidation time on NaOH consumption
2.2.2 反应时间对反应产物的影响
BC=1.00 g,TEMPO=0.016 g,NaBr=0.10 g,0.6 mol/L NaClO 8 mL,反应时间与产物羧基含量之间的关系如图5所示。可以看出,在1~18 h之间时,产物羧基含量随着反应时间的增加而急剧减少;在18~48 h之间时,产物的羧基含量保持相对稳定,维持在0.70~0.75 mol/kg之间。
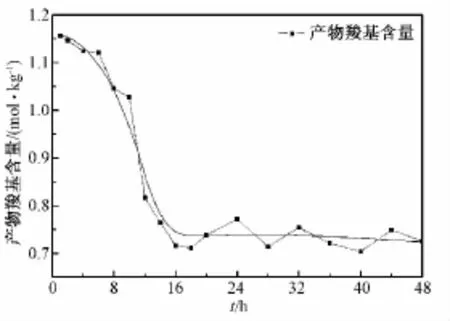
图5 反应时间对反应产物羧基含量的影响Fig.5 Effect of the oxidation time on carboxyl content of the product
2.3 催化剂(TEMPO)量对反应的影响
2.3.1 催化剂的量对反应初始阶段的影响
催化剂TEMPO量不同时,从0.6 mol/L NaClO溶液8 mL滴加完毕后体系pH达最大时开始计时,各体系的pH随时间的变化关系如图6(a)所示,图6(b)为图6(a)中各点的斜率取绝对值所得。
由图6(a)可以看出,在反应的初始阶段,TEMPO量不同的各体系pH均随着反应的进行而逐渐降低。图6(a)中各点的斜率取绝对值即为相应时间点pH的变化速率,记为ΔpH。由图6(b)可以看出,ΔpH随TEMPO用量和反应时间不断变化。TEMPO用量在0.003~0.016 g之间时,各体系ΔpH均在最初几分钟内逐渐增大,ΔpH出现最大值后又逐渐减小。在所记录范围内任一时间点,TEMPO用量 0.003、0.006、0.009 g 3个等级中,ΔpH与TEMPO用量成正相关;TEMPO用量0.016 g时,任一时间点的ΔpH小于TEMPO用量为0.003、0.006、0.009 g的3个等级相应时间点的ΔpH;总体而言,4个TEMPO等级同一时间点的ΔpH差异不明显。
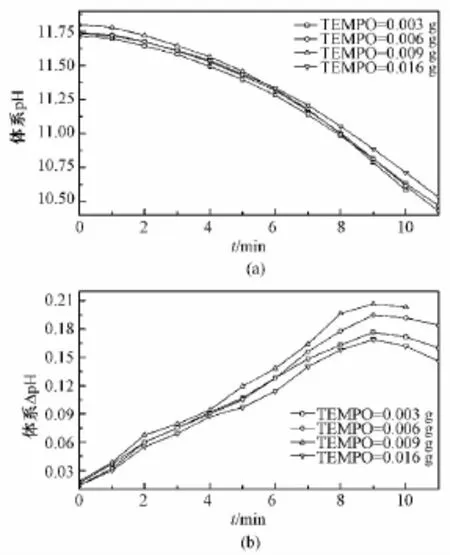
图6 TEMPO量对反应体系初始阶段的影响。(a)体系pH随反应时间的变化;(b)图(a)中各点切线斜率的绝对值对反应时间作图Fig.6 Effect of the dosage of TEMPO on the initial stage of the reaction system.(a)The pH of solution changing with the oxidation time in different system.(b)The absolute value of the slope of the tangent at every point in figure(a)varying with the oxidation time.
TEMPO量不同时,反应初始阶段各体系出现最大ΔpH的时间点及对应的pH值如表2所示。由表2可以看出,TEMPO用量在0.003~0.016 g之间时,ΔpH达到最大值所需的时间基本一致,约为反应体系pH达最大值后第9 min;各体系出现最大ΔpH相应时刻的pH值均在10.50~11.00之间,均值为10.78。
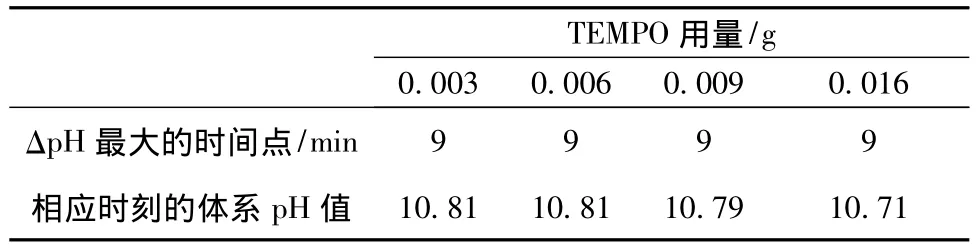
表2 TEMPO量对ΔpH最大值出现时间的影响Tab.2 Effect of the TEMPO dosage on the appearing time of maximum ΔpH
2.3.2 催化剂的量对反应过程的影响
BC=1.00 g,NaBr=0.10 g,0.6 mol/L NaClO 8 mL,TEMPO量不同时,反应时间与反应所消耗的0.5 mol/L NaOH量之间的关系如图7所示。可以看出,TEMPO用量在0.003~0.009 g之间时,反应最初的5 h内,各体系所消耗的NaOH量均随反应时间的延长而增大;在反应最初5 h内任一时间点,反应所消耗的NaOH量随TEMPO用量的增加而增大。
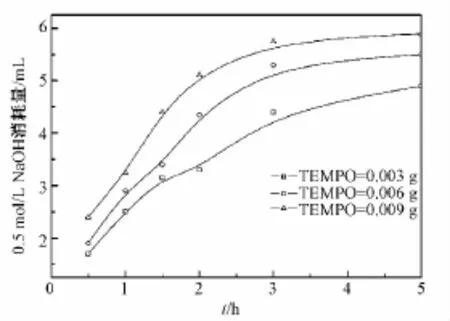
图7 TEMPO量对反应体系消耗NaOH量的影响Fig.7 Effect of the TEMPO dosage on NaOH consumption
2.3.3 催化剂的量对反应产物的影响
BC=1.00 g,NaBr=0.10 g,0.6 mol/L NaClO 8 mL,TEMPO量不同时,反应时间与产物羧基含量之间的关系如图8所示。可以看出,TEMPO用量在0.003~0.009 g之间时,反应最初的5 h内,各体系的产物羧基含量均随着反应时间的延长先增大后减小;在反应最初5 h内任一时间点,产物的羧基含量随TEMPO用量的增加而增大。
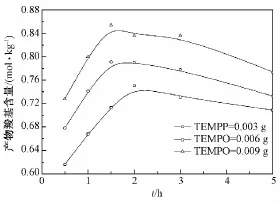
图8 TEMPO量对反应产物羧基含量的影响Fig.8 Effect of the TEMPO dosage on carboxyl content of the product
TEMPO 量为 0.003、0.006、0.009、0.016 g 这 4个不同等级时,各体系出现产物羧基含量最大值的时间点及对应的羧基含量如表3所示。可以看出,TEMPO用量在0.003~0.016 g之间时,产物羧基含量达到最大值所需的时间随着TEMPO用量的增加而逐渐缩短,产物最大羧基含量随着TEMPO用量的增加而增大。
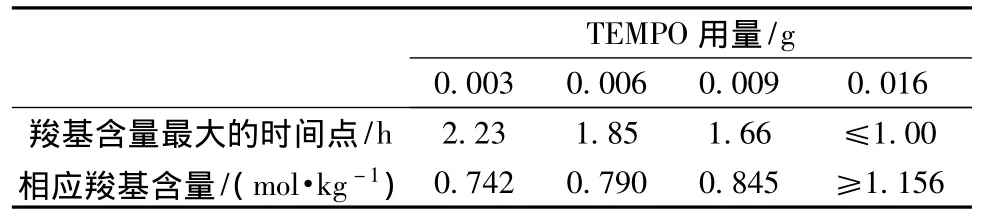
表3 TEMPO量对产物羧基含量最大值及其出现时间的影响Tab.3 Effect of the TEMPO dosage on the maximum carboxyl content and its appearing time
3 讨论
NaClO在水溶液中存在如下主要的电离平衡:ClO-1+H2O ⇌ HClO+OH-1。当NaClO作为氧化剂参与反应时,随着NaClO的消耗,上述电离平衡左移,OH-1减少,导致体系pH下降。因此,任一时间点体系pH下降的数值(即图1(a)中曲线上任一一点斜率的绝对值,记为ΔpH。)可以反映该时刻体系的氧化反应速率。从理论上讲,增大反应物NaClO的量有利于反应的进行,即该氧化反应的速率应增大。但图1(a)中的试验结果显示,当NaClO用量在3~10 mL之间时,在记录范围内任一时间点,氧化反应的速率随着NaClO用量的增大而逐渐减小。这是因为在反应初期短时间范围内,各体系之间NaClO累积消耗量的增加值小于各体系之间NaClO用量的增加值。在任一时间点体系中,NaClO的剩余量 =NaClO用量-NaClO累积消耗量。随着NaClO用量的增大,体系中NaClO的剩余量也逐渐增大,相应体系pH上升得也越多。任一时间点体系表观ΔpH =该时刻氧化反应消耗NaClO的量使pH下降值 -该时刻体系中剩余的NaClO电离使pH上升值,随着NaClO用量的增大,前者和后者均逐渐增大,但后者增大得更快,所以,任一时间点体系的表观ΔpH会随着NaClO用量的增大而减小。
图1(b)中0.6 mol/L NaClO用量在3~10 mL之间时,各体系ΔpH均在最初几分钟内增大,其中NaClO用量在6~10 mL之间时,ΔpH增大到一个极值后又逐渐减小。也就是说,pH在加入NaClO溶液获得的最大值至10.50之间时,体系的反应速率随着pH的下降先增大后减小。由表1可以看出,NaClO用量在6~10 mL之间时,随着NaClO量的增大,体系最大ΔpH逐渐减小,ΔpH达到最大值所需的时间也逐渐延长。各体系最大ΔpH由相应时间点该体系的pH和该体系NaClO的用量共同决定。各体系出现最大ΔpH相应时刻的pH值都在10.67~10.90之间,均值为10.77。这一结果证明,保持体系pH在10.50~11.00时,可以获得较大的氧化反应速率。各体系出现最大ΔpH时相应的pH值比较接近,而且各体系的最大ΔpH与相应时刻的pH值之间无明显的相关关系,在不考虑此因素的前提下,体系最大ΔpH与NaClO用量呈负相关,即在反应初始阶段,体系的最大反应速率随着NaClO用量(0.6 mol/L,6~10 mL)的增大而减小。其原因如下:反应初始阶段细菌纤维素微团表面首先被氧化,然后氧化体系逐渐向微团内部浸润,微团周围的TEMPO、Br-和ClO-等粒子向微团内部扩散,微团内部的H2O分子出来。当周围粒子浓度过高(即0.6 mol/L NaClO用量≥6 mL)时,微团内部相对较小的H2O分子很快扩散到微团外,而微团外部相对较大的TEMPO、Br-和ClO-等粒子还未来得及到达微团内部,此时微团因失水而收缩,体积变小,微纤维之间的孔径变小,周围的TEMPO、Br-和ClO-等粒子更难与微团内部的纤维素链接触并使其氧化。在初始阶段,周围粒子浓度越高,纤维素微团收缩就越厉害,TEMPO、Br-和ClO-等粒子就越难接触到微团内部的纤维素分子链,氧化反应速率就会越低。生物学组织标本制备时,脱水之所以要梯度进行,有与上述现象相类似的原因。当然,这种现象只是暂时的,随着时间的推移,当纤维素微团内外粒子扩散达到平衡时,微团的形状恢复,NaClO用量越多的体系中微团内部的ClO-浓度就越大,体系的反应速率也就越快,所以对整个反应过程来说,NaClO用量越多的体系反应速率越大。
当NaClO用量为1 mL时,滴加后体系pH<10.50,必须立即加入0.5 mol/L NaOH,使pH上升至10.50~11.00之间,此过程要额外消耗一部分NaOH,所以NaClO用量为1 mL时消耗的NaOH总量会偏高(2.55 mL),接近NaClO用量为3 mL时消耗的NaOH量(2.60 mL);当NaClO用量在2~10 mL之间时,滴加后体系pH最大值>10.50,其中当NaClO用量在5~10 mL之间时,滴加后体系pH最大值>11.00。为了使反应体系pH稳定在10.50~11.00之间,理应加入一定量的盐酸进行调节。但是,盐酸中的Cl-可与NaClO发生反应,从而降低体系中ClO-的含量。由预试验可知,此时不加盐酸,体系的pH也很快(本试验条件范围内≤13 min)自然下降至11.00以下,这段时间相对于整个反应过程的8 h而言可以忽略不计,即对整个反应过程影响有限。所以,如图2所示,当NaClO用量在2~10 mL之间时,反应过程所消耗的NaOH量与NaClO的用量呈良好的线性关系,直线拟合结果为y=0.6275x+0.6350,r=0.9952。
对整个反应过程而言,NaClO的用量越大,体系的反应速率就越大,相同时间内产物的量就越多。所以,如图3所示,当NaClO用量在1~10 mL之间时,产物羧基含量随着NaClO用量的增加而增大。当NaClO用量较少(1~8 mL)时,体系的反应速率随着NaClO用量的增加而迅速增大,具体体现为产物羧基量会迅速增大,NaClO用量与产物羧基含量之间呈良好的线性关系,直线拟合结果为 y=0.1119x+0.1755,r=0.9975。这与 Mao等用TEMPO/NaBr/NaClO体系氧化木浆得到的NaClO用量与产物羧基含量之间的变化规律是一致的[20]。Okita等用TEMPO/NaBr/NaClO体系氧化BC分散浆料,获得了羧基含量为1.05 mol/kg的产物,根据激光多普勒电泳测定结果,结合晶体横截面模型分析,认为暴露在纤维素微纤维表面的C6位伯醇羟基几乎全部被氧化成了羧基[17]。在本试验中,当NaClO用量为8 mL时,测得的产物羧基含量为1.04 mol/kg,与上述结果非常接近。所以认为,相对于1 g的BC来说,0.6 mol/L的NaClO 8 mL已经达到了将BC微纤维表面暴露出来的C6位羟基完全氧化所需的氧化剂上限量,故继续增大NaClO用量(8~10 mL)时,产物的羧基含量已基本不再增大。
向体系中加入NaOH溶液是为了中和BC氧化产生的羧基。随着反应时间的延长,产物的羧基含量不断增加,消耗的NaOH量也会不断增加。所以,如图4所示,当反应时间在0~8 h之间时,NaOH的消耗量会随着反应时间的延长而急剧增大。当所有BC的C6位上能够接触到的羟基都被TEMPO/NaBr/NaClO体系氧化时,产物的羧基量不再增加,也就不会继续再消耗NaOH,所以当反应时间在8~18 h之间时,NaOH的消耗量不再随着反应时间的延长而增加,而是维持在约5.95 mL水平。如图5所示,在1~18 h之间实际测得的产物羧基含量随着反应时间的增加而急剧减少。这可以解释为BC经TEMPO/NaBr/NaClO体系氧化后水溶性增大,在最初的8 h内既有明显的产物生成过程又有明显的产物溶解过程,8 h左右产物生成过程基本停止,8~18 h之间主要存在明显的产物溶解过程。所以,图5中1~8 h之间的曲线是产物溶解与产物生成共同作用的结果,8~18 h之间的曲线主要是产物溶解作用的结果。Chang等研究了纤维素等不溶于水的多糖经TEMPO/NaBr/NaClO体系在pH=10.80条件下的氧化,结果表明氧化后纤维素变得可溶,可溶性程度约为 10%(m/v)[21]。Saito等对TEMPO/NaBr/NaClO体系氧化棉绒纤维的规律性进行了研究,认为当产物羧基含量均值超过0.80 mol/kg时,部分产物溶解性明显增大并随洗涤过程丢失,所以其实际得到的产物羧基含量最大值只有0.74 mol/kg,即相当于平均8个单体重复单元含1个羧基[22]。这些研究结果均表明,纤维素经TEMPO/NaBr/NaClO体系氧化后水溶性增大。
如图5所示,在18~48 h之间时,产物的羧基含量相对稳定在0.70~0.75 mol/kg,即可以认为表观羧基含量在18~48 h保持不变。结合上述分析结果可知,此时间段内得到的产物实际上主要是不溶性产物,所以产物羧基含量-时间变化曲线并不能够反映体系的整体变化情况。如图4所示,在18~48 h之间时,NaOH的消耗量随着反应时间的延长而逐渐增大,这说明在此段时间内体系中仍有反应发生。结合整个48 h内NaOH的耗量变化及产物羧基含量的变化,分析有如下可能的原因。
1)在最初8 h内,BC非结晶区C6位上的羟基发生氧化;8 h左右,非结晶区C6位上的羟基消耗完后氧化反应停止;最初18 h内,这些BC非结晶区氧化产物不断溶解;18 h左右,非结晶区产物基本溶解完全,使BC结晶区C6位上的羟基暴露出来,TEMPO/NaBr/NaClO体系又接着与暴露出的BC结晶区C6位上的羟基发生反应,故在18~48 h之间时,NaOH的消耗量会随着反应时间的延长而逐渐增大。由图4可见,二者呈现良好的线性关系,直线拟合结果为y=0.1431x+3.5721,r=0.9855。理论上反应生成的羧基量与NaOH溶液的消耗量成正比,所以可推断这一阶段氧化反应的速率基本保持不变,即可以认为TEMPO/NaBr/NaClO体系氧化BC结晶区C6位羟基的反应速率为定值。若此阶段产物的生成速率接近或等于产物的溶解速率,则实际测得的羧基含量可以保持相对恒定。此外,由图4可以看出,NaOH在0~8 h之间的消耗速率明显大于18~48 h之间的消耗速率,即BC非结晶区氧化反应速率明显大于结晶区氧化反应速率,这与Sun等在研究TEMPO/NaBr/NaClO体系氧化再生纤维素过程中观察到的规律是一致的[12]。
2)已有研究表明,纤维素在碱溶液中会发生降解[23-24],Shibata 等认为,NaBrO 和 TEMPO 形成的羟基自由基是TEMPO/NaBr/NaClO体系在pH=10~11条件下引起纤维素氧化产物降解的主要原因[24]。故认为在碱性条件下,随着反应时间的延长(18~48 h),纤维素分子会发生水解反应和剥皮反应。水解会产生异变糖酸,剥皮反应会产生葡萄糖单元和纤维素末端偏变糖酸基[25],其中产生的葡萄糖单元可被进一步氧化成葡萄糖醛酸及己烯糖醛酸等小分子酸[26]。这些产物酸都会消耗NaOH,使其用量增加。若发生水解反应和剥皮反应的是原BC,则实际测得的羧基含量不受这些反应的影响;若发生水解反应和剥皮反应的是氧化后BC,因反应条件温和、水解程度小,所以对氧化产物的量几乎无影响。剥皮反应使纤维素分子链大约损失50个葡萄糖单元[25],只占 BC分子葡萄糖单元的50/(4 000~16 000),所以对所测产物的羧基含量也几乎无影响。此阶段产物的羧基含量水平与Nge等用TEMPO/NaBr/NaClO体系氧化BC分散浆料得到的不溶性产物的羧基含量(0.74 mol/kg)是一致的[16]。
由图6(b)可知,当 TEMPO用量在0.003~0.016 g之间时,初始阶段各体系的反应速率均逐渐增大,TEMPO各等级体系在同一时间点的ΔpH差异不明显,在同一时间点各体系的pH统计值非常接近(差值≤0.10),表明在反应初始阶段,催化剂TEMPO的量并不是决定反应速率的主要因素,体系pH值才是决定反应速率的主要因素。表2中各TEMPO等级出现最大 ΔpH时,体系 pH值均在10.71~11.81之间,均值为10.78。结合表1结果可知,当NaClO或TEMPO量不同时,体系初始阶段的最大反应速率均出现在 pH=10.50~11.00之间。
底物足量时,催化剂用量越多,体系的反应速率就越大,相同时间内产物的量就越多。TEMPO用量在0.003~0.009 g之间时,在反应最初5 h内的任一时间点,体系所消耗的NaOH量随TEMPO用量的增加而增大(见图7),所测得的产物羧基含量也随TEMPO用量的增加而增大(见图8)。底物量一定时,催化剂越多,氧化反应的进程就越快,BC暴露出来的C6位羟基全部转化成产物羧基所需的时间就越短。所以表3中,当TEMPO用量在0.003~0.016 g之间时,产物羧基含量达最大值所需的时间会随着TEMPO用量的增加而缩短,这与Mao等[20]在研究木浆的氧化过程中得到的规律是一致的。理论上,当BC和NaClO量一定时,TEMPO用量不同的各体系最大羧基含量应该相等,但由于产物生成过程中伴有产物的溶解,TEMPO用量不同的各体系达到最大羧基含量所需时间不同,所以各体系在达到最大羧基含量时体系中溶解的产物量不同,从而使得实际测得的最大羧基含量出现差异。
4 结论
采用TEMPO/NaBr/NaClO体系氧化1 g BC,在反应初始阶段,体系的反应速率逐渐增大,最大反应速率出现在体系pH=10.50~11.00之间,反应速率随NaClO用量(0.6 mol/L,3~10 mL)的增大而减小,TEMPO用量(0.003~0.016 g)对反应速率的影响不明显,体系的pH值是影响此阶段反应速率的主要因素之一。对整个反应过程而言,体系的反应速率随NaClO用量(0.6 mol/L,1~10 mL)的增加而增大,随TEMPO用量(0.003~0.016 g)的增加而增大。不溶性产物的羧基含量随NaClO用量(0.6 mol/L,1~10 mL)的增加而增大,其中 NaClO用量在1~8 mL之间时,二者呈现良好的线性关系;不溶性产物的羧基含量随反应时间的延长先逐渐减小(1~18 h),后保持相对稳定在0.70~0.75 mol/kg(18~48 h);产物的羧基含量随TEMPO用量(0.003~0.016 g)的增加而增大。
培养方式不同(静态或动态培养)所获得的BC的结构和性能不同[27],处理方式不同(是否碱化)时BC的反应性也不同[13],参与反应的BC状态(片材或浆料)也会影响反应进程,所以TEMPO/NaBr/NaClO体系对不同种类BC氧化反应的规律及相互之间的差异还有待更进一步的研究和确定。
[1]Czaja WK,Young DJ,Kawecki M,et al.The future prospects of microbial cellulose in biomedical applications [J].Biomacromolecules,2007,8(1):1 -12.
[2]Schenfelder U,Abel M,Wiegand C,et al.Influence of selected wound dressing on PMN elastase in chronic wound fluid and their antioxidative potential in vitro[J].Biomaterials,2005,26:6664-6673.
[3]Kakisis JD,Liapis CD,Breuer C,et al.Artificial blood vessel:the Holy Grail of peripheral vascular surgery[J].Journal of Vascular Surgery,2005,41(2):349 -354.
[4]李建,万怡灶,黄远,等.仿生矿化法制备可降解羟基磷灰石/氧化细菌纤维素复合材料[J].复合材料学报,2008,25(6):7-11.
[5]Li Jian,Wan Yizao,Li Lianfeng,et al.Preparation and characterization of 2,3-dialdehyde bacterial cellulose for potential biodegradable tissue engineering scaffolds[J].Materials Science and Engineering:C,2009,29(5):1635-1642.
[6]Peng Shuai,Zheng Yudong,Wu Jian,et al.Preparation and characterization of degradable oxidized bacterial cellulose reacted with nitrogen dioxide[J].Polymer bulletin,2012,68(2):415-423.
[7]Calvini P,Conio G,Princi E,et al.Viscometric determination ofdialdehyde contentin periodate oxycellulose PartII.Topochemistry of oxidation[J].Cellulose,2006,13(5):571 -579.
[8]Isogai A,Saito T,Fukuzumi H.TEMPO-oxidized cellulose nanofibers[J].Nanoscale,2011,3(1):71 - 85.
[9]Saito T,Hirota M,Tamura N,et al.Individualization of nanosized plant cellulose fibrils by direct surface carboxylation using TEMPO catalyst under neutral conditions [ J].Biomacromolecules,2009,10(7):1992 -1996.
[10]Cao Xinwang,Ding Bin,Yu Jianyong,et al.In situ growth of silver nanoparticles on TEMPO-oxidized jute fibers by microwave heating[J].Carbohydrate Polymers,2013,92(1):571 -576.
[11]Rodionova G,Saito T,Lenes M,et al.TEMPO-mediated oxidation of Norway spruce and eucalyptus pulps:preparation and characterization of nanofibers and nanofiber dispersions[J].Journal of Polymers and the Environment,2013,21(1):207 -214.
[12]Sun Bin,Gu Chunju,Ma Jinhong,et al.Kinetic study on TEMPO-mediated selective oxidation of regenerated cellulose[J].Cellulose,2005,12(1):59 -66.
[13]Isogai A,Kato Y.Preparation of polyuronic acid from cellulose by TEMPO-mediated oxidation[J].Cellulose,1998,5(3):153-164.
[14]Nge TT,Sugiyama J.Surface functional group dependent apatite formation on bacterialcellulose microfibrils network in a simulated body fluid[J].Journal of Biomedical Materials Research Part A,2007,81(1):124-134.
[15]Ifuku S,Tsuji M,Morimoto M,et al.Synthesis of silver nanoparticles templated by TEMPO-mediated oxidized bacterial cellulose nanofibers[J].Biomacromolecules,2009,10(9):2714-2717.
[16]Nge TT,Nogi M,Yano H,et al.Microstructure and mechanical properties of bacterial cellulose/chitosan porous scaffold[J].Cellulose,2010,17(2):349-363.
[17]Okita Y,Saito T,Isogai A.Entire surface oxidation of various cellulosemicrofibrils by TEMPO-mediated oxidation[J].Biomacromolecules,2010,11(6):1696 -1700.
[18]Luo Honglin,Xiong Guangyao,Hu Da,et al.Characterization of TEMPO-oxidized bacterial cellulose scaffolds for tissue engineering applications[J].Materials Chemistry and Physics,2013,143(1):373-379.
[19]LaiChen, Sheng Liyuan, Liao Shibo, etal. Surface characterization of TEMPO-oxidized bacterial cellulose[J].Surface and Interface Analysis,2013,45(11-12):1673-1679.
[20]Mao Lianshan,Ma Pu,Law K,et al.Studies on kinetics and reuse of spent liquor in the TEMPO-mediated selective oxidation of mechanical pulp[J].Ind Eng Chem Res,2010,49:113 -116.
[21]Chang PS,Robyt JF.Oxidation of primary alcohol groups of naturally occurring polysaccharides with 2,2,6,6 - tetramethyl-1 - piperidine oxoammonium ion[J].Journal of Carbohydrate Chemistry,1996,15(7):819 -830.
[22]SaitoT, IsogaiA. TEMPO-mediated oxidation ofnative cellulose.The effect of oxidation conditions on chemical and crystalstructures of the water-insoluble fractions[J].Biomacromolecules,2004,5(5):1983 -1989.
[23]Tahiri C,Vignon MR.TEMPO-oxidation of cellulose:Synthesis and characterization of polyglucuronans[J].Cellulose,2000,7(2):177-188.
[24]Shibata I,Isogai A.Depolymerization of cellouronic acid during TEMPO-mediated oxidation[J].Cellulose,2003,10(2):151-158.
[25]牟莉.微波辅助下木质纤维素降解与溶解过程的研究[D].长春:东北师范大学,2012.
[26]Saito T,Yanagisawa M,Isogai A.TEMPO-mediated oxidation of native cellulose:SEC-MALLS analysis of water-soluble and insoluble fractions in the oxidized products[J].Cellulose,2005,12(3):305-315.
[27]Czaja W,Romanovicz D,Malcolm BR.Structural investigations of microbial cellulose produced in stationary and agitated culture[J].Cellulose,2004,11(3-4):403-411.
- 中国生物医学工程学报的其它文章
- 人E钙粘素融合蛋白基质对人骨髓间充质干细胞向肝细胞定向诱导分化的影响研究

