人E钙粘素融合蛋白基质对人骨髓间充质干细胞向肝细胞定向诱导分化的影响研究
徐建斌 张 妍 李素华 祝传顺, 姚芳莲 赤池敏宏 杨 军*
1(南开大学生命科学学院,天津 300071)
2(天津大学化工学院,天津 300072)
3(东京工业大学生命理工学研究科,日本横滨 226-8501)
引言
人骨髓间充质干细胞(hBMSCs)来源广泛,易于分离培养,不仅具有自我更新和多向分化的潜能,而且不容易引起免疫排斥,应用于组织工程种子细胞的研究具有广泛的科研和临床应用价值[1-3]。近年有研究表明,骨髓间充质干细胞在特定环境下可以分化为肝细胞样细胞,并具有成熟肝细胞的功能[4-6]。但人骨髓间充质干细胞跨胚层定向诱导分化为肝细胞仍存在尚未解决的问题,如分化效率和产量较低,以及分化的特异性不稳定等问题[7-8]。拟通过基因工程技术生物合成细胞外基质材料仿生构建细胞间紧密结合,改善hBMSCs的体外增殖及其在特定生长条件下向肝细胞的定向分化。
我们已经成功地通过生物合成技术制备了人细胞间粘附分子E-钙粘素胞外域与免疫球蛋白Fc段的融合蛋白 (hE-cadherin-Fc),并将其用于疏水材料的表面修饰,结果显示该基质显著促进hBMSCs体外培养的增殖活性并保持了其未分化性能[9]。
本研究中,通过肝细胞特异性基因、蛋白的表达、流式细胞术、糖原染色、ICG摄取及白蛋白、尿素的合成等检测,与常规的组织细胞培养板(TC-PS)和明胶(Gelatin)基质材料作比较,进一步考察在肝定向特定培养条件下,hE-cadheirn-Fc基质对hBMSCs向肝细胞定向诱导分化的影响(图1)。
1 材料和方法
1.1 材料
人骨髓间充质干细胞(HUXMF,Cyagen公司,中国):肝细胞生长因子(HGF,R&D公司,美国)、成纤维细胞生长因子(FGF-4,R&D公司,美国)、抑瘤素M(OSM,R&D公司,美国)、地塞米松(DEX,索莱宝生物,中国)、组织细胞培养板(TC-PS,CORNING公司,美国)、明胶(Gelatin,Sigma公司,美国)、TRIzol(Invitrogen公司,美国)、M-MLV(Takara公司,日本)、DNA聚合酶(Takara公司,日本)、CD117(BD公司,美国);人白蛋白抗体(ALB,Santa Cruz Biotechnology,美国)、FITC 标记的二抗(Santa Cruz Biotechnology,美国)、高碘酸-雪夫试剂(periodicacid-Schiff,PAS);吲哚青绿(ICG,Sigma公司,美国)、人白蛋白 ELISA试剂盒(R&D systems,美国)、尿素测定试剂盒(BioAssay Systems,美国)。
1.2 方法
1.2.1 hE-cadherin-Fc的表达与纯化
基因工程技术构建hE-cadherin-Fc-pcDNA3.1质粒基因,利用FreeStyle MAX 293蛋白表达系统表达融合蛋白,通过ProteinA亲和蛋白分离柱纯化制备融合蛋白[9]。
1.2.2 hE-cadherin-Fc的基质化
5 μg/mL的hE-cadherin-Fc生理盐水溶液添加到聚苯乙烯培养板中,4℃过夜固定,用生理盐水洗涤一次后待用。
1.2.3 人骨髓间充质干细胞向肝细胞诱导分化
hBMSCs培养到 3~5代后接种于 TC-PS、Gelatin和hE-cadherin-Fc基质表面,添加肝细胞诱导分化培养基(含20 ng/ml HGF,10 ng/ml FGF-4,10 ng/ml OSM和1M DEX)分化培养4周,倒置显微镜观察细胞形态。
1.2.4 RT-PCR检测
TRIzol法提取细胞总RNA,M-MLV逆转录合成cDNA,RT-PCR检测分化后细胞的白蛋白(ALB)、甲胎蛋白(AFP)、角蛋白18(CK18)、肝细胞核因子4(HNF4)和脱唾液酸糖蛋白受体(ASGPR)基因的表达,PCR产物通过1%琼脂糖凝胶电泳表征。利用Primer 5软件设计特异性引物,b-actin:5'-AGCGAGCATCCCCCAAAGTT-3'/5'-GGGCACGAAG GCTCATCATT-3';ALB:5'-ACAGAATCCTTGGTGA ACAGGCGA-3'/5'-TCAGCCTTGCAGCACTTCTCTAC A-3';AFP:5'-TGCAGCCAAAGTGAAGAGGGAAGA-3'/5'-CATAGCGAGCAGCCCAAAGAAGAA-3';CK 18:5'-AATGGGAGGCATCCAGAACGAGAA-3'/5'-GGGCATTGTCCACAGTATTTGCGA-3';HNF4:5'-CCAAGTACATCCCAGCTTTC-3'/5'-TTGGCATCTGG GTCAAAG-3'; ASGPR: 5'-CTGAGCTCGGAGG AAAATGA-3'/5'-GGGATGTGATCTTGTCACCC-3'。扩增产物的荧光强度用Image J分析软件(1.42)进行定量。
1.2.5 白蛋白免疫荧光检测
诱导分化培养4周的细胞,用PBS洗涤两次,4%多聚甲醛固定30 min,0.1%的Triton X-100破膜15 min,山羊血清室温封闭抗原30 min,用ALB一抗4℃孵育过夜,PBS洗两遍,再用FITC标记的二抗避光继续孵育30 min,PI染细胞核,置荧光显微镜下观察。
1.2.6 流式细胞术检测
消化离心收集不同基质表面分化4周的细胞,将细胞重悬浮于冷的PBS中,细胞与抗CD117抗体在冰上孵育30 min,PBS洗涤两次后,重悬定量到每毫升1×106个细胞,用流式细胞仪(FACSCalibur,Becton Dickinson)进行分析。
1.2.7 过碘酸-Schiff氏法检测糖原合成
诱导分化培养4周的细胞,用4%多聚甲醛固定5 min,水洗2次后,滴加1%过碘酸氧化10 min,水洗2次后,滴加雪夫氏溶液,放置于37°C温箱中10 min,取出后流水洗涤10 min,晾干后光学显微镜观察染色情况。
1.2.8 ICG摄取实验
诱导分化4周的细胞,用PBS洗涤两次后,加入1 mg/mL ICG于37°C孵育30 min,光学显微镜下观察细胞摄入ICG颜色的变化。
1.2.9 白蛋白和尿素的检测
分化培养过程中经时检测培养液中的白蛋白和尿素的浓度,其严格按照人白蛋白ELISA试剂盒和尿素测定试剂盒操作指南完成。
1.2.10 统计学分析
采用SPSS 11.0统计软件包进行分析,数据以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为有统计学意义。
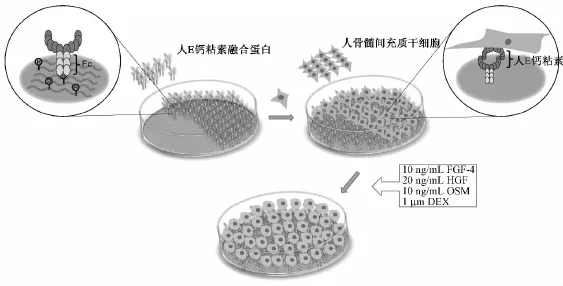
图1 在人E-钙粘素融合蛋白基质表面人骨髓间充质干细胞向肝细胞诱导分化Fig.1 The strategy for the differentiation of hBMSCs on hE-cadherin-Fc fusion protein coated surface
2 结果
2.1 人骨髓间充质干细胞向肝细胞分化的形态变化
首先观察诱导分化前后人骨髓间充质干细胞形态的变化(见图2)。诱导分化前,细胞在3种基质表面均呈成纤维细胞形态生长;在 HGF/FGF/OMS/Dex联合向肝细胞诱导分化4周后,细胞呈圆形或椭圆形的多面体结构,其类似于肝细胞的形态,hE-cadherin-Fc基质表面与TC-PS或Gelatin基质表面无显著性差异。非诱导组并未出现此类细胞形态。
为了进一步确定人骨髓间充质干细胞向肝细胞分化的效率,通过流式细胞术分析肝前体细胞标志物CD117的表达(见图3),结果显示:非诱导组细胞未检测到CD117阳性表达;HGF/FGF/OMS/Dex联合诱导分化后,在hE-cadherin-Fc基质表面CD117的阳性细胞比例高于TC-PS和Gelatin基质表面。
2.2 肝特异性标志基因的表达
如图4所示,在不同基质的表面,hBMSCs在HGF/FGF/OMS/Dex联合向肝细胞诱导分化过程中,其肝特异性基因ALB、CK18、HNF4和 ASGPR的表达均随诱导分化时间的延长而增加;而AFP的表达在诱导分化前两周呈上升趋势后逐渐下降,在第四周AFP表达显著减弱;其灰度比半定量分析结果表明:hE-cadherin-Fc基质表面细胞ALB、CK18和HNF4的表达明显高于明胶和TC-PS表面的细胞。
2.3 肝特异性标志白蛋白的表达

图2 不同基质表面人骨髓间充质干细胞向肝细胞分化的形态(上图为未分化的细胞形态,下图为分化4周的细胞形态)。(a)组织细胞培养板基质表面分化前后的细胞;(b)明胶基质表面分化前后的细胞;(c)人E钙粘素融合蛋白基质表面分化前后的细胞Fig.2 Morphologies of hepatic differentiated cells on various surfaces(The upper row is undifferentiated cells,the lower row is hepatic differentiated cells).(a)Hepatic differentiated cells on TC-PS;(b)Hepatic differentiated cells on Gelatin;(c)Hepatic differentiated cells on hE-cadherin-Fc
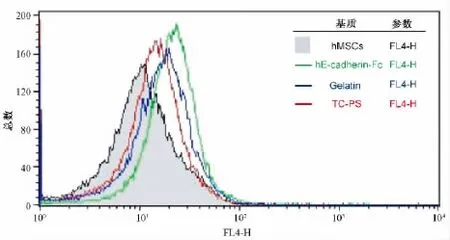
图3 不同基质表面人骨髓间充质干细胞向肝细胞分化的流式细胞术分析Fig.3 CD117 expressions of hepatic differentiated cells on various surfaces
如图5所示,通过免疫荧光染色证实,在不同基质表面向肝细胞诱导分化4周后,hBMSCs均表达肝特异性白蛋白(ALB)。ALB蛋白表达与其基因检测结果一致,hE-cadherin-Fc基质可显著促进HGF/FGF/OMS/Dex联合诱导分化hBMSCs表达肝特异性白蛋白。非诱导分化组未检测到白蛋白阳性细胞。
2.4 肝细胞功能表达
2.4.1 PAS染色和ICG摄取
糖原合成是一个重要的肝细胞代谢功能,通过PAS染色对不同基质表面分化4周后细胞的糖原储存能力进行分析(见图6)。在图6中(b)~(d)的上图,分别显示TC-PS、Gelatin和 hE-cadherin-Fc基质表面均有阳性的颗粒(实际染色为红色)弥散状分布于细胞质中,其表明分化后的细胞具有糖原合成能力。同时,通过ICG摄取实验评价肝细胞的ICG代谢能力,如图6中(b)~(d)的下图所示,1 mg/mL ICG加入到不同基质表面分化4周的细胞培养体系中,孵育30 min后,不同基质表面的分化细胞呈较深颜色(实际染色为绿色)。
2.4.2 白蛋白及尿素合成
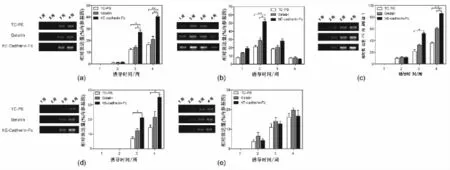
图4 不同基质表面分化细胞的肝特异性基因的表达(左图为肝特异性基因在分化过程中的RT-PCR检测,右图为基因荧光强度的相对表达量)。(a)ALB;(b)AFP;(c)CK18;(d)HNF4;(e)ASGPRFig.4 Hepatic gene expression of hepatic differentiated cells on various surfaces(left is the mRNA expressions,right is the relative fluorescent intensity of amplified products).(a)ALB;(b)AFP;(c)CK18;(d)HNF4;(e)ASGPR

图5 不同基质表面分化细胞的白蛋白免疫荧光染色。(a)未分化的细胞;(b)组织细胞培养板表面;(c)明胶基质表面;(d)人E钙粘素融合蛋白基质表面Fig.5 Immunofluorescence staining of ALB of hepatic differentiated cells on various surfaces.(a)Undifferentiated cells;(b)TC-PS;(c)Gelatin;(d)hE-cadherin-Fc
合成与代谢功能是成熟肝细胞的表型特征之一,其中白蛋白与尿素的合成、分泌已广泛用于肝功能表征,本研究中进一步比较了不同基质对HGF/FGF/OMS/Dex联合诱导分化hBMSCs白蛋白和尿素合成分泌功能的影响(见图7)。在不同基质表面诱导分化1周后,培养液中分别检测到细胞合成分泌的白蛋白和尿素,且其随诱导时间延长,表达量逐渐增高;在诱导分化3周和4周时,hE-cadherin-Fc基质表面细胞的ALB和Urea的表达量明显高于TC-PS和Gelatin基质。上述结果表明,hE-cadherin-Fc基质可以促进hBMSCs向肝样细胞分化并成熟为具有分化功能的肝细胞。
3 讨论
细胞外微环境中细胞间、细胞和细胞外基质以及细胞与生长因子间的相互作用对干细胞黏附、增殖和分化等具有重要作用[10-11]。随着生物学与材料学不断融合发展,利用生物活性材料仿生构建干细胞外微环境,有效调控干细胞增殖及其分化的研究已成为当前生物医学工程领域的一个研究热点[12-14]。其中,细胞外基质蛋白(如胶原蛋白、层粘连蛋白、纤维粘连蛋白等)及其功能多肽(如RGD、YIGSR、FN-CH296等)已广泛用于细胞基质材料的改性,研究表明其均可通过整合素(integrin)家族信号通路显著改善细胞与材料的相互作用,促进体内外干细胞的黏附、增殖及特异性诱导分化[15-16]。同时,近年基因工程技术通过对目标蛋白DNA序列的“剪切”、“拼接”重组蛋白基因序列并生物合成具有特异性多功能融合蛋白的研究,为仿生构建细胞外微环境提供了结构和功能可控的新型多功能融合蛋白基质的设计思路和制备技术[17-18]。

图6 不同基质表面分化细胞的PAS染色和ICG摄取(上图为PAS染色,下图为ICG摄取)。(a)未分化的细胞;(b)组织细胞培养板表面;(c)明胶基质表面;(d)人E钙粘素融合蛋白基质表面Fig.6 PAS staining and ICG uptake of hepatic differentiated cells on various surfaces(The upper row is PAS staining,the lower row is ICG uptake).(a)Undifferentiated cells;(b)TC-PS;(c)Gelatin;(d)hE-cadherin-Fc
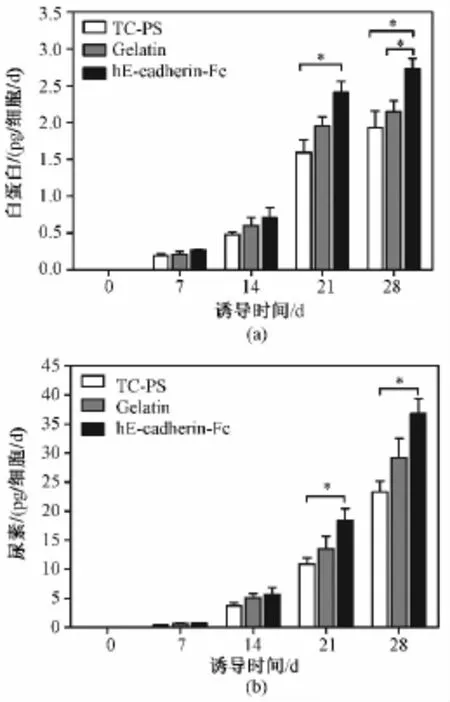
图7 不同基质表面分化细胞的肝功能表达。(a)白蛋白的表达;(b)尿素的表达Fig.7 Expression of live-specific functions of hepatic differentiated cells on various surfaces.(a)Expression of ALB;(b)Expression of urea
研究组已经报道了内皮细胞生长因子(VEGF)与免疫球蛋白IgG的Fc段的融合蛋白(VEGF-Fc)基质。研究结果表明,VEGF-Fc经Fc疏水作用修饰疏水材料表面,显著改善材料的表面亲水性,并经血管内皮细胞表面VEGF受体介导改善血管内皮细胞在材料表面的黏附及增殖活性[19-20],是一种具有VEGF生物学活性的融合蛋白细胞外基质。另外,鉴于细胞间黏附蛋白分子E-钙粘素是一种介导细胞间黏附连接的钙依赖性跨膜糖蛋白,其胞外域形成细胞间同质粘附,其胞内域与连环素(catenin)形成复合体并与微丝骨架结合进而影响细胞生物学行为[21-22];E-钙粘素在干细胞表面也有表达,并对干细胞的细胞间黏附、增殖及分化具有重要的调控作用[23-24]。设计并制备了人源E-钙粘素的胞外域与人IgG Fc的融合蛋白,并报道了其作为细胞外基质通过模拟细胞间相互作用介导人骨髓间充质干细胞黏附并促进其增殖的作用[9]。本研究中,进一步考察了hE-cadherin-Fc融合蛋白基质对hBMSCs向肝细胞定向分化的影响。
本实验结果表明:在以HGF/FGF/OMS/Dex为主要诱导分化因子的条件下,hE-cadherin-Fc融合蛋白基质不仅可以促进hBMSCs跨胚层分化为呈类圆形或多边型且CD117阳性表达的肝前体细胞(图2-3),并且随诱导分化时间的延长,还进一步促进其成熟为具有肝特异性分化功能的肝细胞,即表达肝脏的合成与代谢功能(图5-7)。该结果与其它研究者N-cadherin-Fc基质改善P19胚胎癌细胞体外增殖及其定向心肌细胞分化的研究结果一致[25],说明钙粘素家族蛋白胞外域用于细胞外基质有利于细胞通过钙粘素同源结合促进基质选择性地与细胞间相互作用。另一方面,本研究中基质对hBMSCs向肝细胞诱导分化过程中细胞基因表达的影响研究结果(图4)还显示,hE-cadherin-Fc基质不仅促进肝特异性蛋白基因表达(如ALB、CK18等),还明显上调肝细胞转录因子HNF4a的基因表达。HNF4a通过在转录水平调控下游多种基因的表达,能有效维持和改善干细胞的分化水平,增强肝细胞的蛋白、糖原合成、药物代谢及解毒功能;调控HNF4a表达可能是增强肝细胞生物学活性和功能的有效 途径 之 一[26]。在 hE-cadherin-Fc促 进hBMSCs黏附与增殖的前期研究中,已经报道hE-cadherin-Fc经hBMSCs表面的E-cadherin胞外域介导细胞黏附、明显上调hBMSCs表达β-catenin基因[9]。β-catenin既是E-cadherin与肌动蛋白细胞骨架结合的中间体,也是Wnt信号通路的转录因子,对hE-cadherin-Fc基质调控hBMSCs的黏附、增殖及分化具有重要的影响[27]。综上所述,hE-cadherin-Fc融合蛋白作为一种新型的融合蛋白细胞外基质,其可能影响细胞转录因子表达并在转录水平调控hBMSCs的肝细胞定向分化,但其作用分子机制还有待于进一步深入研究。
4 结论
hE-cadherin-Fc融合蛋白作为一种稳定的仿生细胞间相互作用的细胞外基质与HGF/FGF/OMS/Dex联合诱导分化因子共同作用下,可以有效促进hBMSC向肝细胞定向分化,并表达成熟肝细胞的肝脏特异性分化功能。利用hE-cadherin-Fc基质构建的干细胞外微环境,通过细胞外基质材料增强细胞间黏附,改善hBMSCs相互作用,促进其跨胚层定向分化为功能性肝细胞,为开发高效hBMSCs体外扩增和肝定向分化诱导技术提供了参考。
[1]Bianco P,Robey PG.Stem cells in tissue engineering[J].Nature,2001,414(1):118-121.
[2]Kuo TK,Hung SP,Lee OK,et al.Stem cell therapy for liver disease:parameters governing the success of using bone marrow mesenchymal stem cells[J].Gastroenterology,2008,134(7):2111-2121.
[3]吕静静,於学禅,沈秋霞,等.干细胞在工程化组织构建与再生中的应用[J].中国生物医学工程学报,2013,32(1):99-113.
[4]Horwitz EM.Stem cell plasticity:the growing potential of cellular therapy[J].Arch Med Res,2003,34(6):600 -606.
[5]Chen Ye, Dong Xuejun, Zhang Guorong, et al.In vitro differentiation of mouse bone marrow stromal stem cells into hepatocytes induced by conditioned culture medium of hepatocytes[J].J Cell Biochem,2007,102(1):52-63.
[6]王永红,王常勇,郭希民,等.人骨髓间质干细胞体外扩增和向成骨细胞分化的实验研究[J].中国生物医学工程学报,2002,21(3):251-274.
[7]Takenaga M,Fukumoto M,Hori Y.Regulated nodal signaling promotes differentiation of the definitive endoderm and mesoderm from ES cells[J].J Cell Sci,2007,120(12):2078 -2090.
[8]Lutolf MP,Hubbell JA.Synthetic biomaterials as instructive extracellularmicroenvironments formorphogenesisin tissue engineering[J].Nat Biotechnol,2005,23(1):47 -55.
[9]Xu Jianbin,Zhu Chuanshun,Yang Jun,et al.hE-cadherin-Fc fusion protein coated surface enhances the adhesionand proliferation of human mesenchymal stem cells[J].Colloids Surf B Biointerfaces,2013,109(1):97-102.
[10]Discher DE, MooneyDJ, ZandstraPW. Growth factors,matrices,and forces combine and control stem cells [J].Science,2009,324(5935):1673-1677.
[11]Guilak F,Cohen DM,Estes BT,et al.Control of stem cell fate by physical interactions with the extracellular matrix[J].Cell Stem Cell,2009,5(1):17 -26.
[12]Langer R,Tirrell DA.Designing materials for biology and medicine[J].Nature,2004,428(1):487 -492.
[13]Chen SS,Fitzgerald W,Zimmerberg J.Cell-cell and cellextracellular matrix interactions regulate embryonic stem cell differentiation[J].Stem Cells,2007,25(3):553 -561.
[14]丁亮华,罗光华,吴俊.成人骨髓基质干细胞体外成骨细胞分化诱导[J].中国生物医学工程学报,2006,25(3):333-337.
[15]Ito H,Steplewski A,Alabyeva T,et al.Testing the utility of rationallyengineered recombinantcollagen-like proteinsfor applications in tissue engineering[J].J Biomed Mater Res A,2006,76(3):551-560.
[16]Hersel U,Dahmen C,Kessler H.RGD modified polymers:biomaterials for stimulated cell adhesion and beyond [J].Biomaterials,2003,24(24):4385-4415.
[17]Nagaoka M, JiangHL, ChoCS, etal. Application of recombinant fusion proteins for tissue engineering[J].Ann Biomed Eng,2010,38(3):683-693.
[18]栾希英,段巧艳,张学光,等.再生柞蚕丝素蛋白对人骨髓间充质干细胞体外扩增的支持作用[J].中国生物医学工程学报,2007,26(2):276-281.
[19]Yu Meihua,Du Fengyi,Yang Jun,et al.Preparation and characterization of a VEGF-Fc fusion protein matrix for enhancing HUVEC growth[J].Biotechnol Lett,2012,34(9):1765 -1771.
[20]杨英,杨军.含肝细胞生长因子(HGF)红色荧光融合蛋白基因质粒的构建[J].生物医学工程学杂志,2009,26(6):1286-1290.
[21]Stockinger A,Eger A,Wolf J,et al.E-cadherin regulates cell growthbymodulatingproliferation-dependentb-catenin transcriptional activity[J].J Cell Biol,2001,154(6):1185 -1196.
[22]Georgopoulos NT,Kirkwood LA,Walker DC,et al.Differential regulation of growth-promoting signalling pathways by E-cadherin[J].PLoS One,2010,5(10):13621 -13634.
[23]Li L,Bennett SA,Wang LS.Role of E-cadherin and other cell adhesion molecules in survival and differentiation of human pluripotent stem cells[J].Cell Adh Migr,2012,6(1):59 -70.
[24]Yonemura S.Cadherin-actin interactions at adherens junctions[J].Curr Opin Cell Biol,2011,23(5):515 -522.
[25]Yue Xiaoshan,Murakami Y,Tamai T,et al.A fusion protein N-cadherin-Fc as an artificial extracellular matrix surface for maintenance of stem cell features[J].Biomaterials,2010,31(20):5287-5296.
[26]Watt AJ,Garrison WD,Duncan SA.HNF4:A central regulator of hepatocyte differentiation and function [J].Hepatology,2003,37(6):1249-1253.
[27]Clevers H.Wnt/β-catenin signaling in development and disease[J].Cell,2006,127(3):469 -480.
- 中国生物医学工程学报的其它文章
- TEMPO-NaBr-NaClO体系对细菌纤维素的氧化过程研究

