糖化血清白蛋白试剂盒的抗干扰性能评价
张桂春,贾江花,沃燕波
(宁波美康生物科技股份有限公司,浙江 宁波 315104)
糖尿病(diabetes mellitus,DM)是一种全球性慢性疾病[1],临床工作中要使血糖全面长期达标,短期平均血糖的良好控制非常重要。GA是临床上血糖检测的指标,可反映机体2~4周内平均血糖水平[2,3],被认为能在血糖变化最显著时更确切和及时地反映血糖水平,对于评价糖尿病患者近期血糖控制情况及反映短期内血糖水平的变化具有较高的临床价值[4,5],已被纳入2011版中国血糖检测临床应用指南[6]。
试剂盒的抗干扰性能越来越受关注,对于临床实验室来说,抗干扰性能评价可以明确干扰物引起的结果差异。本实验的目的在于评价GA试剂盒的抗干扰性能,以指导样本的质量评定,从而避免因样品因素引起的检测结果的偏差[7],为临床检测提供一定的实验数据。
1 材料与方法
1.1 材料 仪器为HITACHI 7180型全自动生化分析仪,GA试剂盒由宁波美康生物科技股份有限公司提供,干扰物质 Vc、乳糜、Hb、CB和FB分别购于 Sigma、 华瑞制药有限公司、Amresco、Frontier scientific和J&K。
本实验所用血清样品来源于美康国宾健康体检中心健康体检者清晨空腹混合血清(乙肝、丙肝、HIV、梅毒四项阴性,血糖值正常,无溶血、黄疸和脂血)。将混合血清分装后,于-20℃冻存。使用时先常温下溶化,1 000 r/min离心5 min,取上清液。
1.2 方法
1.2.1 干扰血清的配制 Vc干扰样品的制备:先用去离子水制备600 mg/L的Vc溶液作为储存液,再以储存液为基础分别配制Vc系列浓度溶液,依次为 600、450、300、150、0 mg/L;然后再按稀释 20 倍的比例,与血清样本进行混合,得到系列浓度Vc干扰样品,分别对应 Vc浓度为 30、22.5、15、7.5、0 mg/L。
脂血干扰样品的制备:先用去离子水将乳糜干扰物(14500 FTU,定义为100%)配制成系列浓度溶液,依次为 100、75、50、25、0%;然后再按稀释 10倍的比例,与血清样本进行混合,得到系列浓度乳糜干扰样品,分别对应乳糜为1450、1087.5、725、362.5 、0 FTU。
血红蛋白干扰样品的制备:先用去离子水制备100 g/L的Hb溶液作为储存液,再以储存液为基础分别配制Hb系列浓度溶液,依次为100、75、50、25、0g/L;然后再按稀释20倍的比例,与血清样本进行混合,得到系列浓度Hb干扰样品,分别对应 Hb 浓度为 5、3.75、2.5、1.25、0g/L。
黄疸干扰样品的制备:(1)先用去离子水制备5.76 g/L的CB溶液作为储存液,再以储存液为基础分别配制CB系列浓度溶液,依次为5.76、4.32、2.88、1.44、0g/L;然后再按稀释 20 倍的比例,与血清样本进行混合,得到系列浓度CB干扰样品,分别对应 CB 浓度为 0.288、0.216、0.144、0.072、0 g/L。(2)用0.1mol/L的NaOH溶液制备4.0g/L的FB溶液作为储存液,再以储存液为基础分别配制FB系列浓度溶液,依次为 4.0、3.0、2.0、1.0、0g/L;然后再按稀释20倍的比例,与血清样本进行混合,得到系列浓度FB干扰样品,分别对应FB浓度为0.2、0.15、0.1、0.05、0 g/L。
1.2.2 操作 (1)在最佳仪器条件下,用GA试剂盒对上述样品进行检测,每个样品连续测定3次。(2)根据EP7-A2文件,为了平均系统漂移影响,样品的具体上机顺序:高值-低值,低值-高值,高值-低值。(3)所有干扰样品制备后,2h内上机检测。
1.2.3 数据处理 由于仪器或检测环境影响,产生的具有明显偏差的样品,应剔除,或重新进行测定。计算每个样品测定的平均值、标准差(s)和变异系数(CV),应CV≤10%,以保证干扰实验是在精密度在控的条件下进行。在CV≤10%在控的条件下,按照下面的公式,继续进行数据处理。回收率(%)=干扰样品的测定均值/对照样品的测定均值×100%。对照样品即干扰物含量为0的样品。当回收率≥110%或≤90%所对应的临界干扰样品浓度,即为GA试剂盒所能耐受的最大干扰。
2 结果
应用Excel软件对数据进行分析。GA试剂盒Vc、乳糜、Hb、CB和FB抗干扰剂量效应实验结果,见表1。
2.1 Vc对测试的干扰 当样品中Vc浓度≤30 mg/L时,对GA的测定可产生非线性的干扰。计算得到的回收率在±10%范围内,临床可接受。
2.2 乳糜对测试的干扰 当样品中乳糜浓度≤1450 FTU时,对GA的测定可产生非线性的干扰。计算得到的回收率在±10%范围内,临床可接受。

表1 GA试剂盒Vc、乳糜、Hb、CB和FB干扰实验
2.3 Hb对测试的干扰 当样品中Hb浓度≤5 g/L时,对GA的测定可产生非线性的干扰。计算得到的回收率在±10%范围内,临床可接受。
2.4 黄疸对测试的干扰 当样品中CB浓度≤288 mg/L,FB浓度≤200 mg/L时,均可对GA的测定可产生线性的干扰,其线性干扰方程分别为Y=-0.012X+15.26,R2=0.957; Y=-0.018X+15.16,R2=0.987。结果见图1和图2。当CB≤144 mg/L,FB≤100 mg/L时,计算得到的回收率±10%范围内,临床可接受。当CB≥144 mg/L,FB≥100 mg/L时,计算得到的回收率超过10%范围,超出临床可接受范围。同时,根据拟合曲线回归方程,干扰物在不同浓度的干扰度能够通过方程计算公式被估计。
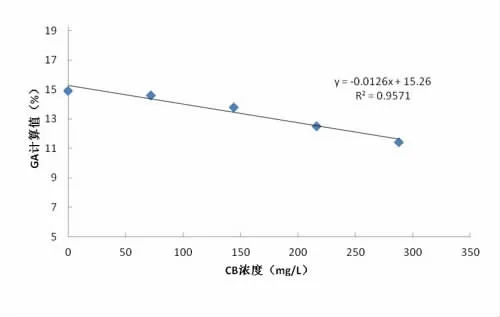
图1 CB对GA测定的干扰趋势
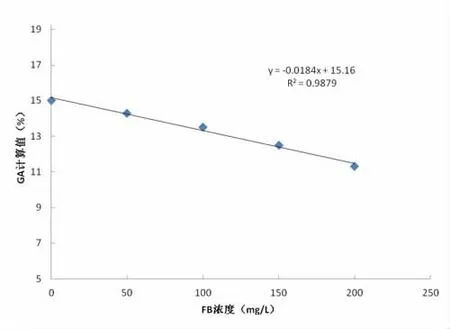
图2 FB对GA测定的干扰趋势
3 讨论
干扰物质主要来源于3个方面:内源性物质(人体血液中成分)、外源性物质(药物或其他相关代谢物)、样本污染物质(抗凝剂等),本研究对常见的干扰物质Vc、乳糜、Hb、CB和FB进行了评价。实验中,选取的干扰物的最高浓度为EP7规定的最高病理浓度[8],以便能够确定分析结果影响临床应用价值的可疑干扰物的最低浓度。干扰样本的准备方面,以添加物质以原血清基质的变化最小为原则,按照1:20的比例稀释,干扰物配成的一系列的浓度为实验浓度的20倍,空白对照样本通过添加溶媒制成,和实验样本同时测定。
本研究发现GA试剂盒在样品检测过程中,当CB≥288mg/L及FB≥200mg/L时对GA的测定会产生负干扰趋势,且均可产生线性干扰;当CB浓度≤144 mg/L,FB≤100 mg/L,其回收率在±10%范围内,为临床可接受范围,对检测结果没有明显影响。而Vc浓度≤30 mg/L,乳糜浓度≤1450 FTU,Hb浓度≤5 g/L,计算得到的回收率均在±10%范围内,为临床可接受范围,对测定结果没有影响。因此,GA试剂盒测定样本时,对Vc、乳糜、Hb的抗干扰能力完全能够满足临床需求。而CB浓度≤144 mg/L时,FB浓度≤100 mg/L时,计算得到的回收率均在±10%范围内,为临床可接受范围。综上,GA试剂盒具有较强的抗干扰性能,基本能够满足临床的需求。
[1]Negre-Salvayre A,Salvayre R,Auge N,et al.Hyperglycemia and glycation in diabetic complications[J].Antioxid Redox Signal,2009,11(12):3071-109.
[2]周健,李红,杨文英,等.糖化血清蛋白正常参考值的多中心临床研究[J].中华内科杂志,2009,48(6):469-472.
[3]巴建明,窦京涛,张小群,等.2型糖尿病患者液态酶法测定糖化血清白蛋白的临床观察[J].中华医学杂志,2009,89(22):1570-1572.
[4]Nagayama H.Inaba M,Okabe R,et al.Glycated albumin as an improved indicator of glycemic control in hemodialysis patients with type 2 diabetes based on fasting plasma glucose and oral glucose tolerance test[J].Biomed Pharmacother,2009,63(3):236-240.
[5]Lu L.Pu L.J Zhang,Q,et al.,Increased glycated albumin and decreased esRAGE levels are related to angiographic severity and extent of coronary artery disease in patients with type 2 diabetes[J].Atherosclerosis,2009,206(2):540-545.
[6]中华医学会糖尿病学分会.中国血糖监测临床应用指南(2011年版)[J].中国糖尿病杂志,2011,3(1):13-21.
[7]高杰,检验科应重视分析前标本因素对检验结果的影响[J].实验与检验医学,2012,30(5):461-462.
[8]CLSI.EP7-A2.Interference testing in clinical chemistry;Approved guideline Second edition[S].Clinical and Laboratory Standards Institute,2002.

