奶牛同期排卵定时输精技术的研究进展
胡路锋,刘贤侠*,杨恒,高树,王海涛,柳振国
(1.石河子大学动物科技学院,新疆石河子832003;2.新疆天康畜牧生物技术股份有限公司,新疆 乌鲁木齐830032)
奶牛同期排卵定时输精技术的研究进展
胡路锋1,刘贤侠1*,杨恒1,高树1,王海涛2,柳振国2
(1.石河子大学动物科技学院,新疆石河子832003;2.新疆天康畜牧生物技术股份有限公司,新疆 乌鲁木齐830032)
同期排卵定时输精技术目前已经在奶牛生产中应用,本文分析了该技术的原理及国内外的研究进展,根据我国奶牛业的养殖现状,提出了今后的研究方向。
奶牛;同期化排卵;定时输精
近年来随着奶牛业的发展,奶牛单产水平的逐步提高,奶牛的繁殖受胎变的越来越困难,产犊间隔延长,部分牛场超过450 d,严重影响了奶牛场的经济效益。目前同期排卵定时输精技术(Timed Artificial Insemination,TAI)已成为规模化牛场繁殖管理中重要内容之一。TAI是指使一群奶牛在同一时期内发情并排卵,不需要观察发情就能进行人工授精的技术,它是改进的同期发情技术,具有效果可靠,使用面广,效率更高的优点,有利于大型规模牧场采用。但是受多种因素的影响,我国各地使用该技术的效果不一,使用方法、对象及操作还存在许多问题。本文总结了近年来国内外该技术应用的进展供参考。
1 TAI原理
TAI技术以促性腺激素释放激素(GnRH)为基础,结合前列腺素(PG)、P4、雌激素(E2)、马(人)绒毛膜促性腺激素(eCG、HCG)等一起使用,最终使母牛同期化排卵,进行集中TAI。目前一般程序为第一次注射GnRH,诱导任何一次卵泡发育波中的卵泡排卵并形成黄体,GnRH注射在促进前一波卵泡排卵后又促进新一轮卵泡发育波的出现,7 d后注射PG溶解黄体,此时卵巢上存在一个来自第一次GnRH注射后产生的优势卵泡,该优势卵泡由于黄体溶解将继续发育,使母牛进入发情期,间隔2 d,在优势卵泡发育接近成熟时对母牛第二次注射GnRH以诱导卵泡排卵。最后在第二次GnRH注射后一定时间对母牛输精,这一技术在GnRH诱发排卵之前就已经调整了卵泡的成熟和黄体的退化,从而无需发情鉴定就可TAI。
2 TAI技术方案及效果
2.1 国内研究现状
2.1.1 使用传统常规方案的研究
滕勇[1]利用一次PG法,二次PG法和GnRH-PG-GnRH法诱导奶牛同期发情这些方法均要在观察发情后配种,受胎率分别为31.25%,41.94%和85.71%。GnRH-PG-GnRH法的受胎率明显高于其他两种方法。李启业等[2]用LHRH-A3对奶牛进行诱导发情,受胎率为87.5%。姚国良[3]采用Ovsynch程序(即对母牛先用GnRH处理,7 d后注射PG,48 h后再注射一次GnRH,第2次注射GnRH后18~20 h输精),分别对乏情奶牛、卵巢静止奶牛及正常发情奶牛进行试验,显示乏情奶牛情期受胎率为74%,高于常规配种49.8%的受胎率;卵巢静止奶牛的治疗有效率为97.2%,情期受胎率为64%;产后正常发情奶牛应用定时输精程序处理后,其情期受胎率分别提高了21%和25.3%。刘念锐等[4]选择产后80 d左右,长期不发情,直肠检查卵巢多为静止、持久黄体、卵巢囊肿等状况奶牛119头,采用Ovsynch程序处理,得到37%的妊娠率,高于常规处理牛群25%的妊娠率。阿布力孜等[5]使用GnRH和PG处理,经产牛的受胎率为71.4%;后备牛的受胎率为75.0%,二者之间无显著差异。凌明湖等[6]对产后32~144 d乏情奶牛和屡配不孕奶牛定时输精,结果乏情奶牛第一情期受胎率为37.5%、下一情期受胎率为50%,分别比该场2008年的实际生产水平高7.5%和6.1%。屡配不孕奶牛第一情期受胎率为37.5%、下一情期受胎率为60%,分别比该场2008年的实际生产水平高7.5%和16.1%。
2.1.2 使用常规方案与孕酮阴道栓(CIDR)相结合方案的研究
高庆华等[7]利用孕激素海绵栓-孕马血清(PMSG)-PG方案(图1)即先用孕激素通过阴道栓处理7 d,结束时注射PG,结果同期发情率达到75%,48 h同期率达到62.15%,受胎率达到44.14%。黄开华等[8]利用GnRH—PG—GnRH法及增加孕酮缓释剂的方法,都得到了约50%的受胎率,结果表明1胎牛效果最好,达55%,5胎及5胎以上牛只有20%左右的受胎率。
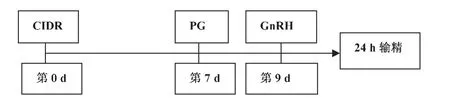
图1
2.2 国外研究现状
2.2.1 使用常规方案的研究
为了确定TAI的最佳时机,Pursley等[9]比较了GnRH二次处理后第0 h、8 h、16 h、24 h、32 h输精的受胎率,结果表明,GnRH二次处理后第16 h受胎率(44%)最高,第32 h受胎率最低。这可能是第32 h实施TAI时已发生排卵,待精子获能后,卵子的受精能力已降低,因此TAI在二次处理后第16 h实施最好。Geary等[10]做了Ovsynch和CO-Synch方案的对比研究,CO-Synch方案进行了少许改进,与Ovsynch方案的激素注射程序完全相同,但是牛在第9 d注射GnRH时就TAI,结果Ovsynch方案牛的妊娠率为57%,明显高于使用CO-Synch方案牛49%的妊娠率,可能是由于用Ovsynch方案处理的母牛输精时间与排卵时间更接近的缘故。
Martinez等[11]在注射GnRH后,观察第一个卵泡活动波的优势卵泡排卵之后的第3 d、第6 d和第9 d诱导母牛卵泡波出现的能力,发现只有那些对处理发生反应的母牛可以诱导出现新的卵泡波,并且在处理后的第7 d有74%的奶牛存在一个优势卵泡,其中85%的优势卵泡大于9 mm并有排卵能力,说明奶牛在GnRH处理后7 d出现了优势卵泡。
Moreira等[12]认为TAI理想的处理阶段应该是母牛处于发情周期的5~10 d。因为在发情早期,自发性排卵已经发生而潜在的优势卵泡太小,对注射GnRH的反应不足以诱导排卵,因此在第二次注射GnRH时,优势卵泡可能已经退化,退化的优势卵泡不发生排卵,即使排卵最终受精率也比较低,因此奶牛在发情早期应用Ovsynch程序的妊娠率可能很低。
Brusveen等[13]对一牛群集中注射GnRH,7 d后注射PG,然后分别按以下方案处理(图2):(1)注射PG后48 h注射GnRH同时进行TAI(Cosynch-48);(2)注射PG后56 h注射GnRH,然后在16 h之后TAI(Cosynch-56);(3)注射PG后72 h注射GnRH同时进行TAI(Cosynch-72),在人工授精后31~33 d利用超声进行妊娠诊断,52~54 d再次进行妊娠诊断。Cosynch-48妊娠率为29.2%,Cosynch-72妊娠率为25.4%,Cosynch-56的妊娠率最高,达到38.6%。
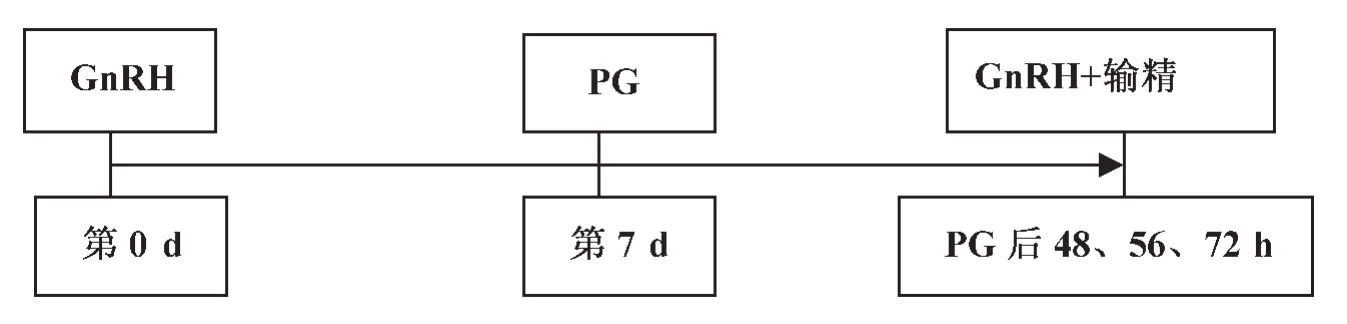
图2
Ahujaa、Stevenson、Bartolome等[14-16]在各自的研究中,使用常规的Ovsynch方案都得到了50%左右的受胎率。Burns等[17]研究了TAI方案中用HCG替换GnRH的同期化排卵效果(图3)。结果表明,不同剂量的HCG与GnRH在排卵反应方面的效果相近,在一定情况下可以代替GnRH。

图3
2.2.2 使用常规方案与孕酮阴道栓相结合方案的研究
Evaluation of micro environment and comfort of civil aviation cabin in China
Geary[18]采用CO-Synch方案得到52%的妊娠率,与Ovsynch方案54%的妊娠率相比,差异不显著,当把CIDR加入到这个方案中时(图4),妊娠率从48﹪提高到59%。
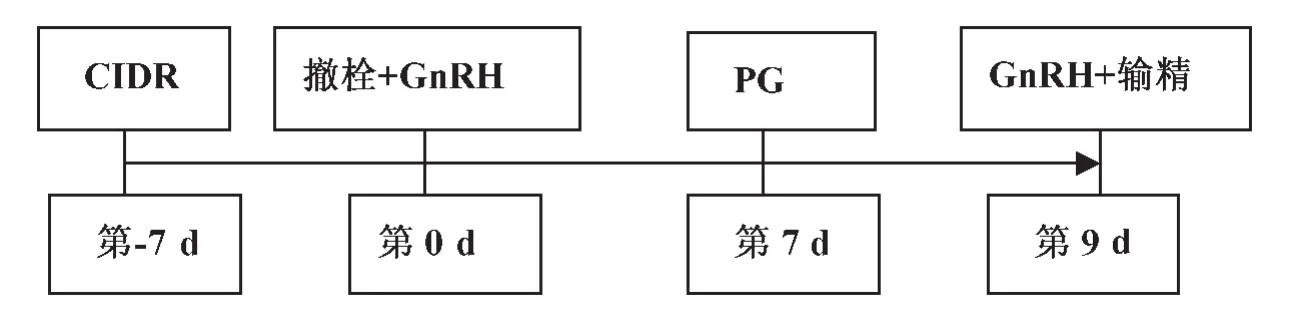
图4
Mialot等[19]在实验中采用PRID-PGF2α-GnRH(图5)和PRID-PGF2α-PMSG(图6)方案,受胎率分别为44.7%和53.8%。
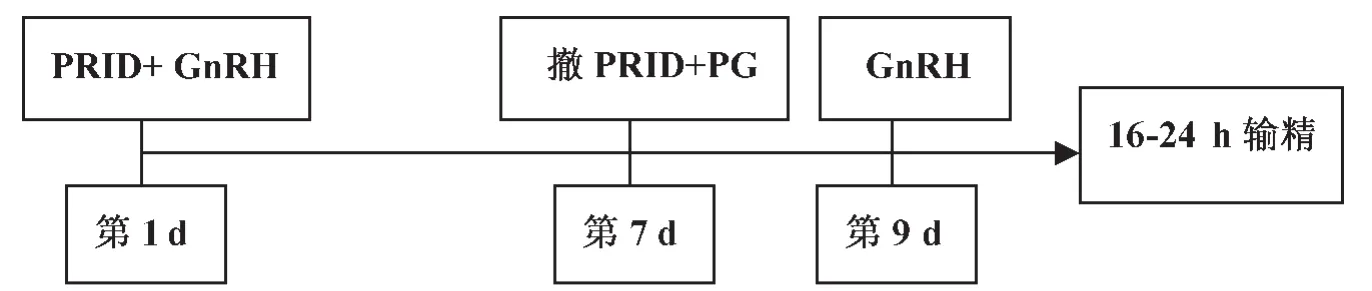
图5
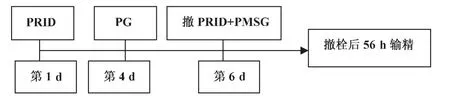
图6
Larson等[20]为了研究发情鉴定对TAI的影响,及在以GnRH为基础的方案中增加CIDR能否提高生殖力,采用5种方案进行试验。(1)对照组先埋栓7 d,去栓同时给予PG,注射PG后观察发情并人工授精。如果没有观察到发情,则在84 h注射GnRH并TAI;(2)GnRH处理后7 d注射PG,接着在60 h后第二次注射GnRH并TAI;(3)在第2种方案基础上增加CIDR,即在第一次注射GnRH与PG之间;(4)GnRH处理后7 d注射PG,然后观察发情并人工授精,如果没有观察到发情,则在84 h注射GnRH并TAI;(5)第4种方案增加CIDR,在第一次注射GnRH与PG之间。结果第5种方案的妊娠率为58%,第3种方案的妊娠率为54%,第4种方案的妊娠率为53﹪,对照组的妊娠率为53%,而第2种方案仅为44%。
Busch等[21]改变常规TAI程序中CIDR的处理方式(图7),即在GnRH处理前23 d置入CIDR,14 d后撤栓,实验组与对照组分别于注射PG后72 h、54 h第二次注射GnRH并TAI。结果实验组的情期受胎率为62%,高于对照组的47%。该研究表明提前用CIDR处理或延长处理时间,能够提高母牛受胎率。

图7
Small等[22]研究了在降低孕酮剂量情况下CIDR和eCG的使用效果(图8),结果表明:低剂量的孕酮有增加大卵泡的直径和响应GnRH的排卵等作用,但它并不能提高TAI的受胎率,所以经产牛一般不需使用CIDR,但对一些乏情牛可以选择使用;而在第7 d注射PG的同时注射eCG,可促进卵泡发育,提高初产牛的受胎率,但对经产牛无明显作用。
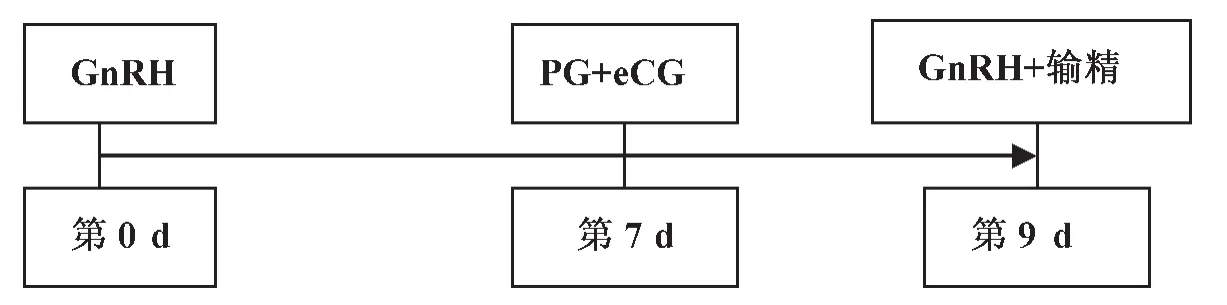
图8
Bridges等[23]对“CO-Synch+CIDR”方案进行了改进,即在注射GnRH后5 d用PG处理,12 h后第二次注射PG,在第二次注射PG 60 h后TAI。结果母牛受胎率提高了9.1%~13.3%,但由于该方案改变因素较多,究竟是哪种因素导致了受胎率的提高还有待研究。
3 今后研究的方向及改进措施
3.1 研究不同地区气候及管理条件下奶牛排卵规律
奶牛卵泡的发育是个复杂的生理过程,卵泡波主要与血液中FSH浓度有关,随着卵泡的生长,FSH浓度逐渐下降。此时,LH脉冲性释放可以促进卵泡的继续生长以及E2的产生。随着优势卵泡的生长,E2分泌也加强,当血液中有足够的E2来诱导出现LH峰时,引起了优势卵泡排卵[24]。通过采集血液进行分析可以判断母牛发情周期及其卵泡的生长状态。但是常规的采血需要多次保定,并且对牛的应激也较大,而应用连续遥控采血装置可以解决这个难题,国内对该装置应用于奶牛TAI排卵时间的研究尚未见报道。国外用近红外线装置测量后躯和臀部温度差变化等研究发情和排卵规律,因此这些方面还有待研究。
3.2 应用B超监测确定合适的输精时间
在使用激素处理后,母牛的黄体、卵泡都会发生相应的变化,使用B超检查,可以相对准确判断此时黄体和卵泡的状态,以便决定是否适合输精。McArt等[25]对比研究了普通TAI方案和与超声结合的TAI方案对奶牛繁殖力的影响。结果表明,使用超声检测的方案能够提高奶牛的繁殖力,并且在牛群中运用超声检测还可提高发情检测率,使奶牛产犊间隔缩短,减少了直肠触摸和激素注射的次数,同时降低了生产成本。这些方面国内应深入研究。
3.3 与发情鉴定结合,根据不同地域饲养方式,分析出集中发情时间分布规律,以提高受胎率
Larson等[20]在激素处理前10 d开始收集待处理牛的血清样品,以确定该牛所处的发情周期阶段。研究中发现,同样处理条件下,进行发情鉴定后再TAI母牛的受胎率更高。但是进行发情鉴定又增加了工作量,与TAI程序的目的相悖。所以我们需要在不增加工作量的情况下进行发情鉴定。在Walsh等[26]的研究中就选择了计步器作为判断母牛是否发情,因为在排卵前72~16 h,母牛活动量会逐渐增加,从16 h开始突然增加,并持续发情。此外,不同规模的牛场和不同饲养条件下,应根据饲养方式、牛的品种、环境条件的不同,研究不同地域条件下TAI中输精的合适时间。TAI基本程序适用于产后70 d不发情或初检空怀牛,第2次注射GnRH前可以先直肠检查或B超检查鉴定卵泡,若无卵泡则视为无效,体况差的或患病牛不宜使用,第2次注射GnRH后配种时间有一定的变化,要以当地的临床研究规律为准。
3.4 TAI前预处理提高情期受胎率
在TAI前进行预处理可以促进子宫复旧,恢复其正常功能,也就间接地调节了卵巢的功能与活性。尤其对于那些因为观察不到位等人为原因造成的产后发情率低,而牛群的子宫、卵泡、体况尚可的情况下,使用预处理TAI方案能够产生明显的经济效益。预处理方案一般选择PG处理,即在分娩后39 d注射PG,14 d后再注射一次。第2次注射PG,牛开始表现发情时进行配种。第2次注射PG的12~14 d之后,没有观察到牛发情,就可使用同期化排卵技术。使用PG预处理不但能够调节卵巢的正常功能,促进优势卵泡发育、成熟、排卵,同时还能在一定程度上起到净化子宫作用,减少了子宫疾病的发生。张明辉等[27]应用PG结合GnRH的预同步定时输精程序,在奶牛产后35~40 d开始处理,奶牛产后80 d的参配率和情期受胎率分别达到92.6%和46.7%,产后80 d和产后180 d总受胎率分别达到43.3%和93.5%,预处理方案适用于产后70 d发情率较差的大中型牧场,能够提高产后75 d参配率,取得良好效果。因此预处理方案可以在规模化奶牛场中推广应用。
3.5 重视配后保胎管理可提高受胎率
奶牛胚胎死亡经常发生于妊娠早期,据报道[28],奶牛1个月内的早期胚胎死亡率可达38%,高产奶牛更高。适当的营养水平和良好的饲养管理可以减少胚胎早期死亡。高树等[29]认为可根据临床实际情况在配后5~7 d、15~17 d分别对高产奶牛采取保胎措施,每次注射黄体酮100 mg或HCG 1 500~2 000 IU。也可用LH保胎。钟寿坤[30]使用LH对青年牛处理,使流产率下降50%多,效果明显。在使用药物或激素保胎同时,还应加强妊娠母牛的管理,防止其他外部因素造成的流产。
3.6 调查分析牛场繁殖存在的主因,提高饲养管理水平
在生产中,动物的繁殖机能受很多因素的影响,同样品种、年龄、体况、卵巢发育状态及地区、气候等因素都会影响TAI的处理效果,因此要调查分析出牛场繁殖问题的主要原因,尤其要做好奶牛围产期的保健、繁殖机能监控和饲养管理。奶牛夏季炎热天气对其应激较强,在夏季处理效果可能较差。因此需要注意奶牛的防暑降温。日粮也要平衡,不能造成奶牛过肥或过瘦,或者一些微量元素缺乏,这些都会影响奶牛繁殖性能。
4 小结
TAI技术的最大价值在于提供了一种有效的奶牛群体繁殖调控手段,减少了空怀时间,缩短了产犊间隔,简化了操作流程更利于大群的操作。在实际生产中,为了使TAI程序获得较高的受胎率还应提高奶牛的饲养管理水平,优化激素药物的处理方案、注意工作的细节问题(包括注射药物是否过期、注射针头的长度、牛的体况、注射方式以及注射的时间),也应注意繁殖资料的记录和分析,培训提高TAI程序实施人员的理论和技术素质,逐步完善规范化的操作并具体落实,注重营养及环境等饲养管理因素对受胎率的影响,TAI技术的应用才会效果更好。
[1]滕勇.GnRH、PGF2a诱导奶牛同期发情效果的比较[J].黄牛杂志,2002,28(5):1-2.
[2]李启业,马占海,阿增仁.用GnRH类似物提高大通奶牛情期受胎率试验[J].青海畜牧兽医杂志,2007,37(1):26-27.
[3]姚国良.定时输精程序(Ovsynch/TAI)在奶牛繁殖上的应用效果[J].中国奶牛,2008,(12):33-35.
[4]刘念锐,司永,黄峰,等.同期化排卵—定时输精技术在牛场的应用[J].黑龙江动物繁殖,2011,19(5):48-49.
[5]阿布力孜·吾斯曼,亥尼拜·玉苏音,热依木江·艾孜木,等.母牛同期化排卵定期输精法的初步研究[J].中国草食动物,2008,28(2):35-37.
[6]凌明湖,王定法,刘晓华,等.奶牛定时输精程序在武汉的应用[C].中国奶业协会第24次繁殖学术年会暨国家奶牛/肉牛产业技术体系第一届全国牛病防治学术研讨会论文集,2009:131-133.
[7]高庆华,何良军,马宾详,等.不同方法对受体母牛诱导发情效果的比较[J].中国草食动物,2006,26(1):16-17.
[8]黄开华,陈江,张长号,等.同期化排卵-定时输精技术在奶牛繁殖中的应用[J].黑龙江动物繁殖,2010,18(6):50-51.
[9]Pursley JR,Kosorok MR,Wiltbank MC.Reproductive management of lactating dairy cows using synchronization of ovulation[J].Dairy Sci,1997,80(2):295-300.
[10]Geary TW,Whittier JC.Effects of a timed insemination following synchronization of ovulation using the Ovsynch or Co-Synch protocol in beef cows[J].Anim.Sci,1998,(14):217-220.
[11]Martinez MF,Adams GP,Bergfelt DR,et al.Effect of LH or GnRH on the dominant follicle of the first follicular wave in beef heifers[J].Anim Reprod Sci,1999,57(1-2):23-33.
[12]Moreira F,Diaz T,Thatcher WW,et al.Effect of day of the estrous cycle at the initiation of a timed artificial insemination protocol on reproductive responses in dairy heifers[J].Anim Sci,2000,78(6):1568-1576.
[13]Brusveen DJ,Cunha AP,Silva CD,et a1.Altering the time of the second gonadotropin-releasing hormone injection and artificial insemination(AI)during Ovsynch affects pregnancies per AI in lactating dairy cows[J].Dairy Sci,2008,91(3):1044-1052.
[14]Ahujaa C,Montiela F,Cansecoa R,et a1.Pregnancy rate following GnRH+PGF2atreatment of low body condition,anestrous Bos taurus by Bos indicus crossbred cows during the summer months in a tropical environment[J].Anim Reprod Sci,2005,(87):203-213.
[15]Stevenson JS,Cartmill JA,Hensley BA,et a1.Conception rates of dairy cows following early not-pregnant diagnosis by ultrasonography and subsequent treatments with shortened Ovsynch protocol[J].Theriogenology,2003,60(3):475-483.
[16]Bartolome JA,Silvestre FT,Kamimura S,et a1.Resynchronization of ovulation and timed insemination in lactating dairy cows I:Use of the Ovsynch and Heatsynch protocols after non-pregnancy diagnosis by ultrasonography[J].Theriogenology,2005,63(6):1617-1627.
[17]Burns MG,Buttrey BS,Dobbins CA.et a1.Evaluation of human chorionic gonadotropin as a replacement for gonadotropin-releasing hormone in ovulation-synchronization protocols before fixed timed artificial insemination in beef cattle[J].Anim Sci,2008,86(10):2539-2548.
[18]Geary TW,Whittier JC,Hallford DM,et a1.Calf removal improves conception rates to the Ovsynch and Co-Synch protocols[J].Anim Sci,2001,79(1):1-4.
[19]Mialot JP,Constant F,Dezaux P,et a1.Estrus synchronization in beef cows:comparison between GnRH+ PGF2α+GnRH and PRID+PGF2α+eCG[J].Theriogenology,2003,60(2):319-330.
[20]Larson JE,Lamb GC,Stevenson JS,et a1.Synchronization of estrus in suckled beef cows for Detected estrus and artificial insemination and timed artificial insemination using gonadotropin-releasing hormone, prostaglandin F2a,and progesterone[J].Anim Sci,2006,84(2):332-342.
[21]Busch DC,Wilson DJ,Schafer DJ,et a1.Comparison of progestin-based estrus synchronization protocols before fixed-time artificial insemination on pregnancy rate in beef heifers[J].Anim Sci.2007,85(8): 1933-1939.
[22]Small JA,Colazo MG,Kastelic JP,et a1.Effects of progesterone presynchronization and eCG on pregnancy rates to GnRH-based,timed-AI in beef cattle[J].Theriogenology,2008,71(4):698-706.
[23]Bridges GA,Helser LA,Grum DE,et a1.Decreasing the interval between GnRH and PGF2afrom 7 to 5 days and lengthening proestrus increases timed-AI pregnancy rates in beef cows[J].Theriogenology, 2008,69(7):843-851.
[24]Wiltbank MC,Gumen A,Sartori R.Physiological classification of anovulatory conditions in cattle[J]. Theriogenology,2002,57(1):21-52.
[25]McArt JA,Caixeta LS,Machado VS,et a1.Ovsynch versus Ultrasynch:reproductive efficacy of a dairy cattle synchronization protocol incorporating corpus luteum function[J].Dairy Sci,2010,93(6):2525-2532.
[26]Walsh RB,LeBlanc SJ,Duffield TD,et a1.Synchronization of estrus and pregnancy risk in anestrous dairy cows after teatment with a progesterone-releasing intravaginal device[J].Dairy Sci,2007,90(3): 1139-1148.
[27]张明辉,吴谢华,王建勇.预同步定时输精程序对提高奶牛产后繁殖效率的效果观察[J].中国奶牛,2012,(20):35-37.
[28]赵兴绪.兽医产科学(第4版)[M].北京:中国农业出版社,2009,264-267.
[29]高树,刘贤侠,王建梅,等.新疆规模化奶牛场奶牛胚胎死亡率高的主要原因及预防措施[J].新疆畜牧业,2011,(4):35-37.
[30]钟寿坤.使用LH保胎的效果观察[J].中国奶牛,2003,(5):48.
Study on Ovulation-Synchronization Timed Insemination in Dairy Cows
HU Lu-feng1,LIU Xian-xia1*,YANG Heng1,GAO Shu1,WANG Hai-tao2,LIU Zhen-guo2
(1.College of Animal Science,Shihezi University,Shihezi 832003,China; 2.Xinjiang Tiankang Animal Husbandry Biotechnology Limited Liability Company,Urumqi 830032,China)
The Synchronization of ovulation-timed insemination has been used in dairy farms.In our review, the principle of the technology and relative research progress at home and abroad were analyzed throughly. Meantime,according to our nation’s current situation in dairy industry,the direction of our future research was indicated in the end.
dairy cows;synchronization of ovulation;timed artificial insemination
S814.4
A
1003-6377(2013)03-0001-07
2013-02-11
国家科技支撑计划子课题“奶牛标准化规模养殖饲草料高效利用和管理技术集成与示范”(2012BAD43B01);石河子大学科技服务团队项目“规模化奶牛场规范养殖技术应用与推广”(kjfwtd2011-03)
胡路锋(1988-),男,在读硕士,研究方向:动物生殖调控与产科疾病。
刘贤侠(1970-),男,副教授,主要从事兽医外产科学的教学和科研工作。

