聚乳酸/双亲性葡聚糖中空纳米囊泡包载亲水性药物及释放
龙丽霞,原续波,钱小敏,柳朝永,张志华,盛 京
聚乳酸/双亲性葡聚糖中空纳米囊泡包载亲水性药物及释放
龙丽霞1,2,原续波1,2,钱小敏1,2,柳朝永1,2,张志华1,2,盛 京1,2
(1. 天津大学材料科学与工程学院,天津 300072;2. 天津市材料复合与功能化重点实验室,天津 300072)
亲水性药物包载是缓释纳米微粒制备的难点,通过共透析胆固醇改性葡聚糖和聚乳酸得到表面多糖修饰的中空纳米囊泡,在透析过程中以氯化钆溶液代替水相,所得纳米囊通过透射电子显微镜观察和热失重分析测试,证明氯化钆可包载于中空纳米囊泡的亲水性内核,且在纳米囊泡壁形成微孔道.将此纳米囊对亲水性药物头孢拉定反透析,药物通过微孔道扩散进入内核得到载药纳米囊.药物释放研究表明,纳米囊泡使亲水性药物持续释放24,h以上,具有缓慢释放的特性.
聚乳酸;双亲性葡聚糖;中空纳米囊;亲水性药物;缓释
囊泡是两亲性分子有序组合体的一种形式[1],它是由密闭双分子层所形成的球形或者椭球形的单室或者多室类的缔合结构.与胶束相比,囊泡具有很多的优势:囊泡具有很大的比表面积,可以吸附比胶束更多的反应物;而且囊泡双层膜具有很强的刚性,可以增溶大的药物分子或酶;另外其表面电荷更多且电性可以通过改变组成来调节,使电场更强,因此在应用方面有巨大的潜力.囊泡一般由小分子表面活性剂聚集形成,但近20年来,由双亲性高分子通过自组装形成的囊泡越来越受到关注,与小分子表面活性剂形成的囊泡相比,高分子囊泡具有稳定性好、结构和尺寸可控等优点,已被广泛应用于生物、催化、生态、食品及环境领域.
近年来,由天然高分子或可生物降解性高分子材料制备的囊泡由于其优良的生物相容性和无免疫原性被越来越多地用于药物载体的研究[2-4].迄今为止,高分子微囊泡包载的大部分是疏水性药物,如紫杉醇[5]、阿霉素[6]等,用以改变这些药物在血液中的稳定性及其组织分布,降低其毒副作用,用于亲水性小分子药物的研究却不多见.事实上,一些亲水性药物经静脉进入血液后会与蛋白结合或发生分解,从而降低药效,影响治疗效果,如顺铂被广泛应用于头颈癌、食道癌、恶性淋巴瘤、乳腺癌等多种癌症的治疗,据研究,超过65%~98%的顺铂进入血液后与血蛋白共价结合[7],使其抑瘤活性显著降低[8].因此,寻求并开发包载和控释亲水性药物载体具有重要的临床价值.
本课题组前期以胆固醇改性的葡聚糖和聚乳酸为原料,通过内界面沉积法制备了可生物降解纳米囊泡[9],本文中以此纳米囊泡为载体预载GdCl3,以头孢拉定为模型药物,将包载GdCl3的纳米囊泡对头孢拉定药液反透析,通过渗透增强作用制备包载亲水性药物的可生物降解的纳米囊泡,并研究了其缓释行为,为亲水性药物的包载提供了一条新途径.
1 实 验
1.1 实验原料
聚乳酸(PDLLA,相对分子质量3×104)购自山东医疗器械研究所;葡聚糖(Dextran,相对分子质量4×104)购自Amersham Biosciences,Sweden;丁二酸酐(分析纯)购自天津市福晨化学试剂厂产品;氯化钆(GdCl3)购自北京泛德辰科技有限公司;胆固醇(分析纯)购自上海化学试剂有限公司,经重结晶提纯后备用.注射用头孢拉定购自华北制药集团有限责任公司;氯化亚砜及二甲基亚砜(DMSO)均为分析纯,购自天津科威化学试剂厂;实验中所用其他试剂均为分析纯.
1.2 实验方法
1.2.1 胆固醇改性葡聚糖(Chol-DEX)的合成
将1,g胆固醇溶解于30,mL的吡啶中,加入1,g丁二酸酐.溶液在70,℃下搅拌3,h,待反应结束后减压蒸馏将吡啶蒸出,粗产品溶解在少量的水/无水乙醇(1∶10)的溶液中,加热到50~70,℃,趁热过滤,将滤液置于冰水浴中重结晶,过滤得到胆固醇-丁二酸酯,50,℃真空干燥.
称取306,mg(0.628,9,mmol)胆固醇-丁二酸酯溶于20,mL干燥的三氯甲烷中,量取摩尔数10倍过量于胆固醇-丁二酸酯的氯化亚砜溶于5,mL三氯甲烷中,然后加入到恒压漏斗中,缓慢滴加到反应体系中.滴加完毕后,将体系升温至60,℃,反应5,h结束.将反应产物旋蒸,蒸出过量未反应完的二氯亚砜和三氯甲烷,得到淡绿色黏稠状液体,然后加入5,mL三氯甲烷定容,得到0.085,mmol/mL的胆固醇-丁二酸酯酰氯的三氯甲烷溶液.
称取300,mg葡聚糖溶解于60,mL二甲基亚砜中.将反应容器中滴加8、9滴三乙胺.量取4.5,mL胆固醇-丁二酸酯酰氯置于恒压滴液漏斗中.将反应体系中通入氮气,然后开始缓慢滴加胆固醇-丁二酸酯酰氯,将体系恒温80,℃,反应7,h,待反应结束以后,停止加热,反应产物在水中透析72,h后冷冻干燥,得到白色蓬松固体.产物结构通过红外光谱和核磁共振分析,胆固醇的取代度(每100个葡聚糖结构单元中胆固醇的含量)为8.2%.
1.2.2 聚乳酸/胆固醇改性葡聚糖(PDLLA/Chol-DEX)纳米囊泡的制备
称取30,mg Chol-DEX和30,mg PDLLA共同溶解于6,mL DMSO中,在磁力搅拌器上搅拌至完全溶解,并搅拌过夜使两者充分混合,将所得高分子溶液装入截流相对分子质量为1,400的透析袋中对500,mL去离子水透析,前3,h每小时换一次水相,随后的12,h每3,h换一次水相,余下的时间内每8,h换一次水相.透析结束后将产物冻干备用.
1.2.3 聚乳酸/胆固醇改性葡聚糖(PDLLA/Chol-DEX)载药纳米囊泡的制备
将上述纳米囊泡置于20,mL头孢拉定溶液中(质量分数为10%)孵化24,h,然后对1,000,mL去离子水透析4,h,除去未包载的头孢拉定,将所得纳米囊泡溶液从透析袋中取出冻干,得到表面吸附头孢拉定的载药纳米囊泡.
称取30,mg Chol-DEX和30,mg PDLLA共同溶解于6,mL DMSO中并充分混合后,所得高分子溶液装入截流相对分子质量为1,400的透析袋中对500,mL去离子水透析4,h后,将水相更换为质量分数为2%的GdCl3溶液,继续透析40,h(其间更换两次GdCl3溶液),将透析袋取出,立即放入到20,mL头孢拉定溶液中(质量分数为10%)孵化24,h,然后对1,000,mL去离子水透析4,h,每小时换一次去离子水,以除去未包载的头孢拉定,将所得纳米囊泡溶液从透析袋中取出冻干,得到包载头孢拉定的载药纳米囊泡.
1.2.4 纳米囊泡表征
将冻干所得的纳米囊泡在去离子水中分散均匀后,以激光粒度仪(BI-90,Plus)测定纳米囊泡的粒径与粒径分布.测试条件:25,℃,散射角为90°,波长635.0,nm.每一个样品都重复3次,取平均值.
取纳米囊泡的去离子水溶液,将样品滴至喷有碳膜的铜网上,室温挥发干燥后以透射电子显微镜(TEM,JEOL-100CXⅡ型)观察纳米囊泡的形貌.
1.2.5 纳米囊泡载药率测定及药物释放
称取2,mg冻干后的载头孢拉定囊泡溶于5,mLPBS溶液中,超声(400,W)以破坏囊泡结构,20,000,r/min高速离心30,min,取上清液;沉淀物中再次加入5,mL PBS溶液,离心取上清液.此过程重复3次,将所取上清液合并,在260,nm处测得药物的吸光度值.依据标准曲线计算药物含量,计算微粒载药率,即

式中:mi为药物质量;mj为聚合物质量.
按下述方法进行载药纳米囊泡的药物释放:称取冻干后的载头孢拉定的囊泡10,mg,均匀分散于5,mL pH值为7.4的PBS溶液,装至事先溶胀的透析袋中(截留相对分子质量1,400),对30,mL PBS溶液透析,释放体系在恒温水浴摇床中模拟体内环境摇动,转速75,r/min,温度37,℃.在特定的时间间隔(20,h每隔1,h)取样,将透析袋的外介质倒出并换以新的等体积的PBS溶液,始终保持同样的浸泡环境,取出的PBS溶液用UV-Vis分光光度计测定在260,nm处的吸收,并通过标准曲线计算药物释放量.
2 结果与讨论
聚合物微囊泡通常由双亲性高聚物通过自组装形成,组装过程中亲水性的极性头与周围水环境接触,而疏水部分组成了双层的内部结构,并形成疏水性微区[10-11],当作为药物载体时,疏水性药物通常通过扩散进入这些微区,从而与体液的亲水性环境隔离,提高疏水性药物的稳定性[12].相分离法是制备中空微囊的另一种方法,Atkin等[13]通过微相分离和内界面沉积法制备了聚四氟乙烯/聚甲基丙烯酸甲酯中空微囊,本课题组前期研究[9]发现,以Chol-DEX和疏水性可生物降解高聚物PDLLA共透析时,两者在自组装初始阶段形成由双亲性多糖和聚乳酸构成的胶束,随着透析过程Chol-DEX与PDLLA发生相分离,大部分Chol-DEX扩散至胶束表面,少部分Chol-DEX因胆固醇侧基与PDLLA相互作用滞留于胶束内部,胶束衍变为表面覆盖Chol-DEX、内核由溶胀的PDLLA聚乳酸和Chol-DEX组成的具有核/壳结构的微粒,继续去溶剂化使PDLLA在微粒内界面沉积,从而形成中空微囊泡结构(图1(a)、(b)).

图1 Chol-DEX/ PDLLA纳米囊泡的透射电镜照片及其结构示意Fig.1 TEM images and schematic diagram of Chol-DEX/ PDLLA nanocapsules
微囊泡(包括脂质体)被认为是药物的良好载体,如阿霉素脂质体被FDA批准上市、紫杉醇脂质体已被应用于临床治疗卵巢癌、非小细胞肺癌和乳腺癌,但是迄今为止大多数微囊泡被用于包载疏水性药物.聚合物微囊泡往往由双亲性高分子通过自组装过程形成,这种自组装过程包括去溶剂法[14]、层-层静电自组装法[15],文献[16]还报道了改变pH值诱发的自组装和氢键诱发的自组装微囊泡.对于通过去溶剂法和透析法形成的药物载体体系,自组装过程往往在水相中进行,对亲水性药物的包载率一般较低或者难于包载,而且在自组装过程中,水相与聚合物的质量比可能达到103~104,水溶性药物即使能载入微囊,其包封效率(被包封入微囊的药量/总投药量)也会非常低,因而会浪费大量药物.
迄今为止可成功用于亲水性药物包载的技术有层-层静电自组装技术,亲水性药物(如布洛芬、地塞米松、消炎痛和利尿磺胺)以微晶方式存在于非溶剂中,表面通过正负荷电性高分子层-层自组装包封药物微晶,形成亲水性药物的控释体系[15].另一种成熟的包载亲水性药物的方法是复乳法,如以聚乳酸为原料,以W/O/W的方式制备亲水性载药微囊[17],但是上述两种方法制备的载药微粒多在微米级,粒径较大,不适于静脉给药.本课题所用的双亲性多糖和PDLLA制备的中空微囊,平均粒径在228,nm,可用于静脉给药注射.
Tiourina等[18]以静电层-层自组装法制备聚丙烯胺/聚苯乙烯磺酸微囊泡,通过调控pH<4改变高分子相互作用,在囊壁上形成微孔,使糜蛋白酶易于进入微囊液核,然后调控pH>8使微孔闭合,得到包载亲水性蛋白的微囊泡,其蛋白包封率可达到100%.先制备包载GdCl3的PDLLA/Chol-DEX微囊泡,此囊泡对药液反透析时由于微囊膜内外的浓度(或离子强度)差使GdCl3向外扩散,并在囊壁形成微孔,有利于药液向纳米囊内核的扩散和渗透,最终形成包载亲水性药物的纳米囊泡.但将PDLLA和Chol-DEX共溶于DMSO中直接对GdCl3溶液透析时难以得到稳定的微粒,这可能由于高盐溶液使Chol-DEX在水中溶解度变差,难以形成稳定胶束.在纳米囊形成之后将冻干纳米囊与GdCl3共孵育24,h也难于看到GdCl3进入纳米囊内核(图2(a)),这是由于疏水性的PDLLA阻止了GdCl3向纳米囊内核的扩散.
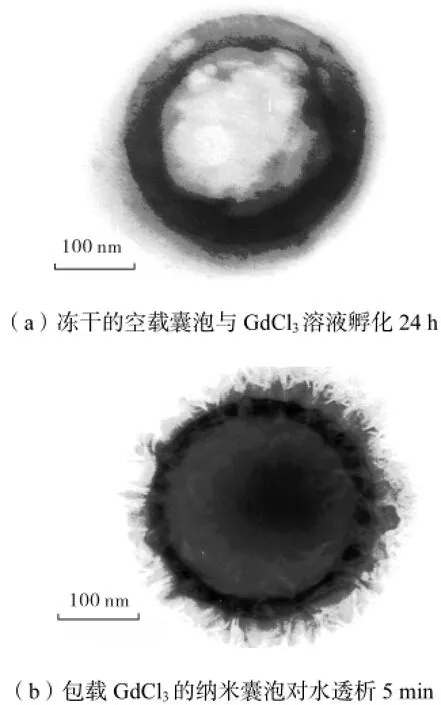
图2 GdCl3溶液处理后的PDLLA/Chol-DEX纳米囊泡的透射电镜照片Fig.2 TEM images of PDLLA/Chol-DEX nanocapsules treated with GdCl3solution
前期研究[9]表明,PDLLA/Chol-DEX纳米囊泡在透析4,h时初步形成,此时纳米囊泡壁尚未完全固化,TEM制样对纳米囊的扰动可使部分纳米囊泡破裂,因此选择在此时间点以GdCl3溶液代替去离子水,TEM观察表明GdCl3进入了纳米囊内核,形成了包载GdCl3的纳米囊泡(图1(c)).热失重分析也进一步证明了GdCl3纳米囊泡的形成.图3是PDLLA/ Chol-DEX纳米囊泡、GdCl3和包载GdCl3纳米囊泡的热失重曲线.如图3所示,空载纳米囊泡开始失重的温度为254.3,℃,这是由于PDLLA受热发生断链分解,温度升高至300,℃,热重曲线发生明显转折,这主要是由于PDLLA的热分解速率减慢,此时Dextran受热开始分解[19-20],温度升高至600,℃时热分解基本完成,最终失重率为90.4%;GdCl3开始失重温度为131.3,℃,最终失重为33.6%;纳米囊泡包载GdCl3后,热失重曲线与GdCl3相似,在131.3,℃有明显的热失重,最终失重率减为68.8%,说明GdCl3已经成功包载进囊泡中.然而样品的初始失重温度为58.4,℃,这可归结为囊泡中包载的GdCl3冻干后以六水合氯化钆(GdCl3·6,H2O)的形式存在,在此温度下氯化钆失去结合水.
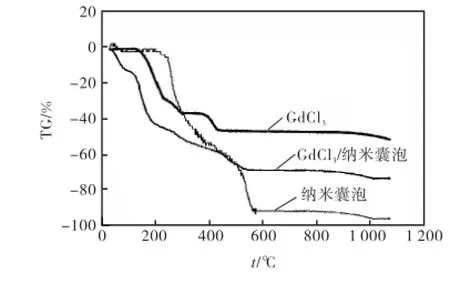
图3 PDLLA /Chol-DEX纳米囊泡、GdCl3和包载GdCl3纳米囊泡的热失重曲线Fig.3TG curves of PDLLA/Chol-DEX nanocapsules,GdCl3,GdCl3-loaded nanocapsules
将对GdCl3溶液透析后的纳米囊泡立即对头孢拉定溶液反透析,得到载药纳米囊泡的TEM照片如图1(d)所示,纳米囊既没有空载纳米囊泡的中空结构,也没有GdCl3纳米囊泡的全实心形貌,但仍呈现明显的核壳结构.以超声破碎载药纳米囊并反复提取所载药物后得到药物的载药率为8.1%,与纳米囊泡和头孢拉定简单孵育所得的表面吸附头孢拉定的微囊样品相比(载药率1.7%),载药率明显提高.
为分析载药过程,以TEM对GdCl3纳米囊泡在水中的形貌进行观察,可以发现GdCl3向外渗透在纳米囊壁上形成很多微孔(图2(b)),这可能是由于纳米囊泡内部存在高浓度盐使内外存在高的渗透压,使纳米囊壁易于形成泄漏孔道.由于疏水性聚乳酸骨架的存在,GdCl3的泄漏并不易使纳米囊泡完全破裂.由GdCl3形成的微孔成为药物进入纳米囊泡内核的通道,而由GdCl3产生的纳米囊泡内外渗透压差或离子强度差也使药物易于向纳米囊内核扩散,提高纳米囊对药物的包载率.
GdCl3和药物的包载增大了PDLLA/Chol-DEX纳米囊泡的水合动力学粒径,空载PDLLA/Chol-DEX纳米囊泡的平均水合动力学半径为228,nm,当包载GdCl3和头孢拉定后纳米囊泡的水合动力学粒径分别增大到252,nm和284,nm(见图4),这可能与亲水性物质进入纳米囊泡引起的渗透压使纳米囊泡溶胀有关.
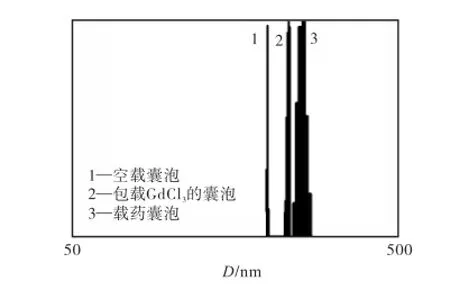
图4 PDLLA /Chol-DEX纳米囊泡的水合动力学粒径Fig.4 Kinetic diameter of PDLLA/Chol-DEX nanocapsules
在模拟体液环境中分析纳米囊的药物释放,并以表面吸附药物的纳米囊样品为对照,结果如图5所示.药物从纳米囊表面的解吸附是一个非常快速的过程,在2,h内近80%的药物从纳米囊泡表面脱附.与此相比,内核载药的纳米囊泡显示出缓释特性,前3,h释放所载药物的45%,这归结于纳米囊表面吸附药物的快速解吸附以及由载药体系内外浓度差造成的突释效应.在随后的24,h内药物逐步缓释,在24,h内释放所载药物的95.8%.

图5 药物头孢拉定从PDLLA/Chol-DEX纳米囊泡中的释放行为Fig.5 Cefradine release profile from PDLLA/Chol-DEX nanocapsules
载药PDLLA微囊泡的这种药物释放特点与其传统的载药微球有着很大的不同,其突释效应更强,释放速率更快,释放周期短,这可能与纳米囊壁具有较强的通透性有关,当然也与亲水性药物在外水相中的溶解度相关,通过选择不同的微囊组成材料可以实现对药物释放速率的调控.
3 结 语
由于聚乳酸疏水层的阻碍,直接将亲水性头孢拉定与PDLLA/Chol-DEX纳米囊泡孵育难以将药物包封至纳米囊内核.在透析过程中以GdCl3水溶液代替去离子水可以得到包载GdCl3的纳米囊,将此纳米囊对头孢拉定溶液反透析,由于GdCl3渗透导致纳米囊壁形成微孔道,使亲水性药物通过浓度差和渗透压作用进入纳米囊.亲水性药物在纳米囊中显示出缓释特性.由于PDLLA/Chol-DEX纳米囊泡具有较小的粒径,包载GdCl3和亲水性药物使其成为具有良好生物相容性和生物可降解性的潜在的核磁成像剂和亲水性药物释放载体.
[1] Antonietti M,Förster S. Vesicles and liposomes:A self-assembly principle beyond lipids[J]. Advanced Materials,2003,15(16):1323-1333.
[2] Uchegbu I F,Schätzlein A G,Tetley L,et al. Polymeric chitosan-based vesicles for drug delivery[J]. Journal of Pharmacy and Pharmacology,1998,50(5):453-460.
[3] Daiguji H,Takada S,Cornejo J J M,et al. Fabrication of hollow poly(lactic acid)microcapsules from microbubble templates[J]. The Journal of Physical Chemistry B,2009,113(45):15002-15009.
[4] An Zhihua,Möhwald H,Li Junbai. pH controlled permeability of lipid/protein biomimetic microcapsules[J]. Biomacromolecules,2006,7(2):580-585.
[5] Pastorino L,Erokhina S,Caneva-Soumetz F,et al. Paclitaxel-containing nano-engineered polymeric capsules towards cancer therapy[J]. Journal of Nanoscience and Nanotechnology Research Gate,2009,9(11):6753-6761.
[6] Yang Xiaoying,Chen Liting,Huang Bo,et al. Synthesis of pH-sensitive hollow polymer microspheres and their application as drug carriers[J]. Polymer,2009,50(15):3556-3563.
[7] Ivanov A I,Christodoulou J,Parkinson J A,et al. Cisplatin binding sites on human albumin[J]. The Journal of Biological Chemistry,1998,273(24):14721-14730.
[8] Møller C,Tastesen H S,Gammelgaard B,et al. Stability,accumulation and cytotoxicity of an albumincisplatin adduct[J]. Metallomics,2010,2(12):811-818.
[9] Long Lixia,Yuan Xubo,Chang Jiang,et al. Selfassembly of polylactic acid and cholesterol-modif i ed dextran into hollow nanocapsules[J]. Carbohydrate Polymers,2012,87(4):2630-2637.
[10] Elbert R,Laschewsky A,Ringsdorf H. Hydrophilic spacer groups in polymerizable lipids:Formation of biomembrane models from bulk polymerized lipids[J]. Journal of the American Chemical Society,1985,107(14):4134-4141.
[11] Holowka E P,Pochan D J,Deming T J. Charged polypeptide vesicles with controllable diameter[J]. Journal of the American Chemical Society,2005,127(35):12423-12428.
[12] Zhao Qinghe,Han Baosan,Wang Zhaohai,et al. Hollow chitosan-alginate multilayer microcapsules as drug delivery vehicle:Doxorubicin loading and in vitro and in vivo studies[J]. Nanomedicine:Nanotechnology,Biology and Medicine,2007,3(1):63-74.
[13] Atkin R,Davies P,Hardy J,et al. Preparation of aqueous core/polymer shell microcapsules by internal phase separation[J]. Macromolecules,2004,37(21):7979-7985.
[14] Zhu Jintao,Jiang Ying,Liang Haojun,et al. Selfassembly of ABA amphiphilic triblock copolymers into vesicles in dilute solution[J]. The Journal of Physical Chemistry B,2005,109(18):8619-8625.
[15] Wang Yajun,Hosta-Rigau L,Lomas H,et al. Nanostructured polymer assemblies formed at interfaces:Applications from immobilization and encapsulation to stimuli-responsive release[J]. Physical Chemistry Chemical Physics,2011,13(11):4782-4801.
[16] Mu Minfang,Ning Fanglin,Jiang Ming,et al. Giant vesicles based on self-assembly of a polymeric complex containing a rodlike oligomer[J]. Langmuir,2003,19(24):9994-9996.
[17] Uchida T,Yoshida K,Goto S. Preparation and characterization of polylactic acid microspheres containing water-soluble dyes using a novel W/O/W emulsion solvent evaporation method[J]. Journal of Microencapsulation,1996,13(2):219-228.
[18] Tiourina O P,Antipov A A,Sukhorukov G B,et al. Entrapment of α-chymotrypsin into hollow polyelectrolyte microcapsules[J]. Macromolecular Bioscience,2001,1(5):209-214.
[19] Nampoothiri K M,Nair N R,John R P. An overview of the recent developments in polylactide(PLA) research [J]. Bioresource Technology,2010,101(22):8493-8501.
[20] Sufleta D M,Chitanua G C,Desbrièresb J. Phosphorylated polysaccharides(Part 2):Synthesis and properties of phosphorylated dextran[J]. Carbohydrate Polymers,2010,82(4):1271-1277.
Polylactic Acid/Amphiphilic Dextran Hollow Capsules for Hydrophilic Drug Loading and Release
Long Lixia1,2,Yuan Xubo1,2,Qian Xiaomin1,2,Liu Chaoyong1,2,Zhang Zhihua1,2,Sheng Jing1,2
(1. School of Material Science and Engineering,Tianjin University,Tianjin 300072,China;2. Tianjin Key Laboratory of Composite and Functional Materials,Tianjin 300072,China)
Loading of hydrophilic drug is a challenge for the preparation of sustained release nanoparticles. In the present study, hollow capsules were prepared by dialysis-induced self-assembly of PDLLA and cholesterol-modified dextran. By replacing aqueous with GdCl3solution during dialysis, GdCl3was loaded into the aqueous core of hollow capsules and led to the formation of micro-channels on the wall of hollow capsules, which was confirmed by TEM observation and TG analysis. Those micro-channels facilitated the diffusion of hydrophilic drug into the aqueous core during reverse dialysis, and GdCl3capsules against cephradine solution were then obtained. The release of cephradine from capsules lasted for over 24,h, demonstrating the sustained release feature of the drug-loaded capsules.
polylactic acid;amphiphilic dextran;hollow capsule;hydrophilic drug;sustained release
文献标志码:A 文章编号:0493-2137(2013)06-0510-06
DOI 10.11784/tdxb20130607
2012-01-12;
2012-06-06.
国家自然科学基金资助项目(51073118);教育部新世纪优秀人才支持计划资助项目(NCET-08-0393).作者简介:龙丽霞(1986— ),女,工程师,lixialong@tju.edu.cn.
原续波,xbyuan@tju.edu.cn.

