基于微透析的组织液中葡萄糖浓度连续检测方法
栗大超,王日东,刘 宇,徐可欣
基于微透析的组织液中葡萄糖浓度连续检测方法
栗大超,王日东,刘 宇,徐可欣
(天津大学精密仪器与光电子工程学院,天津 300072)
基于微创血糖检测中需要对组织液中葡萄糖浓度进行校准的要求,提出了一种利用微透析连续检测组织液中葡萄糖浓度的方法,研究了灌流速度、被测液浓度和温度等条件对回收率的影响.实验结果表明,灌流速度从0.3,µL/min上升到3.0,µL/min时,回收率下降71.7%;组织液浓度变化对回收率没有明显影响,温度从25,℃上升到58,℃时,回收率则上升34.6% .此外,提出了一种模拟体内葡萄糖浓度连续变化的方法,并建立了实验系统,验证了微透析方法在葡萄糖浓度连续变化条件下用于组织液葡萄糖检测的可行性.为进一步开展动物实验提供了理论基础和实验依据.
组织液;葡萄糖;微透析;连续检测;校准
糖尿病是一种严重危害人类健康的疾病,连续血糖检测在临床上有着十分重要的意义.目前根据检测方法对人体的损伤程度,血糖浓度检测方法可以分为3类:有创检测、无创检测和微创检测.有创血糖检测技术无法避免对患者的创伤,很难实现连续检测;无创血糖检测方法依靠光与人体特定部位组织的相互作用来检测人体内血糖浓度的变化[1],由于生物个体差异性大、信号提取困难以及生理和测量条件难以控制等因素的制约,目前还处于研究阶段[2];微创血糖浓度检测技术是通过将传感器植入皮下或通过组织液透皮抽取的方法来测量人体组织液中葡萄糖浓度[3],再根据组织液中葡萄糖浓度与血液中葡萄糖浓度的关系得到血液中葡萄糖浓度.微创血糖浓度检测在最大限度地降低对人体造成创伤的基础上,可实现人体血糖浓度的动态、连续监测,技术原理相对简单,具有可实现性更强、使用方便、响应时间短等特点,能满足糖尿病人血糖浓度检测的临床需要,具有重要的应用价值和商业前景[4].
目前利用微创血糖检测技术检测组织液葡萄糖浓度主要有2种方法:①将组织液透皮抽取到体外进行检测;②在皮下植入传感器直接检测组织液浓度[5].前者由于抽取的组织液量很小,往往需要经过稀释才有利于收集和测量,测得的不是组织液葡萄糖浓度的真实值;后者则受到体内生物电或化学物质的干扰,测得结果也不是真实的组织液浓度值.这2种方法都需要用组织液中葡萄糖浓度的真实值来校准.目前如何获得这一真实值是一个世界性难题.笔者探索性地提出一种基于微透析的组织液葡萄糖检测方法,实现组织液中葡萄糖浓度的连续检测,为微创血糖检测的校准供校所需的组织液中葡萄糖浓度的真实值.
1 组织液中葡萄糖浓度的检测方法
采用微透析(microdialysis)技术检测组织液中的葡萄糖浓度,对插入皮下组织的微透析探针在非平衡条件下进行灌流,葡萄糖分子沿浓度梯度逆向扩散,穿过探针尾部的半透膜进入透析管内,并被透析管内流动的灌流液不断带出,最后对流出的透析液进行检测,进而得到组织液中葡萄糖的浓度值.这种检测方法具有连续性强、取样量小、组织创伤小等优点.
微透析是一种被动的扩散过程,可用Fick’s第一扩散定律[6]来表示,即

式中:J为单位时间内穿过半透膜的物质的分子数;D为扩散系数;A为半透膜的表面积;C为待测物质的浓度;dC/dx为半透膜内外的浓度梯度;负号表示物质扩散的方向与浓度增加的方向相反.
式(1)表明,在单位时间内通过垂直于扩散方向的单位截面的葡萄糖相对分子质量与该截面处的浓度梯度,以及实验所选用的微透析探针半透膜表面积成正比,与探针的曲率成反比.
由于微透析是在非平衡取样条件下取样,所以测得透析液中葡萄糖的浓度只是探针周围组织液中葡萄糖浓度的一部分[7],前者与后者的比值称为探针的回收率[8-9],即

式中:R表示回收率;cout和cq分别表示透析液和周围组织液中葡萄糖的量浓度,mmol/L.
相关书籍和研究文献也对微透析的过程提出了更为详细的数学模型,如Bungay等[10]提出的模型
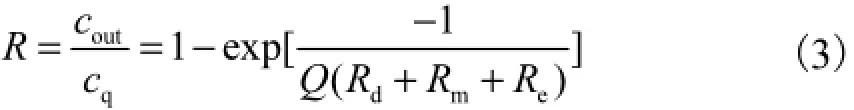
式中:Rd、Rm、Re分别表示透析液、探针半透膜、外部介质的扩散阻力;Q为微透析灌流速度. 式(3)表明,随着灌流速度增大,回收率呈指数下降趋势.
2 影响组织液中葡萄糖浓度检测的因素
搭建了一套体外微透析模拟实验系统,通过配制不同浓度的葡萄糖溶液来对微透析的检测方法进行研究,分别研究了灌流速度、葡萄糖溶液的浓度、温度等主要因素对回收率大小的影响.在此基础上建立了模拟体内葡萄糖浓度连续变化的实验系统,为进一步开展基于微透析的葡萄糖浓度检测的动物实验奠定了基础.
2.1 体外微透析模拟实验系统
体外微透析模拟实验系统主要是由微量注射泵、微透析探针、恒温水浴池和酶电极传感器组成.微量注射泵的功能是向微透析探针注射灌流液(0.9%NaCl溶液),恒温水浴池用来调节葡萄糖溶液的温度,酶电极传感器的作用是检测透析液中的葡萄糖浓度.实验所选用的探针是瑞典CMA公司的CMA20 microdialysis probe(CMA Microdialysis,Sweden),分子截留量为20,kD,膜长为10,mm,透析膜直径0.5,mm.
系统的工作过程如图1所示,灌流液由注射泵注入微透析探针的输入端,在探针尾部通过半透膜与葡萄糖溶液发生物质交换,最后经探针输出端流出,并由检测器测量透析液中的葡萄糖浓度.实验中通过改变灌流速度、温度、葡萄糖溶液浓度等条件,研究其对回收率的影响.
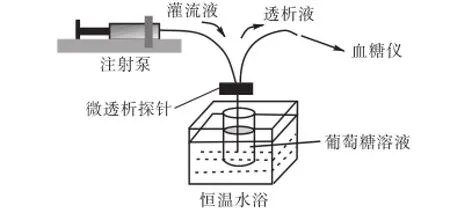
图1 体外微透析实验系统Fig.1 Experiment system of microdialysis in vitro
2.2 灌流速度对回收率的影响
灌流速度分别选用0.3,µL/min、0.5,µL/min、1.0,µL/min、1.5,µL/min、2.0,µL/min和3.0,µL/min,待测葡萄糖溶液浓度为5.3,mmol/L,环境温度为26,℃.由于探针的输出管路的体积为6,µL,分别以0.3,µL/min、1.0,µL/min、1.5,µL/min、2.0,µL/min、2.5,µL/min、3.0,µL/min和5.0,µL/min的流速进行灌流时,微透析达到平衡所需的时间分别约为20,min、6,min、4,min、3,min、2.4,min、2,min和1.2,min.达到平衡后,每5,min收集一次透析液进行测量.由此得到灌流速度与回收率的对应关系如图2所示,纵轴为葡萄糖溶液在不同灌流速度下进行微透析对应的平均回收率,每个数据点取8次测量的平均值.从图2中可以看出,随着灌流速度的增大,对应的回收率呈指数趋势不断减小.当灌流速度大于1.0,µL/min时,回收率较低,这就对传感器在低葡萄糖浓度环境下的测量提出了较高的要求.若流速低于0.5,µL/min,透析液收集速度较慢,会造成组织液检测的实时性下降.
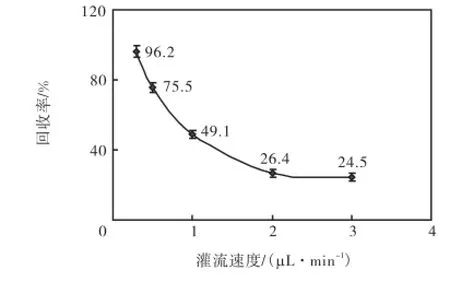
图2 灌流速度对回收率的影响Fig.2 Effect of perfusion rate on recovery rate
2.3 葡萄糖浓度对回收率的影响
分别选取浓度为3.1,mmol/L、5.3,mmol/L、8.2,mmol/L和10.3,mmol/L的葡萄糖溶液,灌流速度设定为1.0,µL/min,温度为26,℃.微透析达到平衡后,每5,min收集一次透析液进行测量,得到葡萄糖浓度与回收率的对应关系如图3所示.
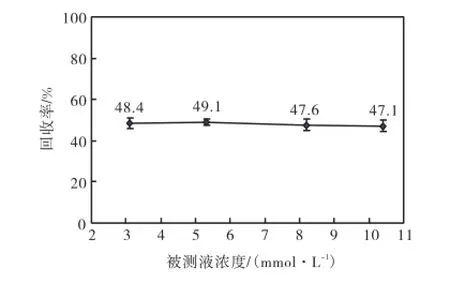
图3 葡萄糖浓度对回收率的影响Fig.3 Effect of glucose concentration on recovery rate
可以看出曲线基本与横轴平行,表明在灌流速度与温度恒定的条件下,葡萄糖溶液的浓度对回收率无明显影响.这一结果说明在其他条件稳定的情况下,对不同浓度的葡萄糖溶液进行微透析可以得到稳定的回收率,即微透析可以用于透析液浓度动态实时变化条件下的连续检测.
2.4 温度对回收率的影响
灌流速度设定为1.0,µL/min,葡萄糖溶液浓度为5.3,mmol/L,通过水浴池调节温度的变化范围为20~60,℃.每改变一次水浴温度,当待测葡萄糖溶液的温度与水浴温度平衡后再进行透析.由此得到温度与回收率的对应关系如图4所示.
实验中测得溶液温度分别为25,℃、31,℃、36,℃、42,℃、49,℃和58,℃.由图4可知,回收率随温度上升而明显增大,二者具有较好的线性相关性.此结果说明,用微透析的方法检测组织液的葡萄糖浓度应保持被测部位温度恒定,以获得稳定的回收率,实现有效校正.
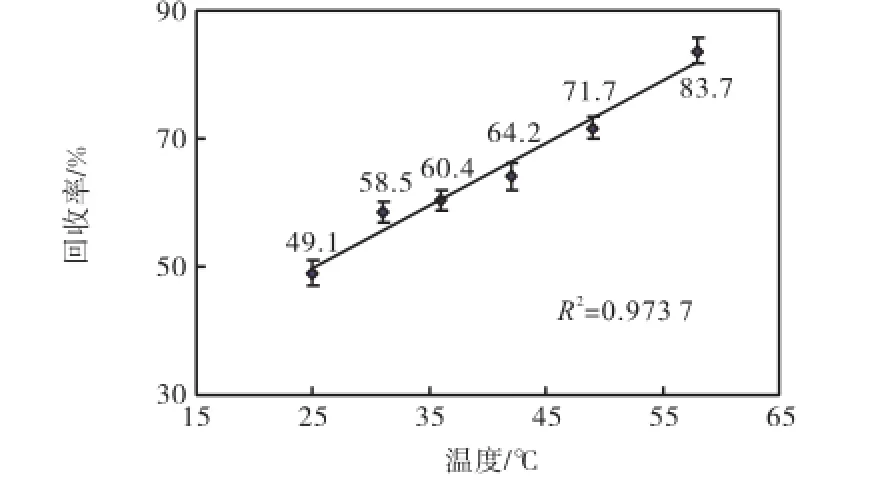
图4 温度对回收率的影响Fig.4 Effect of temperature on recovery rate
3 体内葡萄糖浓度连续变化的模拟实现
在实际应用中,随着人体正常生理活动的进行,组织液中的葡萄糖浓度会发生连续变化.为此提出了一种模拟人体内组织液中葡萄糖浓度连续变化的方法,并搭建了实验系统,为开展基于微透析的葡萄糖浓度检测的动物实验奠定了基础.
3.1 系统组成
体内葡萄糖浓度连续变化的模拟实验系统如图5所示.该系统由注射泵、微透析探针、蠕动泵、混合腔、通道阀和葡萄糖传感器等器件组成.2台蠕动泵分别用于抽取葡萄糖溶液和缓冲液,使2种液体进入混合腔内,经过充分混合后由输送管输出.实验中通过调节2个蠕动泵的抽取速率来改变混合液中的葡萄糖浓度,并使它们的抽取速率之和保持恒定,以免混合液流速的变化对微透析的回收率产生影响.二选一阀门的作用是切换混合液流出的通道,实现透析液浓度和透析前混合液浓度的独立检测.
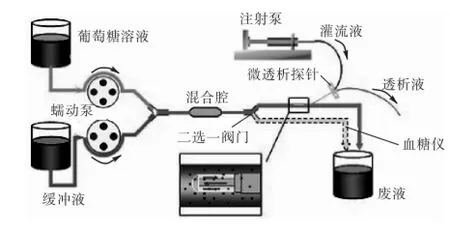
图5 模拟葡萄糖浓度连续变化的系统Fig.5 System for simulating continuous glucose concentration change
3.2 体内葡萄糖浓度连续变化的模拟检测结果
将缓冲液(0.9% NaCl溶液)与葡萄糖溶液(10.3,mmol/L)以3,mL/min的总流速按不同的比例进行混合,调整2个蠕动泵的抽取速率以改变混合液中葡萄糖的浓度,使其在0~10.3,mmol/L之间变化.
首先检测混合溶液浓度稳定所需时间.调整两个蠕动泵流速为2,007,µL/min和1,004,µL/min,浓度稳定后第1次将速度分别调为1,493,µL/min、1,520,µL/min,此时记为零时刻,然后在0.5,min、1.0,min、1.5,min、2.0,min、2.5,min、3.0,min、3.5,min、4.0,min、5.0,min、6.0,min、7.0,min、8.0,min、9.0,min和10.0,min时取样.在10,min、20,min和30,min时分别调整蠕动泵流速,并按照上述的时间间隔取样.测量结果如图6所示,可以看出蠕动泵流速发生变化时,混合液浓度会迅速发生变化,2,min后即可达到稳定状态.
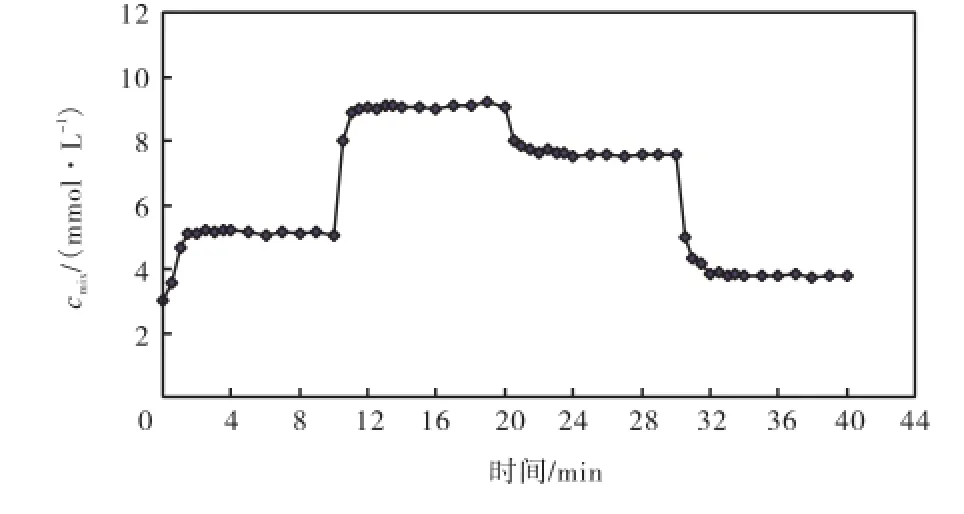
图6 混合液浓度与混合时间的关系Fig.6 Relationship between mixture concentration and time
之后,对浓度连续变化的溶液进行微透析取样检测,灌流速度选择1.0,µL/min,温度为20,℃,混合溶液流速3,mL/min.考虑到微透析探针的延时以及葡萄糖溶液和缓冲液混合均匀所需的时间,确定在调整蠕动泵流速后的8,min时测量透析液浓度,随即对透析前的混合液取样并检测.透析液与透析前的混合液的独立取样通过切换二通阀实现,按照调速→透析液取样→切换通道→透析前的混合液取样这样的顺序进行.上述过程共进行7次.
如图7所示,带有方形标记的是不同浓度下多次测量的平均值,以此来得到拟合的直线.之后又按照同样的步骤测量16次,用图7中拟合曲线的方程校正透析液浓度值,可得到浓度校正曲线,如图8所示,带有菱形标志的是透析前的混合液浓度曲线,浓度变化经历了2个由高到低再升高的过程;带有三角形标志的是校正后透析液浓度曲线,校正曲线上的对应点与混合液浓度非常接近.校正后的值与实际测得对应点的浓度值相比,误差小于5%的概率为43.75%,误差在5%~10%之间的概率为50.00%,误差大于10%的概率仅为6.25%.
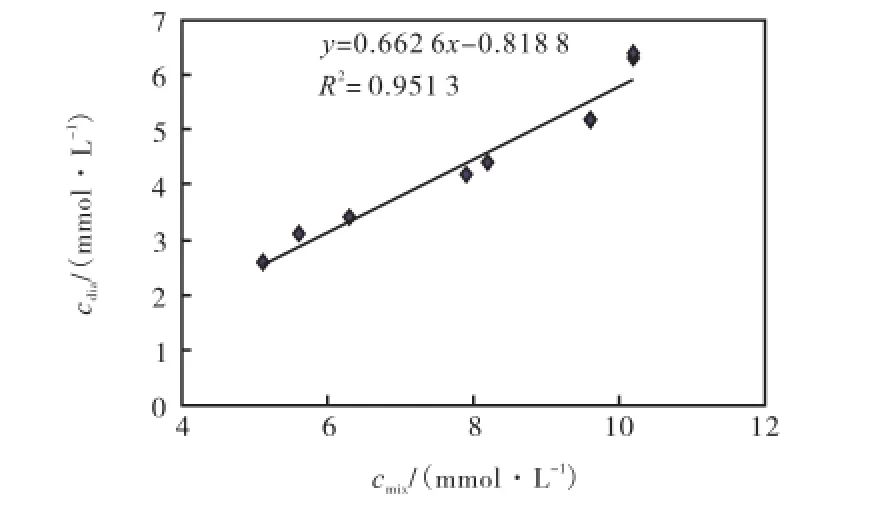
图7 混合液浓度与透析液浓度的关系Fig.7 Concentration relationship between mixture and dialysate
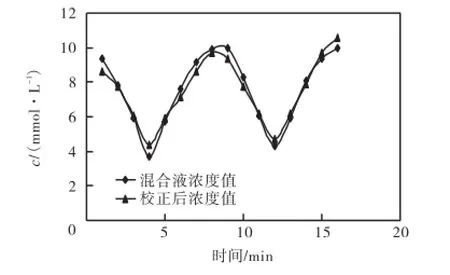
图8 微透析测量的校正Fig.8 Microdialysis calibration
4 结 论
(1) 灌流速度对微透析探针的回收率影响显著,选择1.0,µL/min时回收率可以满足实际需求.
(2) 浓度对回收率无明显影响.
(3) 温度上升使得回收率不断增大,应维持检测部位的温度恒定.
(4) 实验结果具有较好的重复性.
在此基础上,提出了一种模拟人体组织液葡萄糖浓度连续变化的方法,并搭建了实验系统,验证了微透析用于体内浓度连续变化条件下的可行性,所得数据表明校正后浓度值与混合液测得值之间误差小于10%的概率为93.75%.此研究取得的成果为下一步开展动物实验奠定了基础.
[1] 蒋景英,龚启亮,徐可欣,血液成分无创光学检测中浮动基准理论的适用性[J]. 纳米技术与精密工程,2012,10(2):142-146.
Jiang Jingying,Gong Qiliang,Xu Kexin. Availability of floating-reference theory to non-invasive blood component measurement by optical technology [J]. Nanotechnology and Precision Engineering,2012,10(2):142-146(in Chinese).
[2] 高昌浩.人体葡萄糖无创性检测进展[J]. 当代医学,2009,15(13):20-22.
Gao Changhao.Noninvasive detection of human progress glucose[J]. Contemporary Medicine,2009,15(13):20-22(in Chinese).
[3] 伍 鹏,栗大超,杨 佳,等,基于表面等离子共振GGBP胺耦合绑定的葡萄糖浓度测量影响因素[J]. 纳米技术与精密工程,2012,10(5):445-450.
Wu Peng,Li Dachao,Yang Jia,et al. Influencing factors in glucose concentration detection by surface plasmon resonance with GGBP amine coupling[J]. Nanotechnology and Precision Engineering,2012,10(5):445-450(in Chinese).
[4] 王会清,骆清铭. 人体血糖微创和无创伤快速检测方法[J]. 现代仪器,2006,12(6):1-6.
Wang Huiqing,Luo Qingming. Minimally invasive and non-invasive method for rapid monitoring of human blood glucose[J]. Modern Instruments,2006,12(6):1-6(in Chinese).
[5] 于海霞.关于组织液抽取和血糖连续检测的研究[D]. 天津:天津大学精密仪器与光电子工程学院,2007.
Yu Haixia. Research of Tissue Fluid Extraction and Continuous of Blood Glucose Detection [D]. Tianjin:School of Precision Instrument and Opto-Electronics Engineering,Tianjin University,2007(in Chinese).
[6] Stagni Grazia,O’Donnell Dermot,Liu Yanjuan,et al. Iontophoretic current and intradermal microdialysis recovery in humans [J]. Pharmacol Toxicol,1999,41(1):49-54.
[7] Ekberg N R,Wisniewski N,Brismar K,et al. Measurement of glucose and metabolites in subcutaneous adipose tissue during hyperglycemia with microdialysis at various perfusion flow rates [J]. Clinica Chimica Acta,2005,359(1/2):53-64.
[8] Jan Kehr. A survey on quantitative microdialysis:Theoretical models and practical implications [J]. Journal of Neuroscience Methods,1993,48(3):251-261.
[9] Cunningham D D,Stenken J A. In Vivo Glucose Sensing[M]. New York:John Wiley and Sons,2010.
[10] Bungay P M,Morrison P F,Dedrick R L. Steady-state theory for quantitative microdialysis of solutes and water in vivo and in vitro [J]. Life Sciences,1990,46(2):105-119.
A Method for Continuous Glucose Monitoring in Interstitial Fluid Based on Microdialysis
Li Dachao,Wang Ridong,Liu Yu,Xu Kexin
(School of Precision Instrument and Opto-Electronics Engineering,Tianjin University,Tianjin 300072,China)
A method based on microdialysis was presented to monitor glucose concentration in interstitial fluid to meet the requirement that the glucose concentration in interstitial fluid should be calibrated in minimally invasive blood glucose monitoring, and the influences of perfusion rate, concentration and temperature on the recovery rate of microdialysis were studied. The results led to the conclusion that the recovery rate fell by 71.7% when perfusion rate increased from 0.3 µL/min to 3.0 µL/min, different concentrations of interstitial fluid contributed little to the recovery rate, and the rise of temperature from 25 ℃ to 58 ℃ caused the recovery rate to increase by 34.6%. In addition, a method for simulating the rapid changes in glucose concentration in vivo was proposed, and the experimental system was established to verify the feasibility of continuous measurement of glucose level in interstitial fluid by microdialysis. All the work laid a theoretic foundation and experimental guidance for animal clinical trials in the future.
interstitial fluid;glucose;microdialysis;continuous monitoring;calibration
TH776
A
0493-2137(2013)06-0482-05
DOI 10.11784/tdxb20130602
2012-09-16;
2012-12-16.
国家自然科学基金资助项目(61176107);国家高技术研究发展计划(863计划)资助项目(2012AA022602);天津市科技支撑计划重点基金资助项目(11ZCKFSY01500).
栗大超(1976—),男,博士,副教授.通讯作者:栗大超,dchli@tju.edu.cn.

