斑点追踪成像评价心脏淀粉样变性患者左心室心肌分层应变
心脏淀粉样变性(CA)是不可溶性的淀粉样蛋白对心肌间质和血管周围的渗透性浸润过程[1],进而导致心肌运动障碍。CA是一种罕见疾病,病死率高,临床表现无特异性,给诊断带来了极大的困难。超声二维斑点追踪(2D-STI)是近年来心脏超声研究的热点,其无角度依赖性,能测量心脏短轴及长轴各节不同形式运动的应变,能够细致地评价左心室心肌功能。目前国内外尚无采用2D-STI研究CA患者左心室内外膜下心肌应变的报道。本研究旨在探讨CA患者左心室内膜下、外膜下及整体心肌应变的特点,以及采用STI技术评价CA患者左心室心肌收缩功能的价值。
1 资料与方法
1.1 研究对象 2009-01~2012-11中国医科大学附属盛京医院经超声及心外活检确诊的20例CA患者,其中男13例,女7例;年龄42~65岁,平均(54.80±7.76)岁。诊断标准:所有患者均有心脏受累的临床症状,均有典型的CA超声心动图表现[左心室心肌明显增厚(>13 mm),伴或不伴右心室心肌增厚(>8 mm),心肌内可见闪烁颗粒样回声],且均经心外活检证实为淀粉样变性,活检部位:皮肤9例,舌体组织4例,肾4例,牙龈2例,膀胱1例。排除高血压、肥厚型心肌病、肾脏疾病引起的继发性心肌肥厚、房颤或其他严重心律失常、冠心病、中至重度瓣膜疾病、糖尿病及其他疾病所致心脏器质性病变。选择与CA组年龄、性别匹配的30例健康志愿者作为对照,其中男性18例,女性12例;年龄45~62岁,平均(54.85±3.72)岁,均经体格检查、实验室检查、心电图及超声心动图检查排除糖尿病、冠心病等器质性心血管疾病。
1.2 仪器与方法 采用Philips iE33彩色多普勒超声诊断仪,S5-1探头,频率1~3 MHz,帧频(65±7)帧/s。受检者取左侧卧位,平静呼吸,同步记录心电图,行常规超声心动图检查:标准左心室长轴观测量收缩末期左心房内径(LAESd)、舒张末期左心室内径(LVEDd)、舒张末期室间隔厚度(IVSd)、舒张末期左心室后壁厚度(LVPWDd);显示心尖四腔观,采用脉冲多普勒测量二尖瓣口舒张早期血流峰速(E)、舒张末期血流峰速(A)、E波速度下降时间(DT);采用双平面Simpson法测量左心室射血分数(LVEF)。于TDI条件下记录二尖瓣环室间隔侧运动频谱,测量收缩期运动速度(s)、舒张早期运动速度(e)、舒张晚期运动速度(a),计算E/e值。待图像显示清晰稳定后,分别采集心率一致的二尖瓣、乳头肌和心尖水平左心室短轴二维灰阶动态图(帧频60~70帧/s)各5个心动周期,并存储图像。50例受检者均成功采集短轴平面的3个二维灰阶动态图像。
1.3 图像分析 采用Qlab 8.1工作站,进入TMQ Advanced斑点追踪软件程序,软件系统自动将左心室壁分为心内膜下感兴趣区和心外膜下感兴趣区,分别对二尖瓣、乳头肌、心尖3个左心室短轴水平的内膜下、外膜下和整体心肌进行斑点追踪分析,系统自动显示各平面内膜下、外膜下及整体心肌的应变曲线及与心动周期对应的心肌应变值,记录各短轴平面内膜下、外膜下及整体心肌的收缩期圆周应变(CS)峰值和收缩期径向应变(RS)峰值,将连续3个心动周期应变峰值的均值作为心肌收缩期应变峰值;计算左心室短轴3个水平内膜下、外膜下心肌收缩期应变峰值的平均值作为左心室内膜下、外膜下心肌的整体收缩期应变峰值。
1.4 统计学方法 采用 SPSS 17.0软件,组间心脏基础指标、各平面内膜下、外膜下及整体心肌应变峰值比较采用独立样本t检验,组内内膜下、外膜下心肌应变比较采用配对t检验,组间性别比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 超声参数比较 两组年龄、性别比差异均无统计学意义(P>0.05),与对照组比较,CA组IVSd、LVPWDd、LAESd、E/A、E/e值均明显增高,差异有统计学意义(t=10.32、11.16、8.15、3.68、9.29,P<0.01)。LVEF、A、DT、s、e、a值明显减低,差异有统计学意义(t=-3.04、-3.79、-4.88、-8.53、-11.36、-8.67,P<0.01);LVEDd、E 值差异无统计学意义(t=0.88、0.02,P>0.05),见表 1。
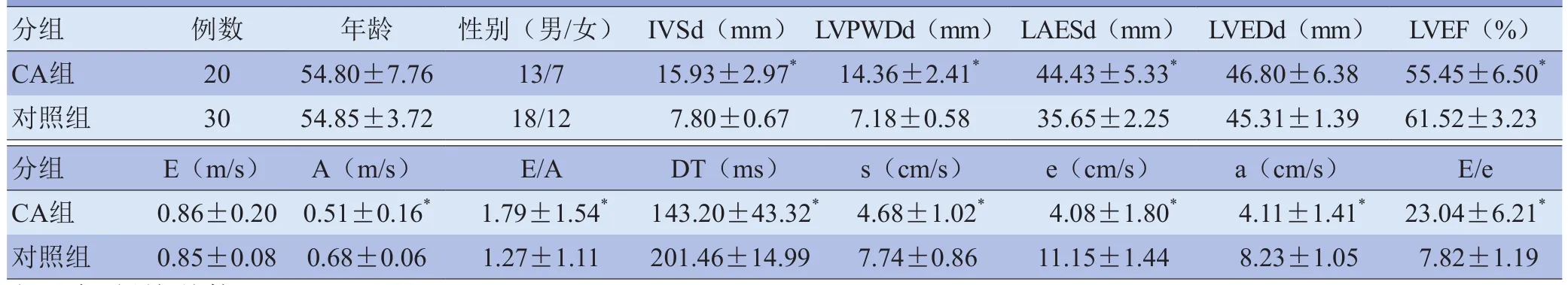
表1 CA组与对照组基础资料及常规超声参数比较
2.2 左心室各短轴平面收缩期内膜下心肌、外膜下心肌CS峰值比较 CA组左心室短轴内外层心肌在心动周期中的CS曲线与对照组相似,均为负向峰值曲线(图1)。左心室短轴3个水平及左心室整体,CA组和对照组内膜下心肌收缩期CS峰值高于外膜下心肌(CA组:t=-8.20、-12.69、-9.71、-13.14;对照组:t=-14.20、-16.81、-11.17、-16.04,P<0.001)。与对照组比较,CA组左心室短轴3个水平内膜下、外膜下心肌收缩期CS峰值均显著低于对照组(内膜下:t=8.85、8.86、7.05;外膜下:t=10.34、9.84、7.75,P<0.001);左心室整体内膜下、外膜下心肌收缩期CS峰值均显著低于对照组(t=9.20、10.31,P<0.001),见表 2。
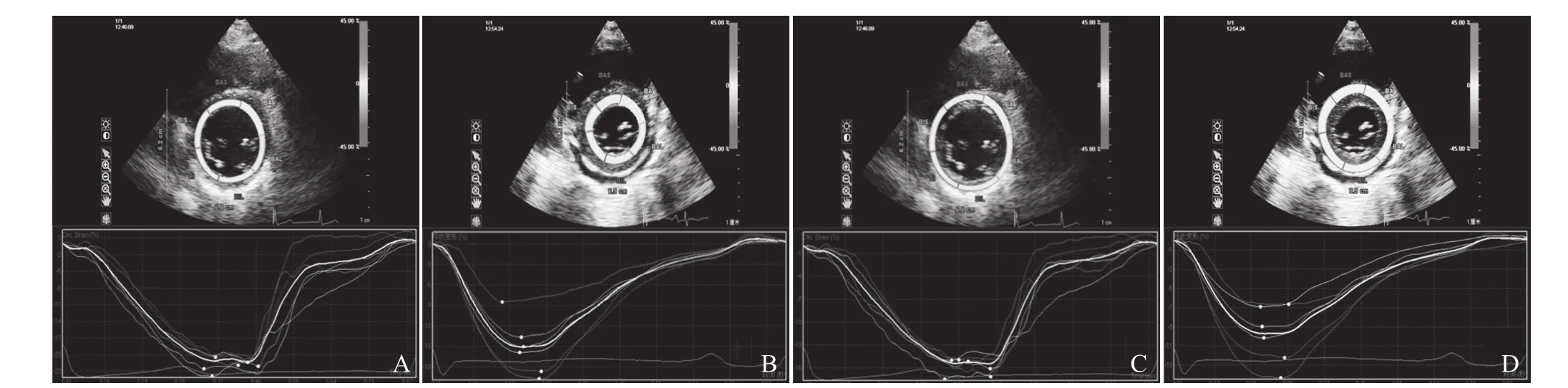
图1 A、B分别为对照组与CA组左心室基底段内膜下心肌圆周应变;C、D分别为对照组与CA组左心室基底段外膜下心肌圆周应变。两组基底水平内膜下、外膜下心肌圆周应变曲线形态基本一致,均收缩末达峰值,峰值为负,但CA组曲线波幅较大,峰值较对照组低
2.3 左心室各短轴平面收缩期内膜下心肌、外膜下心肌RS峰值比较 CA组左心室短轴内外层心肌在心动周期中的RS曲线与对照组相似,均为正向峰值曲线(图2)。对照组左心室短轴3个水平及左心室整体内膜下心肌收缩期RS峰值高于外膜下心肌(t=10.32、7.48、6.26、12.25,P<0.001),CA组内膜下心肌收缩期RS峰值均低于外膜下心肌(t=-2.61、-5.25、-4.06、-6.19,P<0.05)。与对照组比较,CA组左心室短轴3个水平(内膜下:t=-17.46、-15.48、-10.24;外膜下:t=-7.89、-12.41、-7.54,P<0.001)及整体(t=-16.41、-9.81,P<0.001)内膜下、外膜下心肌收缩期RS峰值均显著低于对照组,见表2。

表2 CA组与对照组左心室短轴各水平内膜下、外膜下心肌收缩期CS峰值及RS峰值比较
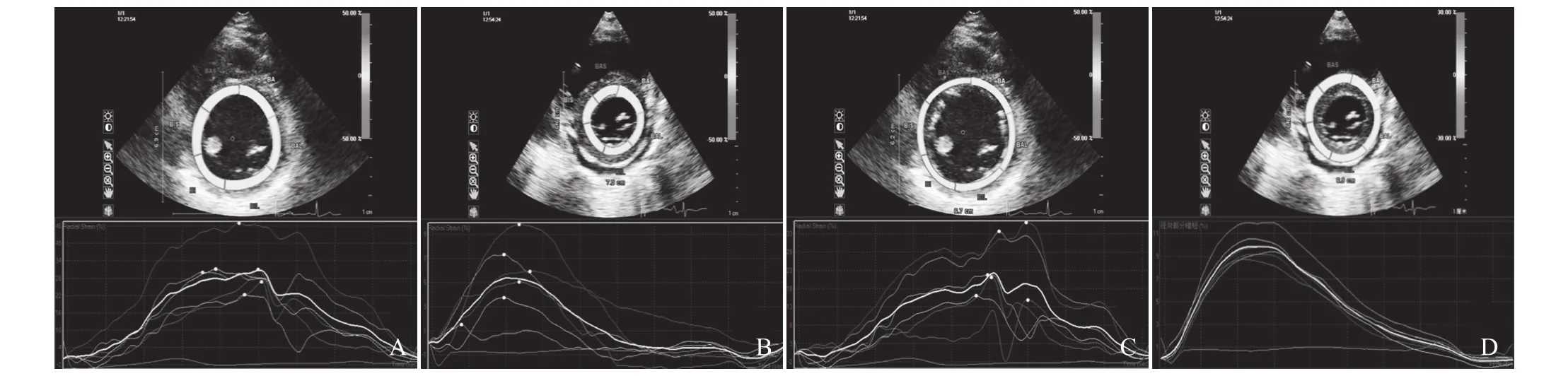
图2 A、B分别为对照组与CA组左心室基底段内膜下心肌径向应变;C、D分别为对照组与CA组左心室基底段外膜下心肌径向应变。两组基底水平内膜下、外膜下心肌径向应变曲线形态基本一致,均收缩末达峰值,峰值为正,但CA组曲线波幅较大,峰值较对照组低
2.4 左心室各短轴平面整体心肌收缩期CS、RS峰值比较 CA组左心室短轴整体心肌在心动周期中的CS、RS曲线与对照组相似,CS为负向峰值曲线;RS为正向峰值曲线(图3)。与对照组相比,CA组左心室短轴3个水平整体心肌收缩期CS、RS峰值均显著低于对照组(CS:t=9.37、6.03、7.82;RS:t=-9.99、-12.46、 -6.33,P<0.001),见表 3。

表3 CA组与对照组左心室各水平整体心肌收缩期CS、RS峰值比较
图3 A、B分别为对照组与CA组左心室基底段整体心肌圆周应变;C、D分别为对照组与CA组左心室基底段整体心肌径向应变。两组基底水平整体心肌圆周及径向应变曲线形态基本一致,均收缩末达峰值,圆周应变峰值为负,径向应变为正,但CA组曲线波幅较大,峰值较对照组低
3 讨论
心肌细胞大约占据25%的心肌结构空间,剩余75%的空间由细胞外基质构成,基质的正常活动对于维持心肌细胞与细胞力耦合和正常的心肌功能至关重要。不溶于组织的淀粉样蛋白主要聚集在细胞外基质[1,2],淀粉样蛋白可替代、挤压正常组织,造成组织细胞损伤,影响基质的运转,导致对心肌运动的束缚,进而心脏顺应性下降。在疾病发展初期出现舒张功能异常,随着疾病的进一步发展,收缩功能也可能下降,逐渐表现出类似限制性心肌病的改变。
既往研究多采用组织多普勒技术评价CA心肌运动[3],但由于其角度依赖性,仅能量化心肌长轴方向应变,无法精确描述心脏短轴方向的心肌运动变化。STI能识别并连续追踪二维超声灰阶图形,除长轴的纵向运动,可对心脏短轴的径向及圆周运动进行评估[4,5],同时可以很好地对心尖段心肌的运动进行研究[6],无角度依赖地评价心肌运动。不同时期淀粉样蛋白对心脏浸润的病理状态,内膜下和外膜下心肌功能减退程度不一致[7,8],故需对内外膜下心肌的收缩运动分别进行研究。本研究首次应用STI技术评价CA患者左心室内膜下心肌和外膜下心肌圆周及径向收缩期峰值应变。
本研究结果显示,与对照组相比,CA组左心室短轴二尖瓣、乳头肌、心尖水平内膜下、外膜下及整体心肌收缩期CS、RS峰值均较对照组显著减低;左心室短轴整体内膜下、外膜下心肌收缩期CS、RS峰值均较对照组显著减低,表明CA患者左心室整体及内外膜下心肌的收缩功能受损,其原因可能为:①由于其不可溶性,淀粉样蛋白替代、挤压正常心肌组织,破坏其正常的结构和功能。②沉积的淀粉样蛋白与心肌细胞微环境的相互作用:如淀粉样蛋白可以直接引起心肌细胞内氧化负荷加重和氧化还原状态改变,影响心肌细胞对钙离子(Ca2+)的处理[2];通过渗入和扩大导致心肌细胞代谢障碍,直接激活细胞内的受体,引起细胞水肿[9],淀粉样前体蛋白对心肌的直接毒性作用[10],均直接导致心肌细胞的收缩和舒张障碍。③CA患者冠状动脉整体储备功能减退,淀粉样蛋白能涉及整个循环系统,包括心外膜和心肌内的冠状动脉[11],CA患者心肌对血供的需求和心脏血供不匹配,以致造成心肌慢性缺血。④随着疾病的进展,CA患者心室腔呈渐进性扩大,左心室形态由正常的类椭圆形向类球形发展,心室发生重构,导致左心室收缩功能减退。
本研究结果还表明,与对照组比较,CA组患者内膜下心肌CS、RS的减低程度较外膜下心肌更为严重,表明CA患者内膜下心肌收缩功能减低程度更严重,其原因可能是更高程度的淀粉样蛋白在心内膜下心肌聚集,内膜下心肌收缩性下降更显著。Hosch等[7]对CA进行解剖病理学与心脏磁共振增强显像(CMR)的对照研究发现,受淀粉浸润的异常心肌以内膜下心肌为主,本研究与其研究结果一致。淀粉样蛋白对心肌的浸润是从内膜下心肌逐渐向外膜下心肌扩散的过程,最终形成对心肌弥漫性浸润,即形成淀粉样蛋白对心肌浸润的内外膜通路(“endo-epicardial route”)[12]。
正常内膜下心肌与外膜下心肌应变之间具有梯度特征,即内膜下心肌的运动幅度比外膜下心肌大,梯度的存在可能与内、外膜下心肌曲率半径不同导致局部张力不同有关[13]。本研究结果显示,CA组内膜下心肌收缩期CS峰值高于外膜下心肌,内膜下心肌收缩期RS峰值低于外膜下心肌,其原因可能是由于淀粉样蛋白以内膜下心肌浸润为主[7],导致心内膜下心肌纤维较心外膜收缩力下降明显,由于径向应变是维持心脏的收缩功能最大、最重要的成分,病理状态下RS可早于CS发生异常[14],即造成处于代偿期的内膜下心肌收缩期CS峰值仍高于外膜下心肌,内膜下心肌收缩期RS峰值却低于外膜下心肌;也可能与病例数过少有关,有待今后增加样本量进一步研究证实。
总之,CA患者左心室短轴收缩功能严重受损,以内膜下心肌受损为著。与常规检测射血分数评估心肌收缩功能相比,2D-STI通过检测心肌应变参数,可以更加敏感地反映心肌收缩功能的变化;同时可检测心内膜下心肌和心外膜下心肌变形能力的差异,为临床检测病变心肌和定位病变心肌的部位提供帮助。本研究的局限性在于样本量较小,尚处于初级阶段。在后续研究中将增大样本量,进一步完善患者纵向及各节段的应变参数,并对患者进行长期随访观察,对应变参数与长期随访结果进行相关分析。
[1]Falk RH, Dubrey SW. Amyloid heart disease. Prog Cardiovasc Dis, 2010, 52(4): 347-361.
[2]Banypersad SM, Moon JC, Whelan C, et al. Updates in cardiac amyloidosis: a review. J Am Heart Assoc, 2012, 1(2): e000364.
[3]Liu D, Niemann M, Hu K, et al. Echocardiographic evaluation of systolic and diastolic function in patients with cardiac amyloidosis. Am J Cardiol, 2011, 108(4): 591-598.
[4]王巧, 李玲, 谢明星, 等. 超声二维斑点追踪显像技术评价心肌致密化不全心肌病患者左心室收缩功能. 中国医学影像技术, 2011, 27(10): 2035-2039.
[5]孙旭东, 黄子扬, 陈良龙, 等. 二维斑点追踪成像与MRI识别陈旧性心肌梗死左心室心尖各节段透壁程度对照研究.中国医学影像学杂志, 2012, 20(6): 475-480.
[6]曲冉, 任卫东, 刘爽, 等. 超声斑点追踪成像技术对心内膜弹力纤维增生症患儿左心室短轴二维应变的研究. 中国医学影像学杂志, 2012, 20(11): 842-845.
[7]Hosch W, Kristen AV, Libicher M, et al. Late enhancement in cardiac amyloidosis: correlation of MRI enhancement pattern with histopathological fi ndings. Amyloid, 2008, 15(3): 196-204.
[8]Perugini E, Rapezzi C, Piva T, et al. Non-invasive evaluation of the myocardial substrate of cardiac amyloidosis by gadolinium cardiac magnetic resonance. Heart, 2006, 92(3): 343-349.
[9]Sipe JD, Benson MD, Buxbaum JN, et al. Amyloid fibril protein nomenclature: 2010 recommendations from the nomenclature committee of the International Society of Amyloidosis. Amyloid, 2010, 17(3-4): 101-104.
[10]Shi J, Guan J, Jiang B, et al. Amyloidogenic light chains induce cardiomyocyte contractile dysfunction and apoptosis via a noncanonical p38alpha MAPK pathway. Proc Natl Acad Sci USA,2010, 107(9): 4188-4193.
[11]Bradshaw SH, Veinot JP. Cardiac amyloidosis: what are the indications for transplant? Curr Opin Cardiol, 2012, 27(2):143-147.
[12]Leone O, Longhi S, Quarta CC, et al. New pathological insights into cardiac amyloidosis: implications for non-invasive diagnosis. Amyloid, 2012, 19(2): 99-105.
[13]Götte MJ, Germans T, Rüssel IK, et al. Myocardial strain and torsion quantified by cardiovascular magnetic resonance tissue tagging studies in normal and impaired left ventricular function. J Am Coll Cardiol, 2006, 48(10): 2002-2011.
[14]Armstrong G, Pasquet A, Fukamachi K, et al. Use of peak systolic strain as an index of regional left ventricular function:comparison with tissue Doppler velocity during dobutamine stress and myocardial ischemia. J Am Soc Echocardiogr, 2000,13(8): 731-737.

